少量乙烯对甲烷爆炸危险性及反应历程的影响
罗振敏,李 逵,毛文龙,张 江,程方明,王 涛,傅 文
0 引言
以甲烷为主要成分的天然气作为一种清洁能源日益广泛地应用在工业和生活中,一直以来,由含甲烷的可燃气体引发的爆炸事故时有发生,造成严重的财产损失和人员伤亡。乙烯作为可燃气体,具有爆炸极限小、压力峰值高和危险度大等特性,若与甲烷混合会增加混合气体的活性,使得甲烷爆炸极限范围明显增大,加剧甲烷爆炸,而造成更大的危害[1]。因此,开展C2H4/CH4混合气体爆炸的研究对安全防爆具有一定指导意义。
目前,国内外学者主要对初始条件、点火能量、障碍物存在、惰性及部分可燃性气体等影响甲烷爆炸的因素进行研究[2-7],在爆炸极限方面,陈晓坤等采用近球型气体爆炸反应罐测试了在空气中C2H6对甲烷爆炸极限参数的影响[8];周利华对矿井火区可燃性混合气体爆炸三角形判别法及其爆炸危险性进行了研究[9];Van den Schoor和Verplaetsen研究了在温度和压力升高时,空气中C2H6和 C3H8爆炸极限的变化规律[10-11];Bolk 等研究了流动状态下 C2H6—Air—N2混合气体的爆炸极限[12]。而涉及到乙烯对甲烷爆炸特性的研究较少,仅部分学者开展了考察,研究表明,少量的乙烯气体可使空气中甲烷爆炸的界限加宽,危险度增大[1];C2H4与CO之间存在着协同氧化诱导效应以及C2H4/CH4混合气体的爆炸极限临界氧浓度降低,使甲烷爆炸危险性增大[13-14],这些研究也只是在宏观上进行了定性分析,并未从微观角度深入研究。随着链式反应理论的提出和化学动力学的发展,发现可燃气体爆炸并不是单一化学反应,而是一种复杂的热爆炸和链式反应,自由基的生成和消失直接影响反应的进行[15]。因此,如果从微观分子角度来定量地分析C2H4/CH4混合爆炸反应的机理,那么将会深入了解C2H4影响甲烷爆炸的规律。为此,文中基于气体爆炸极限测试实验,研究乙烯对甲烷爆炸极限的影响,同时应用Gaussian 09程序,采用密度泛函理论的B3LYP/6-31G方法优化分子构型,并对相关基元反应作定量分析,从热力学和动力学角度,研究C2H4对甲烷链式爆炸的微观作用机理,得出C2H4/CH4混合体系步简化反应机理,从微观角度分析乙烯对甲烷爆炸的影响规律。
1 实验与计算方法
1.1 实验系统
实验系统采用标准的可燃气体爆炸极限测试装置,如图1所示,主要由爆炸反应管、点火器、循环泵、真空压力计、泄压口等组成。爆炸反应管长为1 400±50 mm,管内径60±5 mm,底部装置通径为25 mm的泄压阀;配气、循环搅拌、点火等步骤均在计算机上自动控制完成,配气精确度为0.1%,采用电压为300 VA电压互感器为点火电源,电极间距设置3~4mm,放电时间0.1~1 s可调;实验在常压下进行,初始温度18~26℃,环境湿度56~64%RH,分别测试加入不同体积分数(0%,0.4%,0.8%,1.2%,1.6%,2.0%)的 C2H4气体后CH4在空气中的爆炸极限,循环搅拌时间为5 min,点火放电时间为500 ms.
1.2 计算方法
运用Gaussian 09量子化学程序包,采用密度泛函理论的 B3LYP/6-31G方法[16],优化反应物(Re)、中间体(IM)、过渡态(TS)和产物(P)的几何构型,计算出相关基元反应的热力学数据如活化能、反应焓变、吉布斯自由能变,并用反应内禀坐标法验证反应路径[17],来考察C2H4对甲烷链式爆炸的微观机理。

图1 可燃气体爆炸极限测试装置Fig.1 Test device for explosion limits of combustible gases
2 实验结果及计算分析
2.1 C 2 H 4对空气中CH 4爆炸极限的影响
实验测得 CH4/air中加入不同体积分数的C2H4气体时CH4的爆炸极限,且计算甲烷的爆炸危险度及爆炸极限范围如图2和图3所示,来研究C2H4对甲烷爆的影响规律。其中,可燃气体的爆炸危险度F是爆炸上下限的平均值和下限值的差再除以平均值[18],其表达式 F=(槡UL -L)/,U为爆炸上限,%;L为爆炸下限,%,F值范围为0~1,F值越接近于1则表明CH4爆炸危险性越大。
由图2可知,随着C2H4浓度的增加,爆炸极限范围增大,爆炸下限下降比较明显。图3表明C2H4浓度增加,空气中CH4爆炸危险度F值逐渐增大,2%的 C2H4使得 CH4爆炸危险度增大约59.1%.表明,C2H4在一定程度上增大了CH4在空气中的爆炸危险性。
2.2 C2 H 4/CH 4链式爆炸反应过程计算及分析
对于甲烷燃爆反应机理已有了很多相关报道,若某物质的存在能生成主要中间产物或优先于某些链反应发生,从而生成更多中间产物,那么就提高了反应体系活化中心浓度,促进了甲烷爆炸[19-23]。基于此,现借鉴敏感性分析甲烷燃爆反应的简化机理[24],结合C2H4/CH4混合体系中可能发生的反应,选取其中11个基元反应,从反应发生的难易程度和概率出发,进行反应机理的简化,来分析C2H4对甲烷爆炸影响的微观作用机理。

图2 C2 H4对CH4爆炸极限的影响Fig.2 Influence of ethylene on explosion limits of methane

图3 C2H4对CH4爆炸危险度的影响Fig.3 Influence of ethylene on explosive hazard degree of methane
2.2.1 反应历程分析
图4为各反应中间体、过渡态及生成物构型,红色虚线表示原子间空间距离,并未实际成键。由图4可以看出,IM1的碳碳双键直接裂解到生成物P1,并不存在过渡态TS1,IM2中的一个氧原子与·OH达到成键距离后形成·HO2;IM3中一个氢原子发生断裂,与O2结合生成P3;IM4中碳碳双键断裂后与O2的2个氧原子分别结合形成P4,IM5碳氧双键发生断裂后一个氧原子与羟基结合形成P5,IM6中碳氧键发生断裂后氧原子被氢原子取代,形成P6,IM7中的一个碳氢键发生断裂后,2个游离的氢原子结合,形成P7;IM8中游离的氧原子攻击碳氢键,并与断裂后的氢原子结合形成P8,IM9中同样是游离的氧原子攻击碳氢键,并与断裂后的氢原子结合形成P9,IM10中碳氢键发生断裂后的氢原子与游离的羟基结合形成P10,IM11中游离羟基攻击碳氢键,碳氢单键发生断裂后氢原子与羟基结合生成P11.通过图4所示的计算得知,各中间体和生成物均存在。

图4 B3LYP/6-31G水平下各反应中间体、过渡态、及生成物的构型(键长单位/10-10m,键角单位/(°))Fig.4 Geometries of intermediate,transition states and products at the B3LYP/6 -31G level(Bond lengths/10 -10 m,bond angles/(°))
2.2.2 热力学与动力学分析
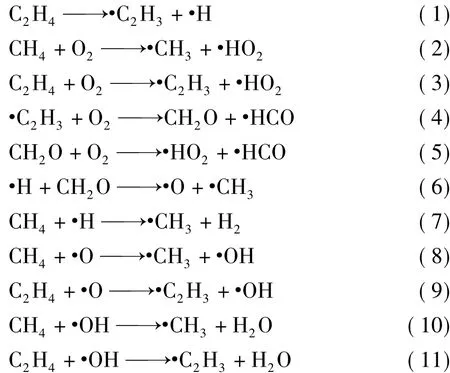
11个基元反应的反应物、过渡态和产物以及正逆反应活化能、反应焓变和吉布斯自由能见表1~4.其中,Ea为正反应活化能;Eb为逆反应活化能;ΔHθ为反应焓变;ΔGθ为反应吉布斯自由能变。
在初始的CH4/C2H4混合体系中,首先可能发生的反应只有反应1,2,3,从反应热力学角度出发,由表1可知,3个反应的ΔGθ均大于0,因此常温常压下均不能自发进行。对比反应(1)C2H4→·C2H3+·H和反应(3)C2H4+O2→·C2H3+·HO2的热力学数据可看出,2个反应的ΔHθ都小于0属于放热反应,反应(3)的正反应活化能Ea为141.331 kJ/mol,逆反应活化能 Eb为 328.608 kJ/mol,此反应Ea<Eb,反应有利于正向进行。反应(1)ΔE 为 28.959 kJ/mol,不存在过渡态,虽然反应(3)有利于反应正向进行,但对比化学反应平衡,对于从反应物开始反应时的次序几乎无影响,而反应(3)的反应活化能小于反应(1)的反应活化能,同样条件下,在此为了方便对比分析,简化描述为率先发生是反应(1)。反应(2)CH4+O2→·CH3+HO2的焓变ΔHθ大于0为吸热反应,正反应活化能 Ea为 289.645 kJ/mol,逆反应活化能 Eb为36.494 kJ/mol,此反应 Ea> Eb,反应有利于逆向进行。对比反应(2)和反应(3)的热力学数据可看出,反应(3)有利于反应正向进行,也就是说更有利于C2H4与O2结合;反应(3)为放热反应,同时反应(3)的正反应活化能Ea小于反应(2),反应(3)发生所需跨越的能垒较小,因此,同样条件下,反应(3)比反应(2)优先发生。故此处可以说反应(1)首先引发了C2H4/CH4混合体系爆炸链锁反应,为后续爆炸链反应提供热量以及关键自由基·H 和·C2H3.
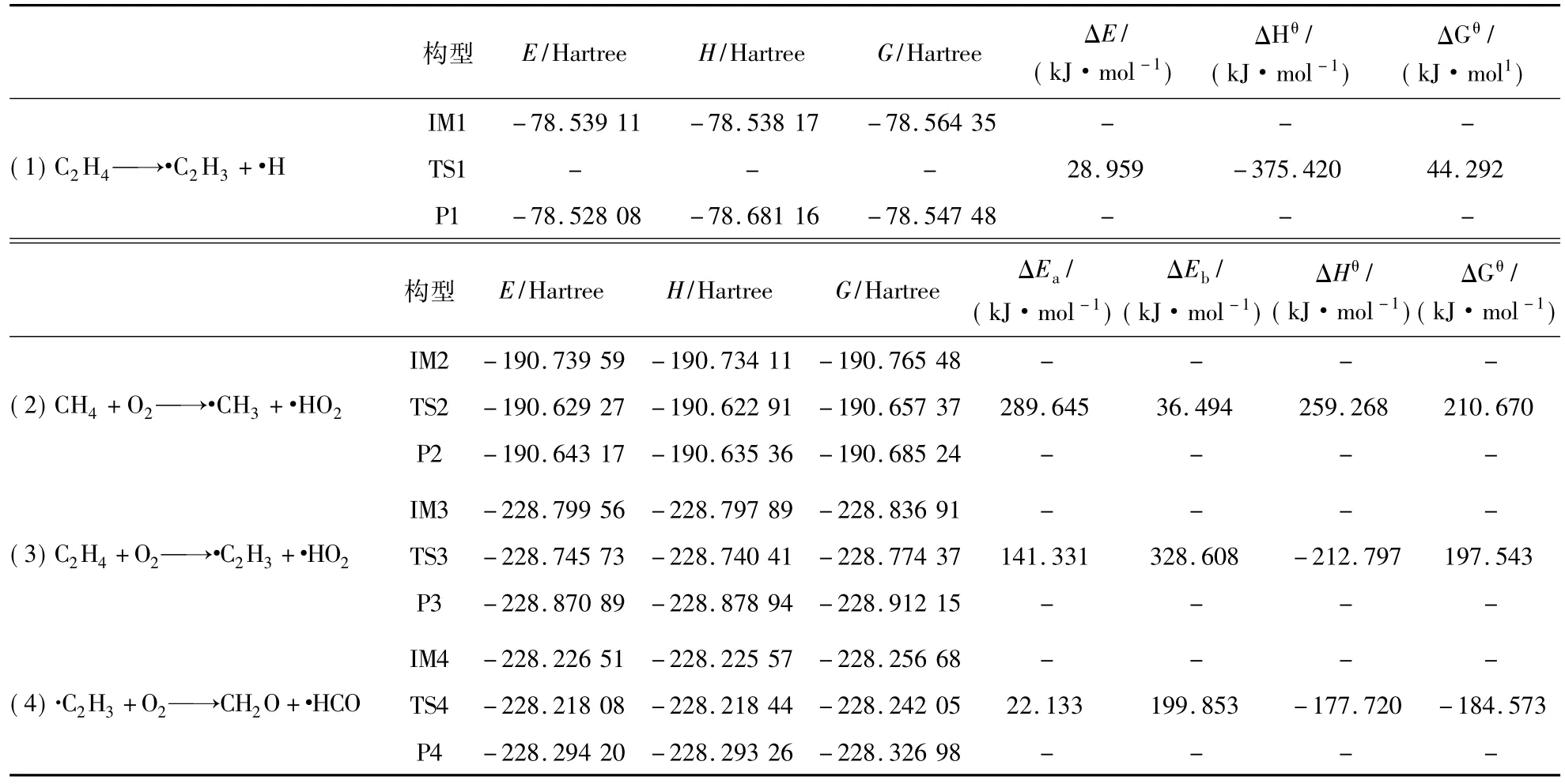
表1 反应(1)~(4)的热力学数据Tab. Thermodynamic data of reaction(1)~(4)
由于反应1比反应3的优先发生,可以使体系中的C2H4大部分反应生成·C2H3,因此在后续的链式反应中,体系中与O2的反应主要体现为反应2,4.由表1可知,链反应(4)·C2H3+O2→·CH2O+HCO正反应活化能Ea为22.133 kJ/mol远小于反应 2的 289.645 kJ/mol,逆反应活化能 Eb为199.853 kJ/mol,焓变 ΔHθ为 -177.720 kJ/mol,为放热反应,ΔGθ<0,此反应在常温常压下能自发进行,同时,此反应 Ea<Eb,反应有利于正向进行。比较反应(2)的热力学数据可以发现,反应(4)比反应(2)更容易发生,也就是说在反应(1)首先引发初始混合体系链锁反应后,·C2H3可以优先或代替CH4去与O2发生反应,同时为体系提供热量和链分支反应(5)的反应物CH2O以及爆炸过程关键自由基·HO2的生成,促进了CH4爆炸的链引发和链分支反应。因此,C2H4的加入使得CH4在空气中更易发生爆炸反应,爆炸危险性将增大,这也解释了C2H4的加入使得空气中CH4爆炸下限出现明显下降和爆炸危险度F值的增大。
由表2可知,反应(5)CH2O+O2→·HO2+·HCO正反应活化能Ea为193.184 kJ/mol远小于反应(2)的 289.645 kJ/mol,逆反应活化能 Eb为50.515 kJ/mol,ΔHθ为 141.646 kJ/mol,是吸热反应,ΔGθ>0,此反应在常温常压下不能自发进行,同时,此反应Ea>Eb,反应有利于逆向进行。同理,反应(6)·H+CH2O→·O+CH3为放热反应,在常温常压下能自发进行,而反应(7)CH4+·H→·CH3+H2是吸热反应且不能自发进行,且反应(6)的Ea小于反应(7)的Ea,因此反应(6)可以优先发生,可以说在反应4优先反应生成更多的CH2O后,CH2O仍可优先与O2发生反应,增加了CH4爆炸过程关键自由基·O,这也就是说C2H4的加入间接增加了CH4燃爆链分支反应的反应物,进而促进了整个链式反应的进行,宏观上可以表现为促进了CH4的爆炸。
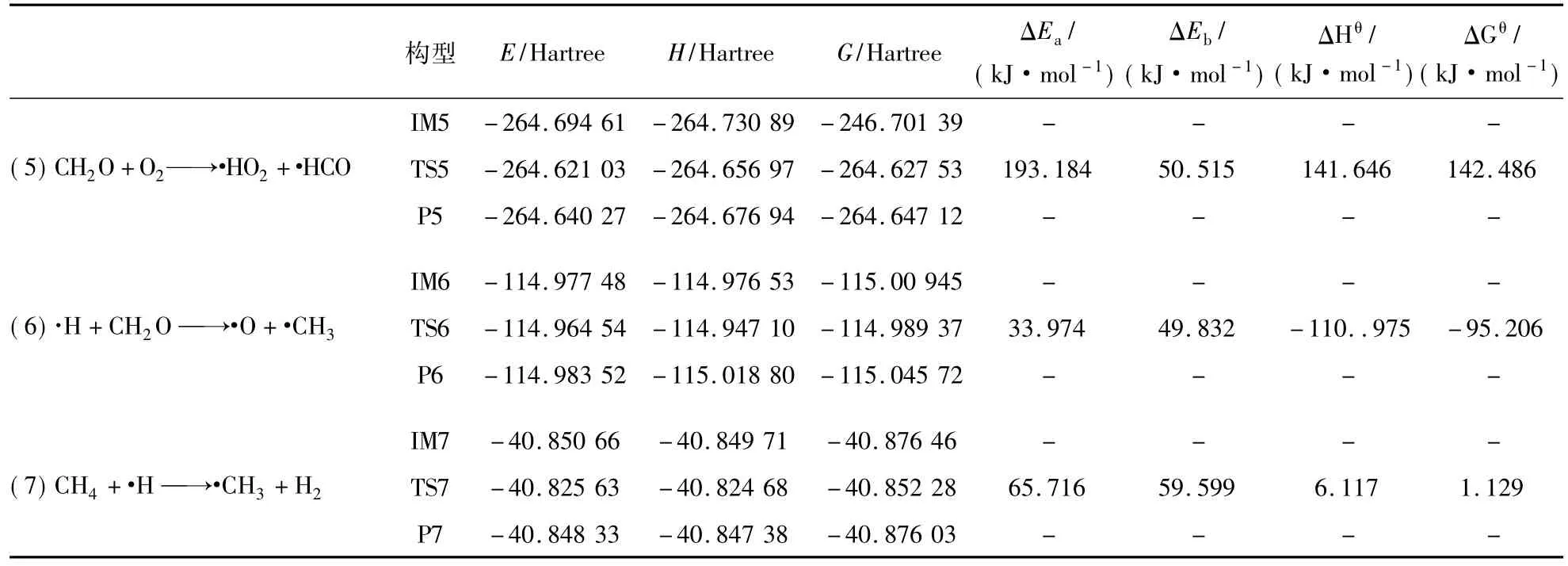
表2 反应(5)~(7)的热力学数据Tab.2 Thermodynamic data of reaction(5) ~(7)

表3 反应(8)~(9)的热力学数据Tab.3 Thermodynamic data of reaction(8) ~(9)
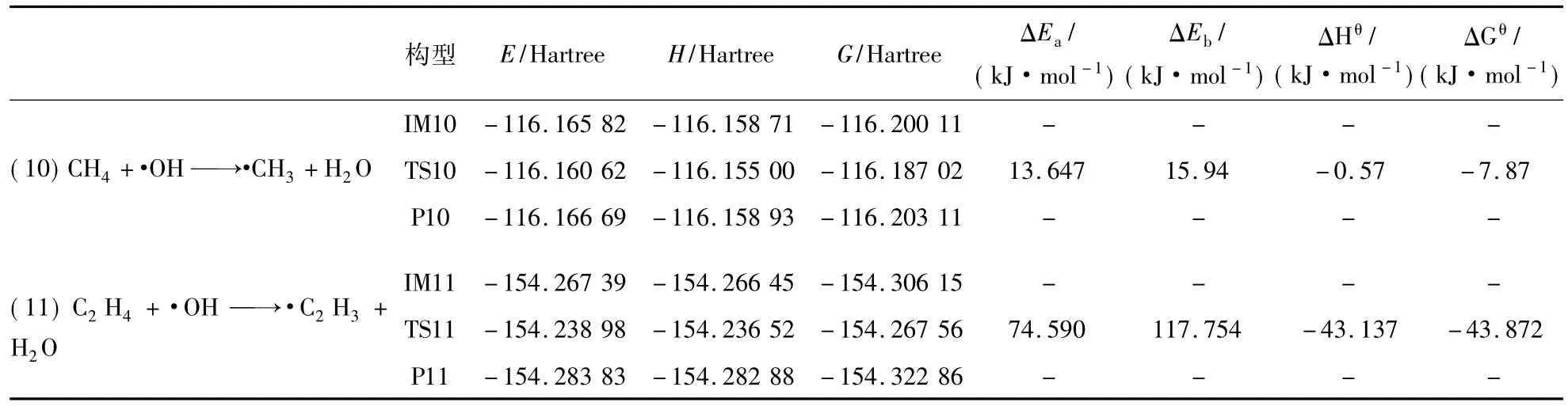
表4 反应(10)~(11)的热力学数据Tab.4 Thermodynamic data of reaction(10) ~(11)
由表3可知,反应(8)CH4+·→O·CH3+·OH为吸热反应,在常温常压下不能自发进行,反应(9)C2H4+·→O·C2H3+·O属于吸热反应且能自发进行,有利于正向反应,同时反应(9)的Ea远小于反应(8)的 Ea,因此,率先发生的是反应(9)。故此处可以说C2H4优先CH4与·O反应,增加了CH4爆炸过程关键自由基·C2H3和·OH,促进了甲烷爆炸。
由表4可知,反应(10)CH4+·H→·CH3+H2O和反应(11)C2H4+·OH→·C2H3+H2O均为放热反应且在常温常压下都能自发进行,但反应(10)的正反应活化能小于反应(11)的正反应活化能,因此,率先发生是反应(10)。虽然CH4优先C2H4与·OH反应,但C2H4的存在增加了关键自由基·C2H3,促进了爆炸链分支反应物CH2O的生成。
为进一步验证所研究反应历程的准确性,利用内禀反应坐标法计算反应通道。受限于篇幅,仅以反应(1)C2H4→·C2H3+·H和反应(2)CH4+O2→·CH3+·HO2为例展示反应路径追踪图,如图5,图6所示。从各反应IRC反应路径分析,皆经历了从初始低能量点构型到生成低能量稳定构型产物的过程,直接验证了文中11个反应的正确性,反应的能量变化情况与实际反应相符。
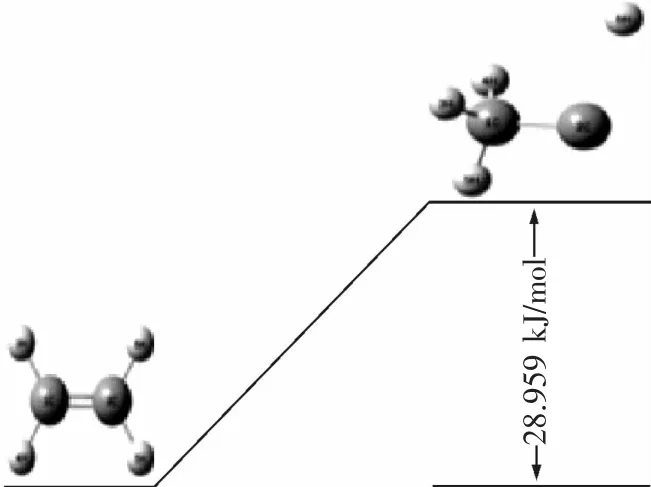
图5 C2H4 →·C2H3+·H IRC反应路径追踪Fig.5 C2 H4 →·C2 H3+·H IRC reaction path tracking
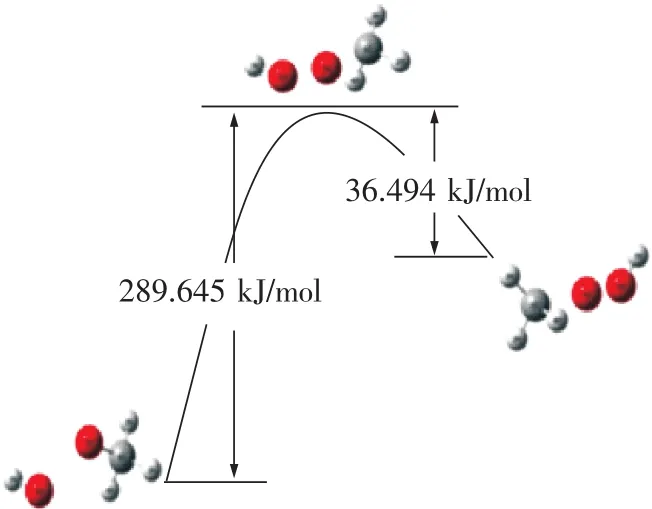
图6 CH4+O2 →·CH3+·HO2 IRC反应路径追踪Fig.6 CH4+O2 →·CH3+·HO2 IRCreaction path tracking
2.2.3 C2H4/CH4混合体系链式爆炸反应简化机理
在C2H4/CH4混合体系爆炸反应过程中,一开始整个反应系统中充满着C2H4,CH4和空气。在点火的一瞬间,混合系统中首先可能发生如下反应

反应(1)的正反应活化能最小,反应发生所需跨越的能垒较小,不存在过渡态,所需吸收的热量极小,所以在同样的条件下,反应(1)可以优先发生,或者说反应(1)发生的概率远大于反应(2)和(3),在此为了方便对比分析,简化描述为在C2H4/CH4混合体系中率先发生是反应(1)。当反应(1)、(3)、(2)发生后,混合体系中除了 C2H4,CH4和 O2外,还有反应(1)产生的新的自由基·H,·C2H3,CH3,HO2.接着可能发生如下反应

同理上述分析,对比各基元反应热力学和反应动力学参数,从反应发生的难易程度和概率出发,分析得出C2H4/CH4混合体系链式爆炸引发阶段反应简化机理如下
甲烷燃爆的基元反应是一个复杂的动态过程,并不能简单认为每个基元反应在体系中存在狭义的顺序。上述基元反应顺序并不能说明这些反应是一个接一个的发生,而是就体系中存在的自由基可能发生的反应和反应的难易程度及概率进行了归纳。
3 结论
1)随着C2H4体积分数的不断增大,空气中CH4爆炸上限和下限均下降,且爆炸下限下降比较明显,而对上限的影响幅度不大,CH4爆炸极限范围逐渐变宽,爆炸危险度F值增大;
2)C2H4→·C2H3+·H首先引发了C2H4/CH4混合体系爆炸链锁反应并释放能量,为后续链式反应提供所需的自由基,降低了混合体系爆炸发生的困难程度,解释了C2H4加入后CH4爆炸下限下降的原因;
3)C2H4→·C2H3+·H产物中·C2H3优先CH4与O2发生反应,增加了CH4爆炸链分支反应所需的中间产物CH2O,促进了甲烷爆炸,同时C2H4的存在增加了CH4爆炸过程中关键自由基·O,·C2H3,·OH,·H,·OH 以及·HCO,提高了反应中中间关键产物的活化中心浓度,在一定程度上促进了甲烷的爆炸;
4)通过分析C2H4对甲烷/空气爆炸的微观作用机理,得出了C2H4/CH4混合体系链式爆炸的16步简化反应机理。
[1] 贾宝山,胡如霞,皮子坤,等.采空区遗煤自燃产生的C2H4促进瓦斯爆炸特性[J].辽宁工程技术大学学报:自然科学版,2015,34(6):677 -682.JIA Bao-shan,HU Ru-xia,PI Zi-kun,et al.Promoting gas explosion characteristics of C2H4produced by spontaneous combustion of residual coal in gob[J].Journal of Liaoning Technical University:Natural Science Edition,2015,34(6):677 -682.
[2] 左 哲,姚志强,高进东,等.受限空间内天然气爆炸反应过程模拟分析[J].天然气工业,2015,35(6):131-137.ZUO Zhe,YAO Zhi-qiang,GAO Jin-dong,et al.Simulation analysis of natural gas explosion within confined space[J].Natural Gas Industry,2015,35(6):131-137.
[3] 刘 丹,司荣军,李润之.环境湿度对瓦斯爆炸特性的影响[J].高压物理学报,2015,29(4):307 -312.LIU Dan,SI Rong-Jun,LI Run-zhi.Ambient humidity influence on explosion characteristics of methane-air mixture[J].Chinese Journal of High Pressure Physics,2015,29(4):307 -312.
[4] 李润之,司荣军.点火能量对瓦斯爆炸压力影响的实验研究[J].矿业安全与环保,2010,37(2):14 -16.LI Run-zhi,SI Rong-Jun.Experimental study on impact of ignition energy on gas explosion pressure[J].Mining Safety and Environmental Protection,2010,37(2):14-16.
[5] 张应安,刘振翼,王 峰,等.含CO2天然气燃烧爆炸特性实验研究[J].天然气工业,2009,29(6):110-112.ZHANG Ying-an,LIU Zhen-yi,WANG Feng,et al.Experimental studies on fire and explosion characteristics of natural gas with carbon dioxide[J].Natural Gas Industry,2009,29(6):110 -112.
[6] 任韶然,李海奎,李磊兵,等.惰性及特种可燃气体对甲烷爆炸特性的影响实验及分析[J].天然气工业,2013,33(10):110 -115.REN Shao-ran,LI Hai-kui,LI Lei-bing,et al.An experimental study of effects of inert and special flammable gases on methane’s explosion characteristics[J].Natural Gas Industry,2013,33(10):110 -115.
[7] 程方明,邓 军.一氧化碳影响二氧化碳惰化甲烷爆炸的实验研究[J].西安科技大学学报,2016,36(3):315-319.CHENG Fang-ming,DENG Jun.Experimental study on the influence of carbon monoxide on carbon dioxide-inerted methane explosion[J].Journal of Xi’an University of Science and Technology,2016,36(3):315 -319.
[8] 陈晓坤,张 娥.可燃性气体对CH4爆炸特性影响的实验研究[J].煤矿安全,2009,40(10):7 -10.CHEN Xiao-kun,ZHANG E.Experimental study on the methane mixed combustive gas explosive characteristic[J].Safety in Coal Mines,2009,40(10):7 - 10.
[9] 周利华.矿井火区可燃性混合气体爆炸三角形判断法及其爆炸危险性分析[J].中国安全科学学报,2001,11(2):47 -51.ZHOU Li-hua.Explosion triangle of mixed inflammable gases and explosion risk analysis in the mine fire district[J].China Safety Science Journal,2001,11(2):47-51.
[10] Van Den Schoor F,Verplastsen F.The upper explosion limit of lower alkanes and alkenes in air at elevated pressures and temperatures[J].Journal of Hazardous Materials,2006,128(1):1 -9.
[11] Norman F,Van Den Schoor F,Verplastsen F.Auto-ignition and upper explosion limit of rich propane-air mixtures at elevated pressures[J].Journal of Hazardous Materials,2006,137(2),666 -671.
[12] Bolk J W,Siccama N B,Westerterp K R.Flammability limits in flowing ethane-air-nitrogen mixtures:An experimental study[J].Chemical Engineering Science,1996,51(10):2231-2239.
[13]邓 军,吴晓春,程 超.CH4,CO,C2H4多元可燃气体爆炸实验研究[J].煤炭现代化,2007(5):63-65.DENG Jun,WU Xiao-chun,CHENG Chao.Experimental study on explosion of multicomponent combustibility gases containing CH4,CO and C2H4[J].Coal Mine Modernization,2007(5):63 -65.
[14]邓 军,程 超,吴晓春.煤矿可燃性气体爆炸氧浓度的实验研究[J].煤矿安全,2007,38(6):5-7.DENG Jun,CHENG Chao,WU Xiao-chun.Experimental study on explosive oxygen concentration of coal mine combustive gases[J].Safety in Coal Mines,2007,38(6):5-7.
[15]高 娜,张延松,胡毅亭.受限空间瓦斯爆炸链式反应动力学分析[J].中国安全科学学报,2014,24(1):60-65.GAO Na,ZHANG Yan-song,HU Yi-ting.Dynamics analysis of gas explosion chain reaction in restricted space[J].China Safety Science Journal,2014,24(1):60-65.
[16] Karunakaran Remya,Cherumuttathu H Suresh.Which density functional is close to CCSD accuracy to describe geometry and interaction energy of small non-covalent dimers?A benchmark study using gaussian 09[J].Journal of Computational Chemistry,2013,34(15):1341-1353.
[17] Bakken V,Helgaker T.The efficient optimization of molecular geometries using redundant internal coordinates[J].Journal of Chemical Physics,2002,117(20):9160-9174.
[18]近藤重雄,韩 美.新的爆炸危险度F值[J].低温与特气,1995(2):57-60.JINTENG Zhong-xiong,HAN Mei.A new explosive hazard degree F[J].Low Temperature and Specialty Gases,1995(2):57 -60.
[19]罗振敏,邓 军,郭晓波.基于Gaussian的瓦斯爆炸微观反应机理[J].辽宁工程技术大学学报,2008,27(3):325-328.LUO Zhen-min,DENG Jun,GUO Xiao-bo.Microcosmic mechanism of gas explosion based on Gaussion[J].Journal of Liaoning Technical University,2008,27(3):325-328.
[20]罗振敏.链式反应理论在矿井瓦斯抑爆中的应用[J].煤矿安全,2009(2):67 -69.LUO Zhen-min.Application of chain reaction theory in mine gas explosion suppression[J].Safety in Coal Mines,2009(2):67 - 69.
[21]罗振敏,张 江,王 涛.CO/CH4链式爆炸反应机理研究[J].兵工学报,2017,38(S1):49 -59.LUO Zhen-min,ZHANG Jiang,WANG Tao.The study of CO/CH4explosion chain reaction mechanism[J].Acta Armamentarii,2017,38(S1):49 -59.
[22]罗振敏,张 江,任军莹,等.NH4H2PO4粉体热分解产物在瓦斯爆炸中的作用[J].煤炭学报,2017,42(6):1489-1495.LUO Zhen-min,ZHANG Jiang,REN Jun-ying,et al.Role of thermal decomposition products of NH4H2PO4powder in gas explosion[J].Journal of China Coal Society,2017,42(6):1489 -1495.
[23]罗振敏,康 凯,任军莹.NH3对甲烷链式爆炸的微观作用机理[J].煤炭学报,2016,41(4):876 -883.LUO Zhen-min,KANG Kai,REN Jun-ying.Microscopic mechanism of NH3on chain of methane explosion[J].Journal of China Coal Society,2016,41(4):876 -883.
[24]侯金丽,金 平,蔡国飙.基于敏感性分析的氧/甲烷燃烧反应简化机理[J].航空动力学报,2012,27(7):1549-1554.HOU Jin-li,JIN Ping,CAI Guo-biao.Reduced mechanism for oxygen/methane combustion based on sensitivity analysis[J].Journal of Aerospace Power,2012,27(7):1549-1554.

