准分子激光消融术在光学相干断层扫描技术指导下治疗冠状动脉旁路移植术后静脉桥血管狭窄病变
李牧蔚 刘巍 赵康
1 临床资料
患者 女,65岁。因“发作性胸痛10年”于2016年12月17日收入河南省人民医院接受治疗。患者10年前因不稳定型心绞痛行冠状动脉造影(coronary artery angiography, CAG)提示“三支病变”。于 2006年12月11日行冠状动脉旁路移植术(coronary artery bypass graft, CABG),三条桥血管分别为左内乳动脉-左前降支 桥 血 管(left internal mammary artery -left anterior descending, LAD-LIMA)、大隐静脉-后降支桥血管(saphenous vein graft - posterior anterior descending,SVG-PDA)和大隐静脉-钝缘支桥血管(saphenous veingraft – obtuse marginal, SVG-OM)。术后坚持服用阿司匹林、他汀类降脂药物进行治疗,未再出现胸痛症状。2010年患者出现头晕、乏力,诊断为窦性心动过缓,植入双腔起搏器,术后症状明显改善。近1年患者快步行走时再次出现胸痛,性质及部位与CABG术前相同,休息数分钟可缓解,活动耐受量逐渐降低。2016年4月至河南省人民医院门诊复查冠状动脉CT血管造影提示冠状动脉三支原位血管严重弥漫狭窄,LAD-LIMA桥血管和SVG-PDA桥血管闭塞,SVGOM桥血管远段重度狭窄(图1),给予硝酸酯类药物治疗8个月,活动性胸痛症状未见明显好转,遂来我院住院治疗。既往高脂血症病史10余年,间断口服他汀类药物治疗。否认高血压病、糖尿病等病史。入院查体:血压115/75 mmHg(1 mmHg=0.133 kPa),心肺腹均未见异常,双下肢未见水肿,颈静脉未见怒张。实验室检查:血、尿、便常规均正常,凝血功能、甲状腺功能、肝肾功能、电解质、血糖均正常,总胆固醇3.77 mol/L、三酰甘油1.10 mmol/L、低密度脂蛋白胆固醇(LDL-C)2.21 mmol/L、高密度脂蛋白胆固醇(HDL-C)1.06 mmol/L。X线胸片未见异常。超声心动图示:左心房轻度肥大,主动脉退行性变化,二、三尖瓣轻度反流。心电图平板运动试验示:下壁、前侧壁ST段明显压低(图2)。 入院诊断:冠心病 (不稳定型心绞痛),窦性心动过缓 (起搏器植入术后)。
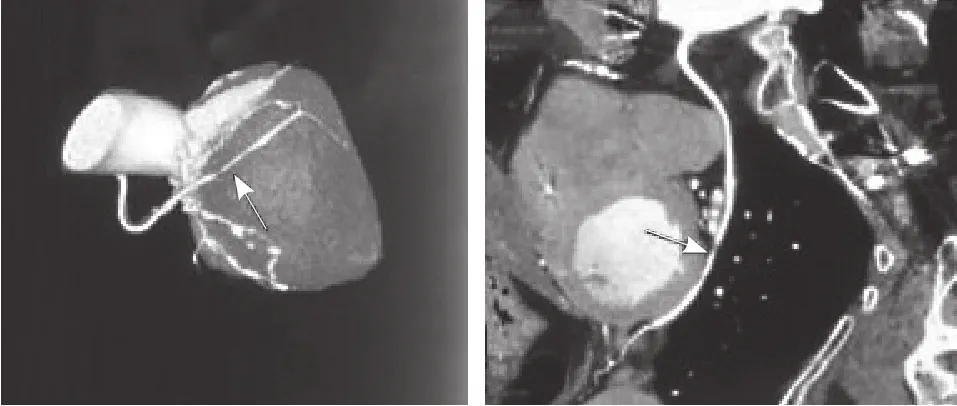
图1 门诊冠状动脉CT血管造影示大隐静脉-钝缘支桥血管远段重度狭窄(箭头所示)
入院后给予双重抗血小板、扩血管、控制心率、调脂等药物治疗,并行CAG检查,提示三支病变:左主干大致正常,左前降支(left anterior descending coronary atery,LAD)近中段弥漫病变,最严重处90%狭窄,D1近段90%狭窄,左回旋支(left circumflex artery,LCX)近段80%狭窄,远段闭塞,右冠状动脉(right coronary artery,RCA)近中远段弥漫病变,最严重处90%狭窄(图3);SVG-OM远段90%狭窄(图4A),LIMA-LAD和SVGPDA闭塞。
光学相干断层扫描技术(optical coherence tomography,OCT)检查可见SVG-OM病变富含脂质斑块且伴有较多血栓成分(图4B),测得最小管腔直径为1.14 mm,最小管腔面积(MLA)为1.04 mm2。1.4 mm准分子激光导管缓慢前进至SVG-OM病变处,能量设置为30 mJ/mm2(35 Hz),激光消融一次后,再次应用45 mJ/mm2(35 Hz)能量进行消融,造影显示管腔狭窄明显减轻(图4C)。OCT检查显示管腔完全通畅,仅近端有少许血栓沉积(图4D),测得最小管腔直径为2.10 mm,MLA为3.89 mm2。根据OCT结果提示,在SVGOM病变处置入3.5 mm×30 mm 雅培XIENCE V依维莫司洗脱支架,以12 atm(1 atm=101.325 kPa)扩张,再次行OCT检查显示支架贴壁良好,近端有部分支架膨胀不良,但无支架内斑块脱垂(图5A、5B),选择美敦力3.5 mm×12 mm球囊以12~14 atm行后扩张两次,支架膨胀不良消失,结果满意(图5C、5D),测得支架最大面积为5.51 mm2。后处理原位RCA病变,由远及近置入支架3枚,狭窄段血管成功开通,效果满意。术后患者活动性胸痛症状消失,规律服药治疗,半年后复查冠状动脉造影示RCA近中远段支架通畅,SVG-OM桥血管通畅,LAD近段70%狭窄,中段90%狭窄,D1近段80%狭窄。遂对LAD病变行介入治疗,置入支架3枚,狭窄段血管成功开通,效果满意。
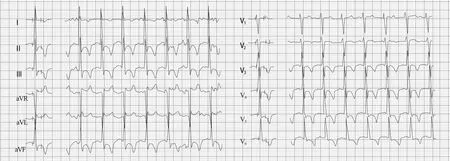
图2 心电图平板运动试验示:下壁、前侧壁ST段压低
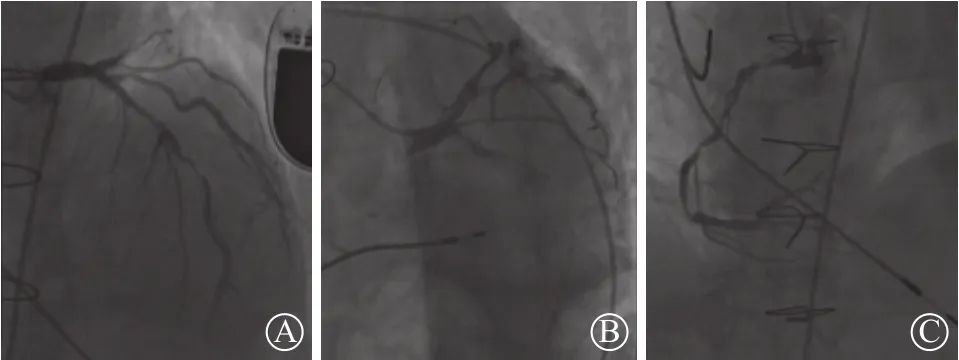
图3 冠状动脉造影提示三支病变 A. 左前降支近中段弥漫病变,最严重处90%狭窄,D1近段90%狭窄;B. 左回旋支近段80%狭窄,远段闭塞;C. 右冠状动脉近中远段弥漫病变,最严重处90%狭窄
2 讨论
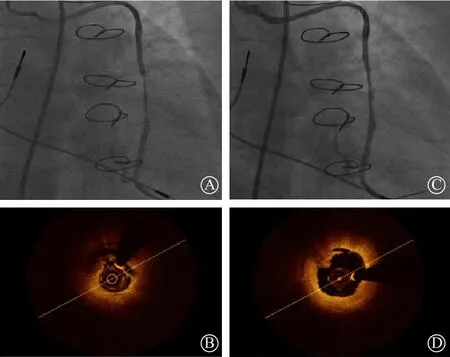
图4 A.冠状动脉造影提示大隐静脉-钝缘支(SVG-OM)远段90%狭窄; B. 光学相干断层扫描技术检查可见SVG-OM病变为富含脂质斑块且伴有较多血栓成分; C.冠状动脉造影显示SVG-OM病变管腔狭窄明显减轻; D.光学相干断层扫描技术检查显示管腔完全通畅,近端有少许血栓沉积

图5 A. C. 置入支架后冠状动脉造影图;B. D. 光学相干断层扫描技术检查图 A. B.左回旋支内支架贴壁良好,近端有部分支架膨胀不良;C. D. 球囊行后扩张后,支架膨胀不良消失
本病例为CABG术后10年的静脉桥血管病变。据统计,CABG术后10年约有50%的静脉桥血管发生闭塞或严重狭窄[1],与冠状动脉自身血管的动脉粥样硬化斑块相比,静脉桥血管的病变更加弥漫松软,富含更多的泡沫细胞、炎症细胞,缺少钙化成分,纤维帽较小或缺如,容易破裂,并且有较多血栓附着[2-4]。静脉桥血管病变的处理策略包括再次CABG和经皮冠状动脉介入治疗(percutaneous coronary intervention, PCI)。二次 CABG 有着较高的并发症发生率和死亡率,PCI因其风险小、成功率高,从而成为此类患者的主要治疗手段[5]。本病例三支病变,其中RCA和LCX为胸痛的靶血管,应优先考虑血运重建治疗。本病例PCI治疗原则上应以开通原位冠状动脉血管为主,但原位LCX为闭塞病变,开通难度大,故而选择处理SVG-OM病变。SVG病变PCI治疗中最大的挑战是球囊扩张或支架释放后斑块成分脱落造成远端血管栓塞导致无复流现象,发生率达10%~15%[6]。无复流发生后,31%患者出现心肌梗死,住院期间死亡率增加10倍[7]。远端保护装置(distal protection devices,DPD)可减少斑块成分或微血栓脱落引起的无复流现象发生,在SVG的介入治疗中发挥了重要的作用,因此被AHA/ACC冠状动脉介入治疗指南列为I类推荐[8]。但是DPD的应用具有一定的局限性[9]:对于远端吻合口病变(约占SVG介入治疗数量的50%),缺乏合适的着陆区;对于严重狭窄或扭曲的静脉桥血管病变,DPD往往不容易通过,即使通过病变,因斑块易碎的性质,在输送DPD的过程中就可能造成斑块碎裂引起远端血管栓塞[10]。准分子激光冠状动脉斑块消融术(excimer laser coronary atherectomy,ELCA)利用血管内斑块组织对波长308 nm的激光能量的特殊吸收效应,使斑块组织发生分子键断裂变成小于10 μm的碎片,从而打通血管通路并起到减容效果。目前ELCA技术治疗静脉桥血管病变在国内刚刚开展,本例应用OCT指导手术进程为国内首创,治疗效果满意。通过OCT检查,术者能够清晰地观察到静脉桥血管病变的性质、ELCA治疗前后斑块负荷的变化,并能够指导支架置入及后扩张。早在20余年前,国外已有关于ELCA治疗静脉桥血管病变的报道[11],随着激光导管技术的不断发展,经过多中心注册的CORAL研究[12]证实,ELCA已能够明显减少SVG介入治疗过程中无复流发生风险,发生率小于5%。Niccoli等[9]通过前瞻性病例对照研究证明,在治疗静脉桥血管病变时,ELCA较DPD可能获得更好的心肌灌注,能够进一步减少围术期心肌梗死发生率。本例通过OCT检查观察到了ELCA治疗静脉桥血管病变的有效性和安全性。相信不久将来,在我国ELCA治疗静脉桥血管病变将成为一项成熟的技术,广泛应用于临床,解决CABG术后SVG病变介入治疗的难题。
[1] Harskamp RE, Lopes RD, Baisden CE, et al. Saphenous vein graft failure after coronary artery bypass surgery: pathophysiology,management, and future directions. Ann Surg, 2013, 257(5): 824-833.
[2] Cho KR, Kim JS, Choi JS, et al. Serial angiographic follow-up of grafts one year and five years after coronary artery bypass surgery.Eur J Cardiothorac Surg, 2006, 29(4): 511-516.
[3] O'Connor GT, Malenka DJ, Quinton H, et al. Multivariate prediction of in-hospital mortality after percutaneous coronary interventions in 1994-1996. Northern New England Cardiovascular Disease Study Group.J Am Coll Cardiol,1999, 34(3): 681-691.
[4] 王刚,张涛,李建,等.内窥镜获取大隐静脉在冠状动脉旁路移植术中的临床研究.中国介入心脏病学杂志,2016,24(4):191-194.
[5] Lee MS, Park SJ, Kandzari DE, et al. Saphenous vein graft intervention. JACC Cardiovasc Interv, 2011, 4(8): 831-843.
[6] Sdringola S, Assali AR, Ghani M, et al. Risk assessment of slow or no-reflow phenomenon in aortocoronary vein graft percutaneous intervention. Catheter Cardiovasc Interv, 2001, 54(3): 318-324.
[7] Abbo KM, Dooris M, Glazier S, et al. Features and outcomes of noreflow after percutaneous coronary intervention. Am J Cardiol,1995,75(12):778–782.
[8] Levine GN, Bates ER, Blankenship JC, et al. 2011 ACCF/AHA/SCAI Guideline for Percutaneous Coronary Intervention: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines and the Society for Cardiovascular Angiography and Interventions. Circulation, 2011, 124(23): e574-651.
[9] Niccoli G, Belloni F, Cosentino N, et al. Case-control registry of excimer laser coronary angioplasty versus distal protection devices in patients with acute coronary syndromes due to saphenous vein graft disease. Am J Cardiol, 2013,112(10): 1586-1591.
[10] Mathew V, Lennon RJ, Rihal CS, et al. Applicability of distal protection for aortocoronary vein graft interventions in clinical practice.Catheter Cardiovasc Interv, 2004, 63(2): 148-151.
[11] Litvack F, Grundfest WS, Goldenberg T, et al. Percutaneous excimer laser angioplasty of aortocoronary saphenous vein grafts. J Am Coll Cardiol, 1989, 14(3): 803-808.
[12] Giugliano GR, Falcone MW, Mego D, et al. A prospective multicenter registry of laser therapy for degenerated saphenous vein graft stenosis:the COronary graft Results following Atherectomy with Laser (CORAL)trial. Cardiovasc Revasc Med, 2012,13(2): 84-89

