鸡巴氏杆菌的分离鉴定及体外抑制实验
边彦超,刘小兰,康绍珠,李雅婷,梁诗毅,曹刚,陈飞虎,陈林文,朱芝秀
(江西农业大学动物科技学院,江西南昌330045)
鸡巴氏杆菌病,又称鸡出血性败血症,是由多杀性巴氏杆菌引起的鸡、火鸡等多种禽类的传染病。患病动物和带菌动物是本病的重要传染源,病死率较高,没有明显的季节性,但在气候剧变之时多发。本病多呈散发或地方性流行,同种动物之间相互传染,不同种种动物间偶见相互传染[1]。

图1 皮肤、黏膜、浆膜出血

图2 胸腔积液
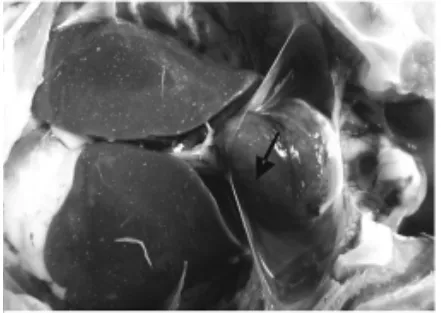
图3 肝针尖状坏死

图4 心肌、心冠脂肪、心内外膜点状出血

图5 肠道弥漫性出血
2015年5月中旬,江西南昌某养鸡场发生疑似鸡巴氏杆菌病病例,剖检发病鸡可见全身皮肤、黏膜、浆膜点状或片状出血(图1);胸腔积液,有纤维素性渗出物 (图2);肝表面有密集的针尖大小的灰白色的坏死点(图3);心肌、心冠脂肪、心内外膜点状出血(图4);肠道弥漫性出血(图5)。临床上呈急性败血性死亡症,初诊为鸡巴氏杆菌病。取坏死肝脏无菌操作细菌分离,进行实验室诊断,确定为由多杀性巴氏杆菌引起的鸡出血性败血症。
1 材料与方法
1.1 材料
1.1.1实验动物:死亡鸡,来自江西南昌某养鸡场;实验鸡,购自江西农大动科院养禽小组。
1.1.2药品及试剂:5%兔血琼脂培养基、普通琼脂培养基、普通肉汤琼脂培养基(自行配制);麦康凯琼脂培养基、伊红美蓝琼脂培养基(北京奥博星生物责任有限公司);药敏试纸、微量发酵管(杭州天和微生物有限公司);鸡唾液乳酸杆菌由江西农大动科院预防兽医教研室保存。
1.1.3实验仪器:AIR TECH超净工作台 (苏净集团安泰公司);COCI光学显微镜 (重庆光学仪器厂);Motic数码显微镜 (麦克奥迪实业集团有限公司);HH.BII.420BS电热恒温培养箱(上海跃进科学仪器厂);LDZX-40BI立式自动电热压力蒸汽灭菌器(上海申安医疗器械厂)。
1.2 方法
1.2.1细菌分离培养:采取病死鸡的肝、脾、心等组织,触片、瑞氏染色;同时无菌操作划线接种于5%兔血琼脂培养基、TSA培养基和麦康凯培养基,37℃恒温箱培养24 h,观察菌落的形态、大小、溶血状况等,挑选单个典型菌落进行革兰氏染色、镜检,观察其菌体形态特征。挑取经过革兰氏染色后的单个菌落,划线接种于5%兔血琼脂平板,放入生化培养箱,37℃培养24h,进行纯培养。纯培养后的分离株分别命名为 JX01、JX02、JX03、JX04、JX05。
1.2.2分离菌生理生化特性:将分离菌分别接种至微量生化反应管中,37℃恒温箱培养24~48 h,观察其生长变化情况,方法按微量生化反应管说明书进行,发酵管分别加入1~2滴无菌血清。
1.2.3体外抑菌实验
1.2.3.1分离菌药敏实验:按照琼脂扩散法[2]做药敏试验,将分离菌血清肉汤培养液分别涂抹5%兔血琼脂培养基,37℃恒温箱培养24 h后,测量其抑菌圈的大小。
1.2.3.2鸡唾液乳酸杆菌对分离菌体外抑制实验。将分离菌分别接种于血清肉汤培养基,37℃培养24h后,均匀涂抹于血清琼脂培养,其上放置牛津杯,将鸡唾液乳酸杆菌加入牛津杯至满,37℃恒温箱培养24h,观察并测量抑菌圈大小。
1.2.4致病性试验:将分离菌无菌操作,接种于血清肉汤培养基,放入生化培养箱,37℃培养24h。分别取0.5mL血清肉汤培养物,肌肉注射3只健康试验鸡;同时,分别取0.5mL血清肉汤培养物,口腔喂服3只健康试验鸡,24h观察其发病情况。并将发病死亡的试验鸡进行细菌分离培养,染色镜检。
2 结果
2.1 分离菌培养特性
病死鸡的肝、脾、心等组织瑞氏染色镜检,均可见菌体呈两端钝圆、两极浓染的椭圆形小杆菌(图7),疑为巴氏杆菌。兔血琼脂平板和TSA培养基上均分离到形态一致的菌落。兔血琼脂平板上菌落生长良好、不溶血,呈半透明、湿润、似露滴状,表面闪光(图8);TSA培养基上菌落直径在1 mm左右、灰白色、湿润、光滑;麦康凯培养基上不生长。单个菌落染色镜检,均为革兰氏阴性短杆菌,菌体两端钝圆,大小为 0.25~0.4μm×0.5~2.5μm,单个或成双排列(图 9)。

图6 乳酸菌体外抑制

图7 瑞氏染色(10×100)

图8 闪光小菌落

图9 革兰氏染色(10×100)
2.2 分离菌生理生化鉴定
实验结果:靛基质、枸橼酸盐、尿素酶等阴性;分解葡萄糖、蔗糖、麦芽糖和甘露醇,产酸不产气;对乳糖不能分解;能还原硝酸盐。见图10、表1。

表1 分离菌生理生化特性
2.3 分离菌药敏实验
结果如表2,分离菌对大部分抗生素耐药;对青霉素G、羧苄青霉素、阿莫西林等青霉素类抗生素完全耐药;对卡那霉素、红霉素、氧氟沙星中等敏感。
2.4 鸡唾液乳酸杆菌对分离菌体外抑制实验
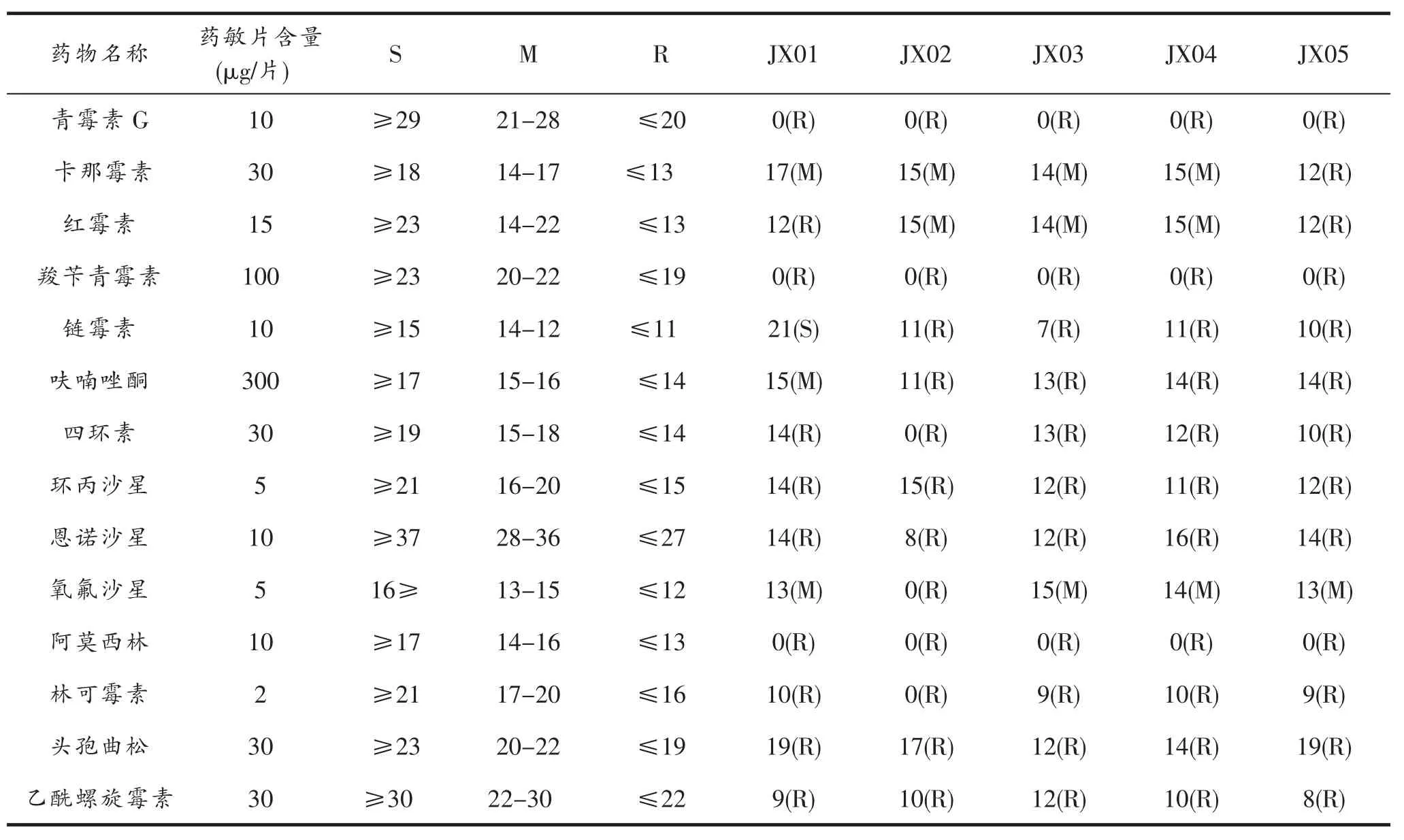
表2 药敏试验结果 mm
5 株分离菌的抑菌圈分别为:24、26、25、31、 33mm,如图 6。

图10 分离菌生化试验
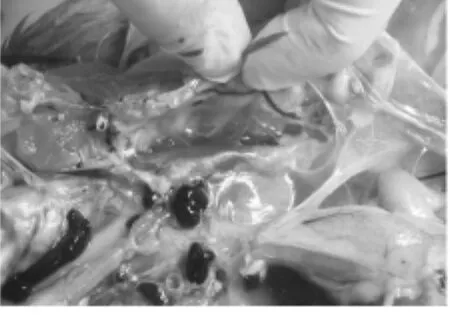
图11 鸡胸腔积液

图12 心包积液,肝脏坏死点

图13 食道浆膜出血

图14 气管环死出血
2.5 致病性试验
3只肌肉接种0.5mL致病菌液健康鸡12d内死亡,3只口腔喂服鸡24d内死亡。解剖口腔喂服死亡鸡,可见胸腔有橙黄色透明的积液(图11);心包内有大量橙黄色透明液体,肝脏有大量坏死点(图12);食道浆膜出血(图13);气管环出血(图14)。从试验鸡肝脏中分离到与原分离菌染色形态、培养特性完全一致的的细菌。
3 讨论
3.1根据临床病理特症,分离菌形态特性,菌落培养特性及生化试验、药敏试验、致病性试验等试验结果,比对伯杰氏细菌分离鉴定手册[3],确诊该分离菌为多杀性巴氏杆菌。
3.2本分离菌与多杀性巴氏杆菌标准菌株生理生化特性大部分一致[4~6],只有个别糖发酵试验[19]以及硫化氢试验[20]不同,可能因为菌株变异造成。
3.3分离菌对青霉素G、羧苄青霉素、阿莫西林等青霉素类抗生素完全耐药,与杜冬华发表的论文[18]相同,与刘红玉发表的论文[15]不同;对卡那霉素、红霉素、氧氟沙星中等敏感,与黄忠森[16]发表的论文相同,与马增军[17]发表的论文不同。这可能是由于地域、菌株差异等造成。
3.4长期以来,在临床上大量使用抗生素,造成分离菌耐药性越来越强[7~10],寻找减少或取代抗生素的有益菌迫在眉睫。本实验所做的乳酸菌体外抑制实验取得了的较好效果,可为后期运用于临床提供理论根据。
3.5本分离菌致病性试验,实验动物呈急性出血性败血症,病变剖检发病鸡可见全身皮肤、黏膜、浆膜点状或片状出血;胸腔积液,有纤维素性渗出物;肝表面有密集的针尖大小的灰白色的坏死点;心肌、心冠脂肪、心内外膜点状出血;肠道弥漫性出血。急性败血性死亡症,与宋晓娜发表的论文[21]一致。分离菌致病性强,注射12h就可引起鸡死亡,为强毒株。
3.6由多杀性巴氏杆菌引起的鸡巴氏杆菌病,对多种动物如鸡、鸭、鹅、火鸡等都具易感性[11~14]。 因此,不宜混养。平时,应加强饲养管理,做好免疫接种,定期肌肉注射禽霍乱蜂胶灭活疫苗1mL/只[1]。发生疫病时,应立即隔离患病禽,严格消毒其污染的场所,进行紧急治疗,有条件的养殖场应做药敏试验选择有效药物全群给药。坚持全进全出的饲养制度。
[1]陆承平.兽医微生物学[M].第四版.北京:中国农业出版社,2010.
[2]倪语星,王金良,徐英春,等.抗微生物药物敏感性试验规范[M].第 2 版.上海:上海科学技术出版社,2009.
[3] R.E.布坎南 , N.E.吉本斯,等.伯杰细菌鉴定手册[M].第八版.北京∶科学出版社,1984.
[4]李增魁,侯统楠,罗妍玉,等.天峻县牦牛巴氏杆菌的多重 PCR 检测[J].西北农业学报, 2012, 21(8)∶10~13.
[5]王彩丽,荣俊,王化俊,等.鸡多杀性巴氏杆菌的鉴定和药物敏感试验 [J].湖北农业科学,2010,49(5)∶1162~1165.
[6]周伟,李能章,魏学良,等.雁鸭源荚膜血清A型多杀性巴氏杆菌的分离鉴定[J]中国预防兽医学报,2012,34(6)∶498~500.
[7]张红见,韩志辉 ,李成业,等.牛多杀性巴氏杆菌病病原的分离与鉴定[J].中兽医医药杂志,2005,(3)∶35~36.
[8]唐先春,吴斌,索绪峰,等.猪多杀性巴氏杆菌的分离鉴定及生物学特性研究[J].畜牧兽医学报,2005, 36(6)∶590~595.
[9]汤生玲,房海,陈翠珍.78株禽多杀性巴氏杆菌对10种常用药物的敏感性测定[J].中国畜禽传染病,1987,33(2)∶42~43.
[10]黄海燕,王印,彭娟,等.猪源多杀性巴氏杆菌PCR鉴定方法的建立[J].畜牧兽医学报,2012,43(7)∶1111~1116.
[11]姜志刚,马文戈,于力.牛源A型多杀性巴氏杆菌培养特性和免疫原性的研究 [J].中国预防兽医学报,2010,32(3)∶183~185.
[12]马晓菁,王静梅,剡根强.犊牛肺炎多杀性巴氏杆菌的分离与鉴定[J].中国兽医学报,2010,30(9)∶1193~1196.
[13]颜赟,刁有祥,程彦丽.一株鸭源巴氏杆菌强毒株的分离鉴定及致病性研究[J].中国兽医科学, 2010,40(6)∶584~588.
[14]孙翠平,王金良,李书光.雏鸭源多杀性巴氏杆菌的分离鉴定和荚膜 PCR 分型[J].中国预防兽医学报,2011,37(7)∶521~525.
[15]刘红玉,邵周伍林,李刚,等.一株鹅源巴氏杆菌的分离鉴定及耐药性分析[J].中国兽医科学,2014(2)∶119~123.
[16]黄忠森,王强,左瑞华.猪巴氏杆菌病——猪肺疫的诊断与防治[J].畜牧与饲料科学,2009(1)∶103~106.
[17]马增军,芮萍,张军辉,等.猪源多杀性巴氏杆菌分离鉴定与药敏试验[J].畜牧与兽医,2015(7)∶93~95.
[18]杜冬华,周静,孙继国.雏鸡多杀性巴氏杆菌的分离鉴定及药敏试验[J].今日畜牧兽医,2006(11)∶4~5.
[19]林逢生,王永林,华育平.梅花鹿多杀性巴氏杆菌病病原体的分离鉴定及其荚膜分型的研究 [J].东北林业大学学报,1993(1)∶49~53.
[20]罗凤珍,张衍俊.多杀性巴氏杆菌和沙门氏菌的分离与鉴定[J].山东畜牧兽医,2005(4)∶1~2.
[21]宋晓娜.鸭源巴氏杆菌的分离鉴定及致病性研究[D].山东农业大学,2012.

