抗菌肽对稻瘟病菌的抑菌活性测定
毛雪琴,刘 伟,邱海萍,张 震,柴荣耀,王教瑜,王艳丽,宋凤鸣,孙国昌*
(1.浙江大学 农业与生物技术学院,浙江 杭州 310058; 2.浙江省农业科学院 植物保护与微生物研究所,浙江 杭州 310021)
稻瘟病是由子囊菌Magnaporthegrisea引起的,是水稻生产上的重要病害[1-2]。目前,稻瘟病的防治主要以抗病育种和化学防治为主,化学防治高效、简单,然而其大量、广泛的使用,不仅带来病原菌耐药性问题,同时易造成农药残留、破坏生态平衡等,因而在加强抗病育种工作的同时,高效、低毒、低残留及低选择压的杀菌剂开发,仍是稻瘟病防治研究的重要内容。
近年来,通过筛选对病原菌具有抑菌活性的天然多肽,并利用基因工程手段来获得多肽产物的研究,成为植物病害防控的新热点。抗菌肽(antimicrobial peptides)是天然免疫的重要介质,是生物机体在抵御病原微生物的防御反应过程中所产生的一类具有抗菌活性的短肽[3-4]。它不仅能抗原虫、病毒或肿瘤细胞,而且抗多种细菌或真菌,对革兰氏阳性菌、革兰氏阴性菌、真菌均有抑杀作用[5-6]。抗菌肽具有理化性质稳定、抗菌谱广,不易产生耐药性等特点,因而可作为农用抗生素的理想替代品,而且基因工程技术的发展,极大促进了抗菌肽的研究和开发,通过抗菌肽基因的克隆与表达,使其大量生产成为可能。
本文以广谱抗菌肽Caseicin A序列为基础,通过人工设计编码,委托Invitrogen公司合成的28种抗菌肽,探讨了其对稻瘟病菌的孢子萌发、附着胞形成和菌丝生长等的影响。根据抑菌活性测定结果,利用盆栽试验评价了抗菌肽对水稻稻瘟病的防治效果,为抗菌肽产品的开发利用提供理论指导。
1 材料与方法
1.1 供试菌株和抗菌肽
稻瘟病菌株2011-8-2,由本实验室分离保存;抗菌肽以广谱抗菌肽Caseicin A序列为基础人工设计编码,由Invitrogen公司合成,抗菌肽序列及相关信息见表1。
1.2 利用孢子萌发法初筛对稻瘟病菌具有抑菌活性的抗菌肽
1.2.1 稻瘟菌孢子制备
将菌株2011-8-2从保存的稻节培养基活化转接至CM培养基平板中,于28 ℃黑暗条件下培养3~5 d。将上述活化后的菌株接种在燕麦培养基上于28 ℃黑暗培养,3~5 d后于黑光灯下照射5~7 d,诱导分生孢子产生。向平板中加10 mL无菌水,将孢子洗出并过滤,用无菌水制成浓度为1×105mL-1的孢子悬浮液备用。
1.2.2 抗菌肽的溶解
配制1×TE Buffer(500 mL),方法:量取1 mol·L-1Tris-HCl Buffer(pH值8.0)5 mL、0.5 mol·L-1EDTA(pH值8.0)1 mL,将上述溶液加入到500 mL试剂瓶中,加入约400 mL ddH2O均匀混合;将溶液定容到500 mL后,调节pH值为7.5,高温高压灭菌;室温保存备用。根据抗菌肽(表1)干粉的质量,加入相应量的1×TE Buffer,振荡混匀,将各抗菌肽终浓度调至20 mmol·L-1。
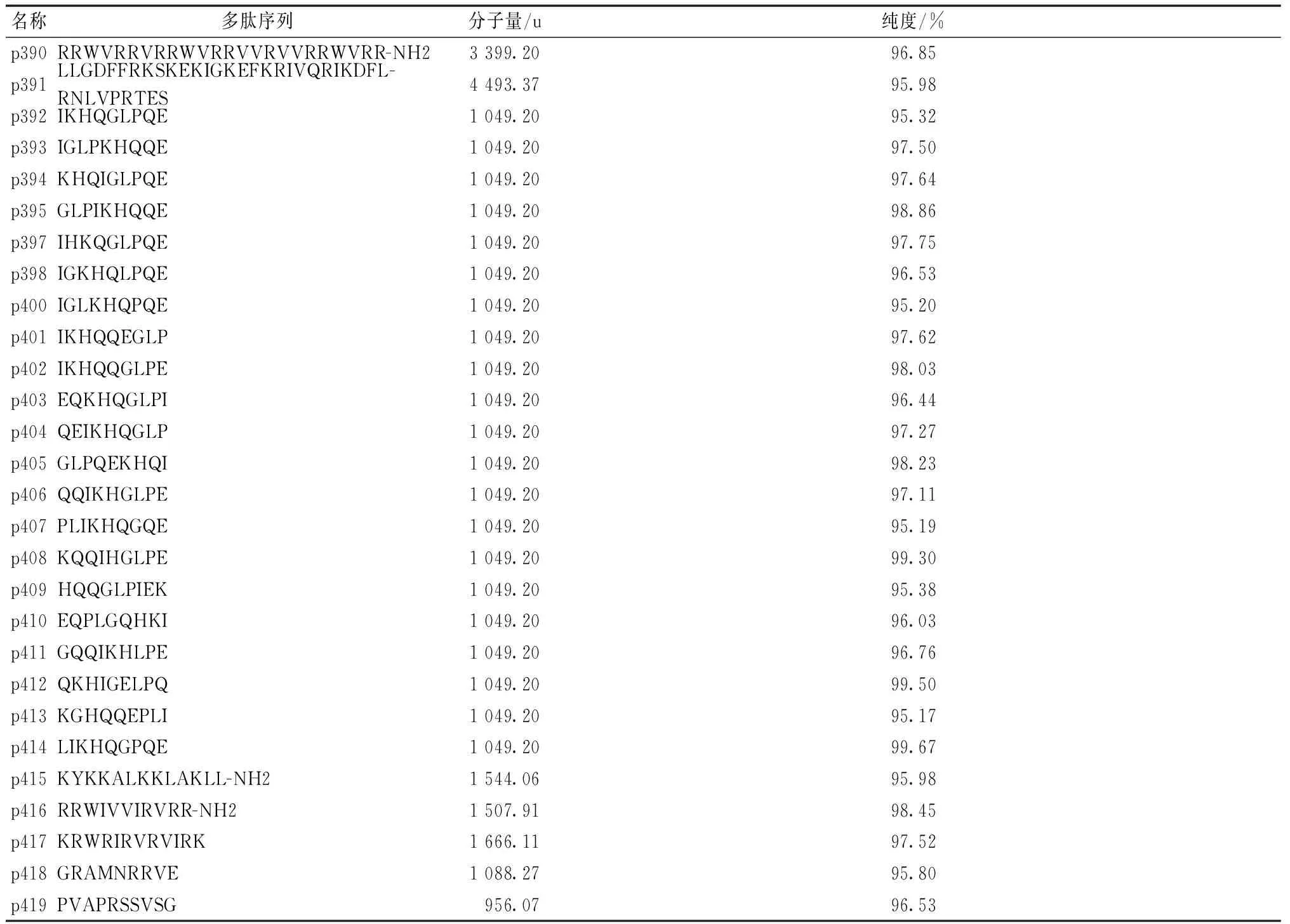
表1 试验所涉及的抗菌肽相关信息
1.2.3 主要培养基
CM培养基配方(1 L):20×Nitrate salts 50 mL,微量元素1 mL,葡萄糖10 g,胰蛋白胨2 g,酵母提取物1 g,酪蛋白氨基酸1 g,维生素1 mL,加ddH2O至1 L,调节pH值至6.5;固体CM需另加18 g琼脂粉。分装后,高压灭菌,室温保存。
20×Nitrate salts配方(1 L):NaNO3120 g,KCl 10.0 g,MgSO410.0 g,KH2PO430.0 g,加ddH2O至1 L,4 ℃避光保存。
1 000×Vitamin solution(维生素)配方(1 L):Biotin(维生素H)0.01 g,Pyridoxin(吡哆醇)0.01 g,Thiamine[硫胺素(维生素B1)]0.01 g,Riboflavin(核黄素)0.01 g,PABA(p-aminobenzonic acid)对氨基苯甲酸0.01 g,Nicotinic acid(烟酸)0.01 g,加ddH2O至1 L,4 ℃避光保存。
1 000×Trace Elements 微量元素配方(1 L):ZnSO4·7H2O 2.2 g,H3BO31.1 g,MnCl2·4H2O 0.5 g,FeSO4·7H2O 0.5 g,CoCl2·6H2O 0.17 g,CuSO4·5H2O 0.16 g,Na2MoO4·5H2O 0.15 g,Na4EDTA 5 g,加ddH2O至1 L,4 ℃避光保存。
燕麦培养基配方(1 L):称取50 g燕麦片置于1 L蒸馏水,沸水浴中加热1 h,之后用纱布滤掉燕麦渣,用蒸馏水补足到1 L,加琼脂粉18 g,分装后,高压灭菌,常温保存。
1.2.4 孢子萌发抑制测定
将实验所需的凹玻片高压灭菌,将不同浓度的抗菌肽分别加入到1.2.1节的孢子悬浮液中,使总体积为100 μL的体系中多肽浓度分别为0.1、0.2、0.4、0.8、1.6和3.2 mmol·L-1等不同梯度,每个梯度4个重复,以不加抗菌肽为空白对照(表2)。将上述体系加到灭菌后的凹玻片上,并置于加垫湿滤纸的培养皿中,于28 ℃黑暗保湿培养,24 h后对孢子的萌发情况进行观察,记录不同浓度下孢子萌发、附着胞形成等情况,统计数据,计算孢子萌发抑制率和附着胞形成抑制率,试验重复2次。孢子萌发抑制率=(对照的孢子萌发率-处理的孢子萌发率/对照的孢子萌发率)×100;附着胞抑制率=(对照的附着胞形成率-处理的附着胞形成率/对照的附着胞形成率)×100。
1.3 利用平板抑菌法筛选对稻瘟病菌菌丝生长具有抑制作用的抗菌肽
从活化后的稻瘟病菌株2011-8-2的CM平板上,取直径为5 mm的菌饼接种到一个新的CM平板的中心点上,于28 ℃黑暗条件下培养。将1.2节中选出的对稻瘟病菌孢子萌发具有抑制效果的抗菌肽,浓度调整至0.1、0.2、0.4、0.8和1.6 mmol·L-1等不同梯度。将灭菌后的牛津杯放入上述培养3 d后的菌株平板中,距离菌饼3 cm处均匀摆放4个牛津杯,其中3个牛津杯中加入不同浓度的抗菌肽,第4个牛津杯中加入清水作为对照,于28 ℃黑暗条件下继续培养,观察稻瘟病菌的生长情况,记录抗菌肽对稻瘟病菌的抑制效果。
1.4 稻瘟病盆栽防效测定
1.4.1 水稻苗的培养
将水稻品种丰两优香1号的种子经催芽后播种于装有育秧土的盆钵里,每盆均匀撒播20粒种子,播种后放置水槽中,水槽保水深度为5 cm,酌施氮肥,保持嫩绿,选择其中长势一致的10株3叶1心期水稻苗备用。
1.4.2 稻瘟病接种
用孢子悬浮液喷雾接种,孢子浓度为1×105mL-1,接种量以所有叶片上布满孢子液为限。接种后置于26 ℃的恒温室内,遮光保湿24 h,以促进病情的发展。
1.4.3 抗菌肽处理
在稻瘟病菌接种24 h后,将p390和p415这2种抗菌肽分别稀释至0.1、0.2、0.4、0.8和1.6 mmol·L-1等不同浓度,均匀喷施于叶面至全部湿润,设清水处理作空白对照,每处理4次重复。待药液自然风干后,将处理后的水稻置于26~28 ℃的恒温室内,12 h光暗交替,相对湿度90%以上的条件下培养。6 d后调查,病害分级、防效计算参照中华人民共和国农业行业标准《农药室内生物测定试验准则》。
2 结果与分析
2.1 抗菌肽对孢子萌发的抑制效果
采用孢子萌发法测定了28种抗菌肽对稻瘟病菌的抑制效果,结果表明28种抗菌肽中对稻瘟病菌孢子萌发有抑制作用的有10个:p390、p391、p392、p393、p397、p409、p412、p415、p416、p417。其中,抗菌肽p390对稻瘟病菌的孢子萌发和附着胞的形成有显著的抑制作用,最低处理浓度0.1 mmol·L-1时,对稻瘟病菌孢子萌发的抑制率达到100%,完全抑制了稻瘟菌孢子的萌发,对附着胞的分化和发育抑制率也达到100%(图1)。当处理浓度为0.2 mmol·L-1时,对稻瘟病菌孢子萌发抑制率达100%的抗菌肽有p415和p416,对附着胞的分化和发育抑制率达100%的抗菌肽有p391、p415和p416。综合以上结果,我们筛选出对稻瘟病菌孢子萌发有较好抑制效果的抗菌肽为p390、p415和p416(表2~3)。

A,清水对照;B,p390多肽浓度为0.1 mmol·L-1;C,p390多肽浓度为0.2 mmol·L-1;D,p390多肽浓度为0.4 mmol·L-1;E,p390多肽浓度为0.8 mmol·L-1;F,p390多肽浓度为1.6 mmol·L-1;G,清水对照;H,p395多肽浓度为0.2 mmol·L-1;I,p395多肽浓度为0.4 mmol·L-1;J,p395多肽浓度为0.8 mmol·L-1;K,p395多肽浓度为1.6 mmol·L-1;L,p395多肽浓度为3.2 mmol·L-1图1 抗菌肽对稻瘟病菌孢子萌发和附着胞形成的抑制效果
2.2 平板抑菌法筛选抗菌肽结果
通过平板抑菌法测定了抗菌肽p390、p415和p416对稻瘟病菌菌丝生长的抑制效果,发现抗菌肽p416对稻瘟病菌菌丝生长的抑制作用不明显。抗菌肽p390和p415在处理浓度达到1.6 mmol·L-1时,出现了明显的抑菌圈。图2为不同浓度的抗菌肽p390对稻瘟病菌菌丝生长的抑制效果。
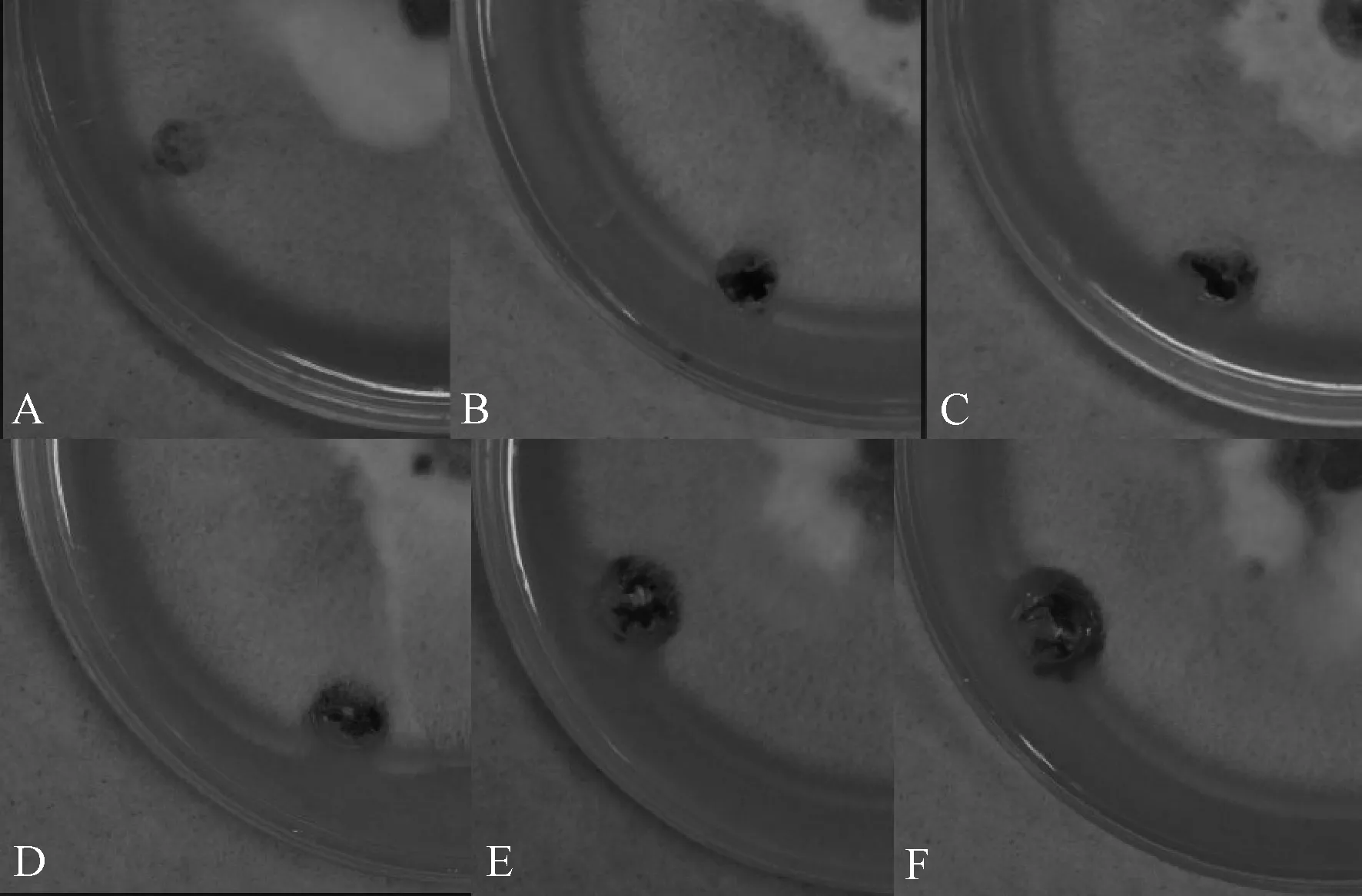
A,清水对照;B,p390浓度为0.1 mmol·L-1;C,p390浓度为0.2 mmol·L-1;D,p390浓度为0.4 mmol·L-1;E,p390浓度为0.8 mmol·L-1;F,p390浓度为1.6 mmol·L-1图2 不同浓度的抗菌肽p390对稻瘟病菌丝生长的抑制效果
2.3 抗菌肽防治水稻稻瘟病盆栽试验
选用抗菌肽p390和p415进行了防治水稻稻瘟病温室盆栽试验。结果表明,抗菌肽p390、p415对稻瘟病具有较好的防治效果,随着抗菌肽浓度的增加防治效果明显加强,当抗菌肽p390浓度为0.2 mmol·L-1时,防治效果达到50%以上,而p415浓度为0.8 mmol·L-1时,防治效果也达到50%以上,p390的防治效果好于p415(表4)。

表2 16种抗菌肽对稻瘟病菌孢子萌发和附着胞形成的抑制效果
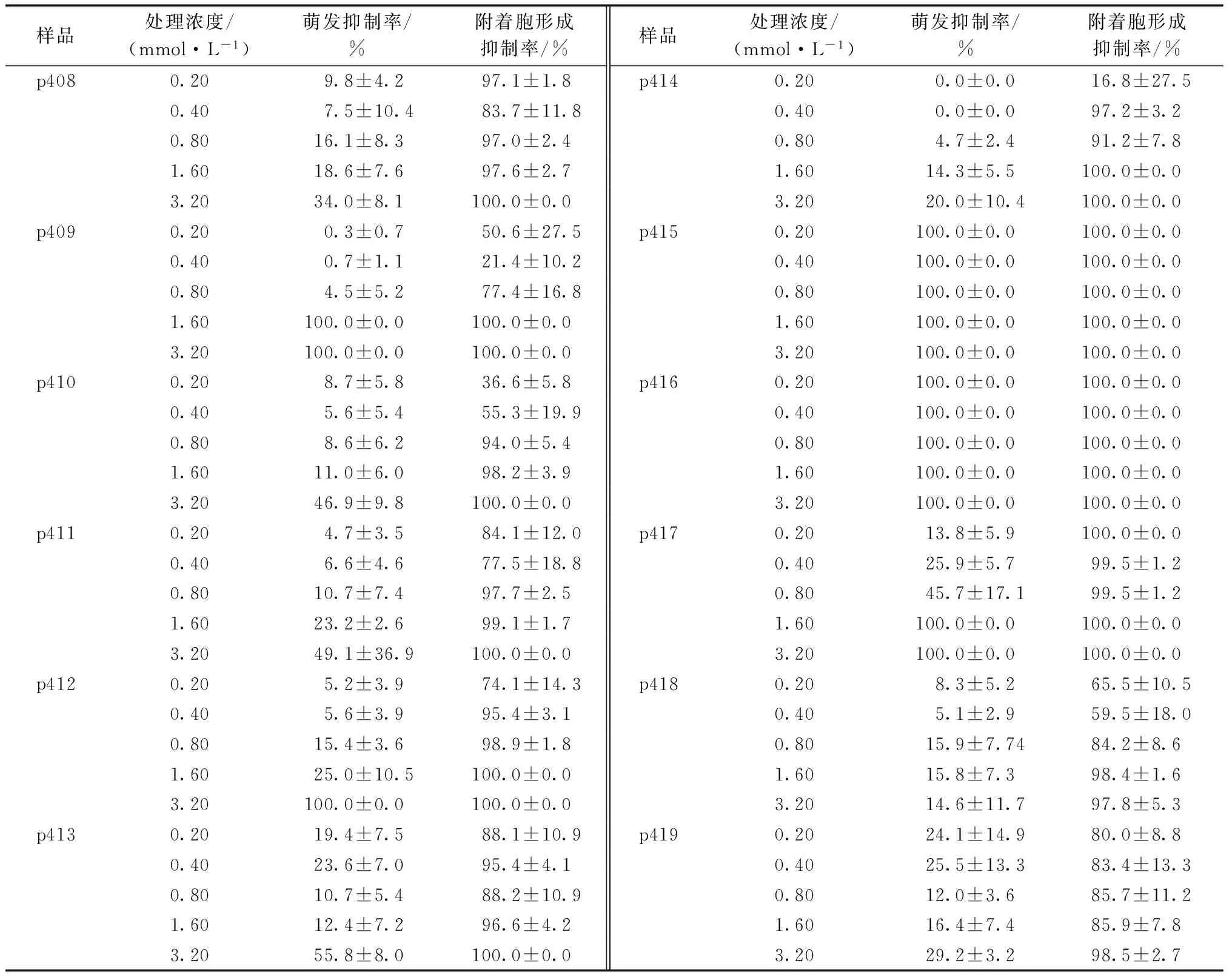
表3 12种抗菌肽对稻瘟病菌孢子萌发和附着胞形成的抑制效果
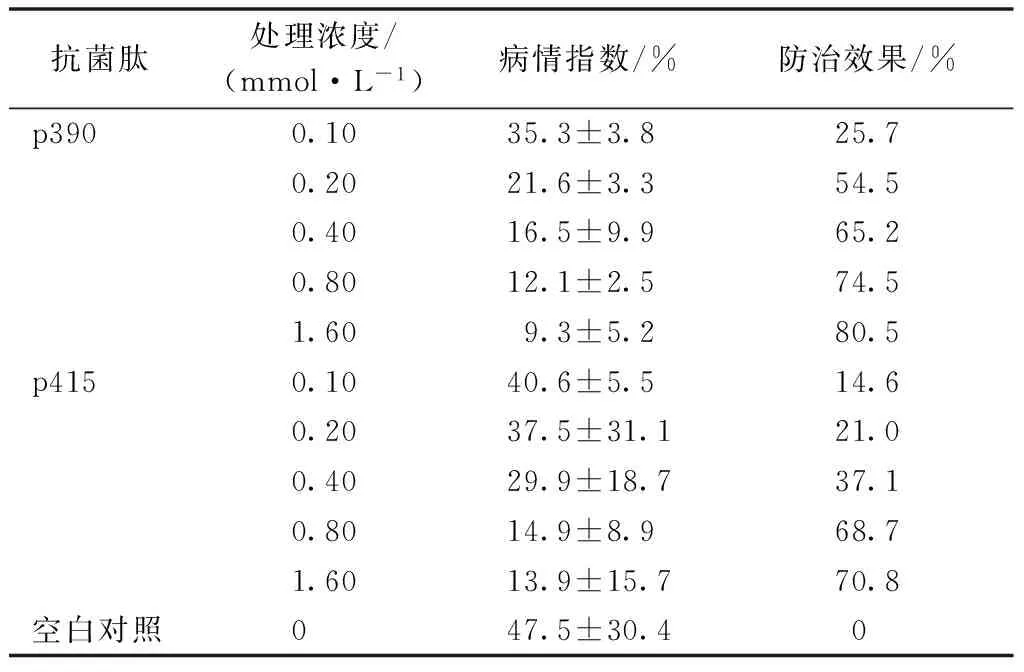
表4 在温室条件下p390、p415对水稻稻瘟病的 防治效果
3 小结与讨论
本研究对源自酪蛋白Casein的28种抗菌肽进行了其对稻瘟病菌孢子萌发和附着胞形成的抑制作用测定,结果表明28种抗菌肽中对稻瘟病菌孢子萌发有抑制作用的有p390、p391、p392、p393、p397、p409、p412、p415、p416和p417。其中,浓度较低时,对稻瘟病菌萌发的抑制率就达到100%的抗菌肽有p390、p415和p416。将筛选出的抗菌肽p390、p415和p416进行平板抑菌试验,结果表明,p416对稻瘟病菌的菌丝生长基本没有抑制作用,而抗菌肽p390和p415对稻瘟病菌的菌丝生长有一定的抑制效果,随着浓度的增加,抑制效果逐渐增强。综合上述实验结果,进一步研究了p390和p415这2种抗菌肽对稻瘟病盆栽防治效果。盆栽防治试验表明这2种抗菌肽对水稻稻瘟病具有一定的防治效果。当抗菌肽p390浓度为0.2 mmol·L-1,p415浓度为0.8 mmol·L-1时,防治效果均达到50%以上,抗菌肽p390的防治效
果优于p415。以上研究结果表明抗菌肽p390在较低浓度时,对稻瘟病有较好的抑制作用,表明该抗菌肽有作为农用杀菌剂进行开发利用的可能性。
[1] COUCH B C,KOHN L M.A multilocus gene genealogy concordant with host preference indicates segregation of a new species,Magnaportheoryzae,fromM-grisea[J].Mycologia,2002,94(4):683-693.
[2] ASHIKAWA I,HAYASHI N,YAMANE H,et al. Two adjacent nucleotide-binding site-leucine-rich repeat class genes are required to confer Pikm-specific rice blast resistance[J].Genetics,2008,180(4):2267-2276.
[3] 杨阳,孙红瑜,金光耀,等. 抗菌肽的作用机理及应用前景[J]. 中国林副特产,2010,6(1):103-104.
[4] 刁昱文,赵红蕾,高宇,等. 抗菌肽的研究进展[J]. 河北科技师范学院学报,2011,25(1):61-65.
[5] 陈星星,陈宏惠,郑新添. 抗菌肽的研究进展及其在畜牧业上的运用[J]. 福建畜牧兽医,2011,33(1):20-22.
[6] 邬晓勇,何钢,颜军,等. 抗菌肽抑菌活性测定方法的研究[J]. 生物学通报,2011,46(4):44-47.

