响应面法优化桂皮胶的提取工艺
寇莹莹,仝其根,2,*
(1.北京农学院食品科学与工程学院,北京 102206;2.食品质量与安全北京实验室,北京 102206)
桂皮(Cinnamon)为樟树科(Lauraceae)樟属植物肉桂、天竺桂或川桂等树皮经烘干等一系列前处理而成,具有特殊香气,在食品加工和医药方面都有很高的利用价值[1-3]。作为最常用的香辛料之一,桂皮主要用于烹调肉类制品,也用于腌渍、发酵及烘焙。随着人们对桂皮利用价值的认识,关于桂皮提取成分的研究及应用越来越广泛[4]。近年来国内外关于桂皮油的研究主要集中在对其成分以及其抗菌抗炎作用机理的研究[5-7]。国外有研究显示从桂树胚乳中提取出桂皮胶,并在80年代对其胶毒理学进行了相关研究[8-9]。而从桂皮中提取桂皮胶的提取工艺研究在国内及国外都尚未有报道,仝其根[10]提出了一种桂皮提取物的提取方法,通过有机溶剂浸提、加水进行高温高压处理等方法将桂皮中所有有用物质进行分离,分离后的最终产物有桂皮油、桂皮鞣质、桂皮色素、桂皮胶四大产品,提高了桂皮的利用率。用此方法提取的桂皮胶在水中溶解度良好,可以形成粘稠的液体,加热则形成胶状液体,这些特点与化学添加剂聚丙烯酸钠性质相似[11],且较化学添加剂来说更加安全无害,使得其在食品加工领域有着很大的发展前景,可用于替代其它增稠剂在生湿面制品、肉类等食品加工中的作用[12-14],或与其它食用胶混合制成复合胶,增强其粘度和在不同环境条件下的稳定性。
本实验采用上述方法,以经过去脂脱色的桂皮粉为原料,以水为提取介质对高温高压提取桂皮胶的工艺条件进行优化。通过响应面分析法分析影响桂皮胶提取量的四个主要因素(pH、料液比、提取温度,提取时间)及其交互作用,确定最优工艺参数,实现优化桂皮胶提取量的目的。从生产角度出发,可以有效利用原材料,增加桂皮的综合加工产品种类,也为下一步胶的纯化及应用功能研究提供理论基础。
1 材料与方法
1.1 材料与仪器
桂皮 从产地广西直接采购;无水乙醇、石油醚(60~90 ℃)、盐酸、硫酸、苯酚试剂 分析纯,北京化工厂;HF131198透析袋CE膜 美国光谱医学。
FW135中药粉碎机 天津市泰斯特仪器有限公司;QM-WX04卧式行星球磨机 南京大学仪器厂;DL-101电热恒温鼓风干燥箱 天津市中环实验电炉有限公司;JJ100型精密电子天平 常熟双杰测试仪器厂;SoxtecTM2045索氏提取系统 福斯中国有限公司;RE-52AA旋转蒸发器、B-220水浴锅 上海亚荣生化仪器厂;S2Z-3型循环水式多用真空泵 海知信实验仪器技术有限公司;PHS-3E pH计 上海仪电科学仪器股份有限公司;LDZM-80KCS立式压力蒸汽灭菌器 上海申安医疗器械厂;3H20RI智能台式高速冷冻离心机 湖南赫西仪器装备有限公司;LGJ-18冷冻干燥机 北京松源华兴科技发展有限公司;KQ-B玻璃仪器气流烘干器 北京中兴伟业仪器有限公司;T6紫外可见光分光光度计 北京普析通用仪器有限责任公司。
1.2 实验方法
1.2.1 桂皮前处理 将桂皮清洗、在通风干燥处自然阴干后切片,用中药粉碎机粉碎后过40目筛。称取适量桂皮粉末置于索氏抽提系统的浸提纸筒中,按1∶20 (g/mL)料液比在提取杯中加入石油醚,70 ℃下浸提2 h。收集溶剂,将桂皮粉末置于40 ℃鼓风干燥箱烘干至重量恒定[15]。将去脂桂皮粉末和85%乙醇溶液按1∶15 (g/mL)料液比置于旋转蒸发器的烧瓶中,在40 ℃条件下水浴浸提1 h,抽滤,收集滤液,重复此步骤三次,滤渣放置在40 ℃干燥箱烘干后,得到去除油脂、鞣质及色素的桂皮粉末[16]。
1.2.2 高温高压处理提取桂皮胶 将经过1.2.1处理的桂皮粉末放入卧式行星球磨机中再次研磨,将其分别过60~140目筛的桂皮粉末,准确称取适量桂皮粉末置于锥形瓶中,按一定料液比加入去离子水搅拌均匀,调节不同的pH,放入压力蒸汽灭菌器,通过控制压力蒸汽灭菌器的工作温度和时间来实现桂皮胶的提取。待混合溶液温度降至室温,在5000 r/min的条件下离心15 min,收集上清液放入经过预处理的透析袋(3.5~5 kDa)中,处理24 h。将所得桂皮胶混合液在40 ℃下旋转蒸发浓缩得到粘稠的糖浆状流体,冷冻干燥72~96 h,得到恒重的浅红棕色片状桂皮胶粗品。
1.2.3 桂皮胶提取量的测定 将冷冻干燥得到的桂皮胶粗品准确称重,提取量按下式计算:
桂皮胶提取量(mg/g)=桂皮胶粗品的质量(mg)/原料质量(g)
1.2.4 桂皮胶提取的单因素实验
1.2.4.1 粉碎粒度对桂皮胶提取量的影响 准确称取5份桂皮粉末,分别过60、80、100、120、140目筛,固定料液比1∶40 (g/mL)加入去离子水,调混合液pH至5.0,120 ℃条件下高温高压提取30 min,计算提取量,考察不同粉碎粒度对桂皮胶提取量的影响。
1.2.4.2 液料比对桂皮胶提取量的影响 准确称取5份粒度为100目的桂皮粉末,分别按料液比1∶20、1∶30、1∶40、1∶50、1∶60 (g/mL)加入去离子水,调节pH至5.0,120 ℃条件下高温高压提取30 min,然后按照1.2.2方法处理得到桂皮胶粗品,计算提取量,考察不同液料比对桂皮胶提取量的影响。
1.2.4.3 pH对桂皮胶提取量的影响 准确称取5份粒度为100目的桂皮粉末,调节去离子水的pH至2.0、3.0、4.0、5.0、6.0,固定料液比1∶40 (g/mL),120 ℃条件下高温高压提取30 min,然后按照1.2.2方法处理得到桂皮胶粗品,计算提取量,考察不同pH对桂皮胶提取量的影响。
1.2.4.4 提取温度对桂皮胶提取量的影响 准确称取5份粒度为100目的桂皮粉末,固定料液比1∶40 (g/mL),调节pH至5.0,设置压力蒸汽灭菌器温度分别为90、100、110、120、130 ℃下,高温高压提取30 min,然后按照1.2.2方法处理得到桂皮胶粗品,计算提取量,考察不同提取温度对桂皮胶提取量的影响。
1.2.4.5 提取时间对桂皮胶提取量的影响 准确称取5份粒度为100目的桂皮粉末,固定料液比1∶40 (g/mL),调节pH至5.0,设置温度为120 ℃,分别提取10、20、30、40、50 h,然后按照1.2.2方法处理得到桂皮胶粗品,计算提取量,考察不同提取时间对桂皮胶提取量的影响。
1.2.5 响应面优化 根据Box-Behnken实验设计原理建立四因素三水平的模型,利用统计分析软件Design-Expert 8.0.6对数据进行拟合、优化桂皮胶提取量的工艺条件。根据单因素实验结果,综合考虑各因素对高温高压浸提法得到桂皮胶提取量的影响,选取以pH(A)、料液比(B)、提取温度(C)、提取时间(D)为自变量,自变量的实验水平以-1、0、1作为编码值,设计29组实验点,其中24组为析因点,5组为区域的中心零点,用于估计实验误差,实验设计方案见表1。

表1 Box-Behnken实验设计因素和水平Table 1 Factor and levels used in response surface experiment
1.2.6 桂皮胶提取物中总糖含量测定
1.2.6.1 葡萄糖标准溶液的配制 取葡萄糖标准品于105 ℃恒温烘干至恒重,精确称取0.100 g葡萄糖于100 mL烧杯中,加水溶解,定容至1000 mL,置于4 ℃冰箱中贮存,得到0.1 mg/mL的葡萄糖标准溶液。
1.2.6.2 苯酚溶液的配制 称取80 g经过重蒸馏的苯酚于100 mL烧杯中,加水溶解,转至100 mL棕色容量瓶中定容,置于4 ℃冰箱中避光保存,得到80%苯酚溶液。吸取5 mL 80%苯酚溶液溶于75 mL水中混匀,得到5%的苯酚溶液,5%苯酚溶液使用前现用现配。
1.2.6.3 标准曲线的绘制 分别吸取0、0.2、0.4、0.6、0.8、1 mL的葡萄糖标准溶液置于20 mL具塞试管中,用蒸馏水补至1.0 mL,向试液中加入1.0 mL 5%的苯酚溶液,然后快速加入5.0 mL硫酸,静置10 min,使用旋涡振荡器使反应液充分混合,然后将试管放置于30 ℃水浴中反应20 min,于490 nm处测吸光度,以葡萄糖浓度(C,mg/mL)为横坐标,以吸收度(A)为纵坐标,绘制标准曲线。
1.2.6.4 桂皮胶总糖含量测定 准确称量冻干后得到的桂皮胶样品0.010 g定容于100 mL容量瓶,取1 mL置于20 mL具塞试管,试液中加入1.0 mL 5%的苯酚溶液,然后快速加入5.0 mL硫酸,静置10 min,使用旋涡振荡器使反应液充分混合,然后将试管放置于30 ℃水浴中反应20 min,于490 nm处测吸光度。
1.3 数据处理
上述实验所得数据均经过3次重复实验求得的平均值,单因素实验结果利用Microsoft Excel和Spass Statiatics 17.0对数据进行统计学分析,采用两两比较的单因素方差分析法得出显著性影响,用p值表示,p<0.05表示具有显著性差异,p<0.01表示具有极显著性差异,用Origin7.5软件绘制趋势曲线图,响应面实验采用Design-Expert8.0.6软件进行拟合分析,并优化出最佳提取工艺。
2 结果与分析
2.1 单因素实验结果
2.1.1 粉碎粒度对桂皮胶提取量的影响 如图1所示,不同粒度的桂皮粉末对桂皮胶的提取量有显著性影响(p<0.05),在其他提取条件一定时,桂皮胶提取量随桂皮粉过筛目数的增大而增大,样品粉碎后有助于提高提取量。当粒度在60~100目范围内,随着目数的增加,桂皮胶提取量呈明显上升趋势,说明在一定范围内,颗粒越小,原料的比表面积越大,增加了桂皮粉与水的接触面积,有利于胶更多的溶解到水中[17-18],其中100目时桂皮胶提取量最高,此时桂皮胶提取量为173.2 mg/g,当粒度大于100目时,提取效果不再发生明显变化,并且考虑到若将原材料粉碎得过细,需要耗时较长,因此在后续利用响应面对实验进行设计时不考虑颗粒粒度作为桂皮胶提取工艺的主要因素,一律采用粉碎粒度为100目的桂皮粉。

图1 粉碎粒度对桂皮胶提取量的影响Fig.1 Effect of particle size on the extraction quantity of Cinnamon gum注:不同字母表示显著性差异(p<0.05);图2~图5。
2.1.2 料液比对桂皮胶提取量的影响 如图2所示,不同料液比对桂皮胶的提取量有显著性影响(p<0.05),料液比在1∶10~1∶40 (g/mL)范围内,随着浸提溶剂和溶质的比值增大,桂皮胶提取量呈明显的上升趋势,说明在一定范围内增加提取剂的使用量,可以提高固液两相体系的质量浓度梯度,有利于加快有效成分的扩散速率,提高桂皮胶提取量。当料液比超过1∶40 (g/mL)后,可能由于溶质的浓度梯度减小到趋于零,提取量无明显变化,虽然提取液中依然具有浓度差,但传质动力不再增加[22-23],桂皮胶溶出减缓,过多的提取剂不利于后期上清液的浓缩,不仅增加浓缩时间,也容易在长期浓缩过程中造成桂皮胶质量的损失。在预实验中发现,桂皮胶的吸水性极强,料液比低于1∶30 (g/mL)时,桂皮粉末不能充分与提取剂混合,影响提取效果,结合图2可知在1∶40 (g/mL)料液比条件下,桂皮胶提取量最高,达到174.8 mg/g,与料液比1∶30 (g/mL)(155.1 mg/g)的条件下提取的桂皮胶提取量具有显著性差异(p<0.05),表明在料液比1∶40 (g/mL)的条件下桂皮胶提取效果好。
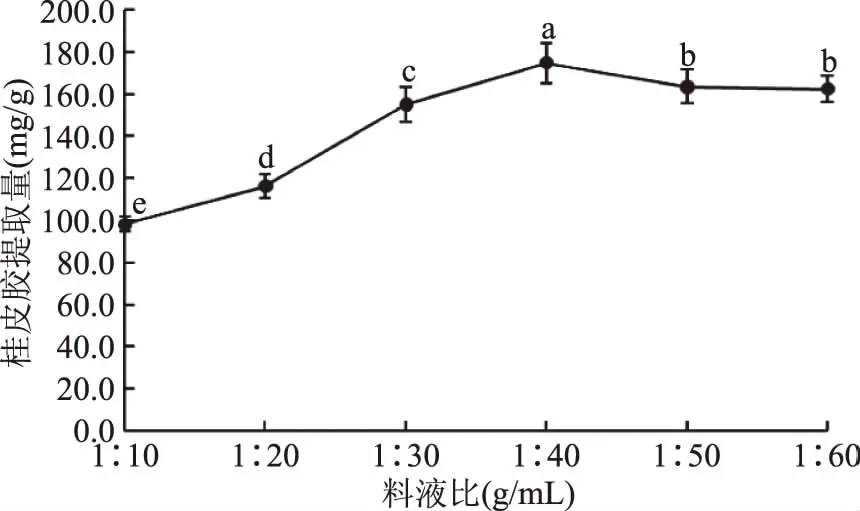
图2 料液比对桂皮胶提取量的影响Fig.2 Effect of solid to liquid ratio on the extraction quantity of Cinnamon gum
2.1.3 pH对桂皮胶提取量的影响 如图3所示,不同pH对桂皮胶的提取量有显著性影响(p<0.05),在pH范围在2.0~3.0时,桂皮胶的提取量较低,原因可能是pH过低时,桂皮胶在高温酸性环境下不稳定发生水解成分子量在3.0KD以下的单糖、多聚糖以及低分子质量多糖等[19-21],后经透析袋处理去除这些小分子物质,导致桂皮胶提取量较低,在pH为5.0的条件下,桂皮胶的提取量最大,达到180.0 mg/g,当pH高于5.0至接近中性时,提取量趋于稳定,结合数据进行分析,选择pH5.0为最佳提取条件。

图3 pH对桂皮胶提取量的影响Fig.3 Effect of pH on the extraction quantity of Cinnamon gum
2.1.4 提取温度对桂皮胶提取量的影响 如图4所示,不同提取温度对桂皮胶的提取量有显著性影响(p<0.05),水提温度在90~120 ℃范围内,桂皮胶提取量随着温度的升高呈快速上升趋势,当温度超过120 ℃,桂皮胶提取量逐渐下降。预实验中在100 ℃以内水浴条件下对桂皮粉进行浸泡、搅拌无法达到理想的提取效果,桂皮胶不能同木质素分离。经高压提取,桂皮胶能够以胶体形式溶出,高温条件降低了桂皮胶遇水溶胀后的粘稠状态(利用旋转粘度计测量,高温提取后的桂皮胶提取液冷却后的最大粘度值为115 mPa·s),也增加了桂皮胶在水中的溶解度,并且在将提取液浓缩冷却至室温后可以基本恢复桂皮胶的黏度,达到提取效果[24-25]。当温度高于120 ℃时,持续高温处理可能会使桂皮胶发生水解,从而导致提取量下降,因此选择120 ℃为最佳提取温度。

图4 提取温度对桂皮胶提取量的影响Fig.4 Effect of extraction temperature on the extraction quantity of Cinnamon gum
2.1.5 提取时间对桂皮胶提取量的影响 如图5所示,不同提取时间对桂皮胶的提取量有显著性影响(p<0.05)。本实验中加压升温过程均控制在15 min内完成,提取结束时待温度降到100 ℃以下,放气减压,其中提取时间在10~30 min范围内,桂皮胶提取量呈迅速上升趋势,这是因为在一定料液比和温度压强的条件下,桂皮胶从木质素中迁移到溶剂中需要一定时间才能达到溶出平衡,达到平衡后提取率的变化很小,其中高温高压处理时间为30 min时,桂皮胶提取量最高,此时桂皮胶提取量为175.9 mg/g,当提取时间大于30 min,桂皮胶提取量趋于平缓,因此,若提取时间太短,桂皮胶溶出会不充分,而提取时间过长会增大提取成本[25-26],综合考虑,选择30 min为最佳提取时间。

图5 提取时间对桂皮胶提取量的影响Fig.5 Effect of extraction time on the extraction quantity of Cinnamon gum
2.2 响应面优化实验
2.2.1 响应面实验结果 根据单因素实验结果,利用Design-Expert8.0.6软件,设计的四因素三水平Box-Behnken中心组合实验,实验设计及结果见表2。

表2 响应面实验设计方案及实验结果Table 2 The experimental design and results for response surface analysis

表3 拟合模型显著性检验结果Table 3 Analysis of variance for the regression equation
注:**表示差异极显著(p<0.01),*表示差异显著(p<0.05)。
2.2.2 拟合模型的建立和模型的显著性分析 利用Design-Expert8.0.6软件对表2中数据进行多元二次回归拟合,建立桂皮胶提取量的多元二次回归模型,分析自变量对于响应值的影响,得到桂皮胶提取量(Y)的多元二次回归模型:
Y=185.48+3.63A+1.75B+5.04C+1.91D+0.18AB+0.90AC+0.13AD+4.62BC-2.90BD+0.30CD-6.26A2-4.96B2-6.95C2-4.60D2

2.2.3 响应面分析 通过Design Expert软件对四个因素的交互作用进行分析,绘制6组响应面图和等高线图,响应面图形是由响应值Y和影响因子A、B、C、D之间的关系构成的三维立体结构图,根据二次线性回归模型绘制出的图像,直观表示四个因素对桂皮中提取桂皮胶含量的交互作用。其中响应面坡度越陡峭,表示该因素对于其他因素的改变越敏感,对桂皮胶提取量的影响越大。等高线可以非常直观地反映两因素交互作用的显著程度,其中椭圆形表示两因素之间作用显著,而接近圆形则表示不显著。利用软件做出的响应面图如图6~图11所示,显示四个变量中任取两个变量为零水平时,其余两个变量同时变化对桂皮胶提取量的影响。

图6 pH和料液比对桂皮胶提取量的影响Fig.6 Effect of pH and solid to liquid ratio on the extraction quantity of Cinnamon gum

图7 pH和提取温度对桂皮胶提取量的影响Fig.7 Effect of pH and extraction temperature on the extraction quantity of Cinnamon gum

图8 pH和提取时间对桂皮胶提取量的影响Fig.8 Effect of pH and extraction time on the extraction quantity of Cinnamon gum
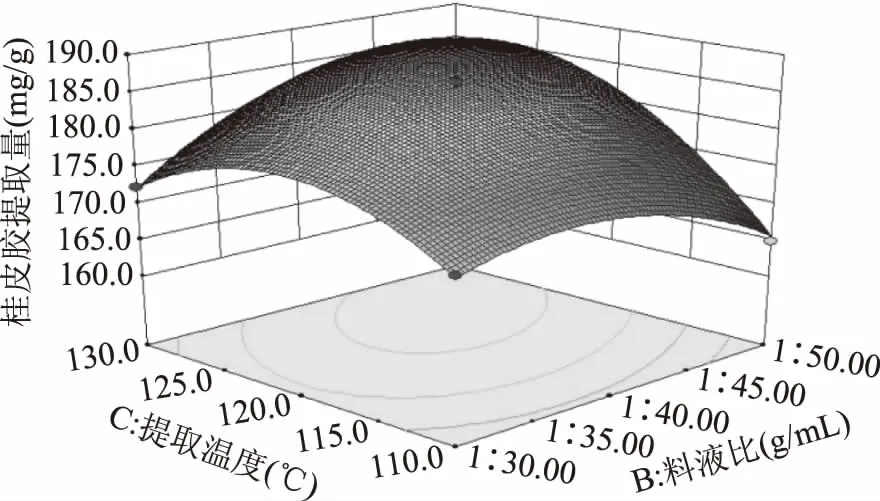
图9 料液比和提取温度对桂皮胶提取量的影响Fig.9 Effect of solid to liquid ratio and extraction temperature on the extraction quantity of Cinnamon gum
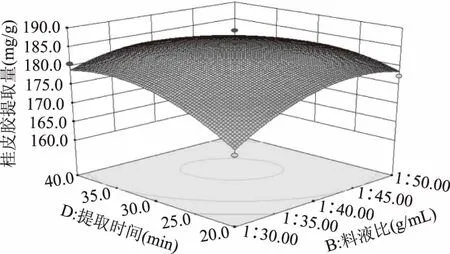
图10 料液比和提取时间对桂皮胶提取量的影响Fig.10 Effect of solid to liquid ratio and extraction time on the extraction quantity of Cinnamon gum
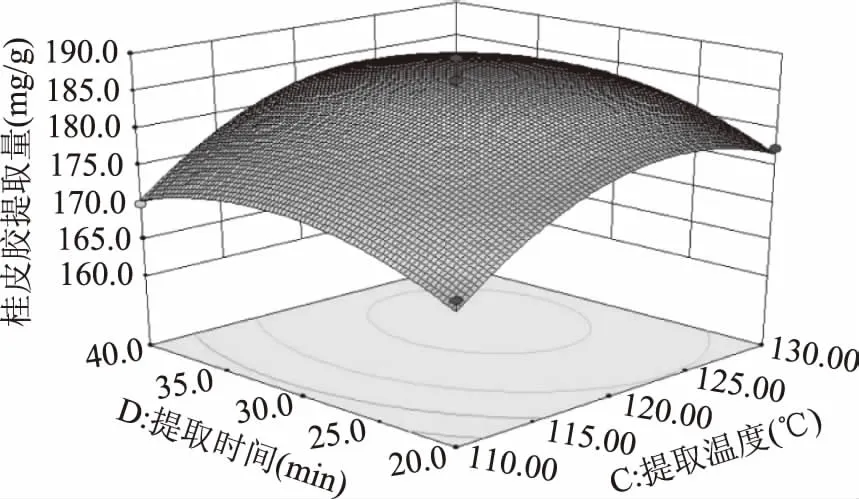
图11 提取温度和提取时间对桂皮胶提取量的影响Fig.11 Effect of extraction temperature and extraction time on the extraction quantity of Cinnamon gum
由图9可以看出响应面的坡度较陡峭,等高线呈椭圆形,表明在pH=5.0,提取时间为30 min的条件下,料液比和提取温度的交互作用显著,随着两个自变量的增加,桂皮胶提取量呈现先上升后下降的趋势;图10显示的响应面的坡度较为陡峭,等高线呈椭圆形,表明在pH=5.0,提取温度120 ℃的条件下,料液比和提取时间的交互作用显著,在提取时间较短时,桂皮胶提取量随料液比的升高而升高,随着提取时间的延长,提取量趋于平缓甚至下降;观察图像得知,图6~图8、图11四组的等高线图均接近圆形,结合数据进行分析,pH与料液比、pH与提取温度、pH与提取时间、提取温度与提取时间四组因素之间的交互作用均不显著。
2.2.4 模型的优化及验证实验 使用Design-Expert8.0.6软件,对多元二次回归模型及响应面图进行分析,得到的最佳提取条件是:pH为5.33,料液比为1∶43.94 (g/mL),提取温度为125.19 ℃,提取时间为31.07 min,在此条件下,桂皮胶提取量的预测值为187.8 mg/g,考虑实际操作的可行性,将提取工艺条件修正为pH5.0,料液比为1∶44 (g/mL),提取温度为125 ℃,提取时间为31 min,在此条件下进行三次平行验证实验,将修正后的条件带入方程,得到桂皮胶的理论提取量为187.1219 mg/g,验证实验中测得的平均提取量为186.5 mg/g,与模型预测值接近,说明此模型可以很好地预测桂皮胶的提取条件和提取量之间的关系,也说明了提取条件参数的可行性。
2.3 桂皮胶提取物中总糖含量测定
2.3.1 标准曲线的绘制 按1.2.6.3中标准曲线制作方法绘制标准曲线见图12,经回归处理得线性回归方程:Y=4.25429X+0.00395,R2=0.9982。

图12 葡萄糖标准曲线Fig.12 Standard curve of glucose
2.3.2 桂皮胶中总糖含量测定 按1.2.6.4中总糖测定方法处理桂皮胶样品,于490 nm处测吸光度,同时进行五次重复,结果见表4。总糖平均含量为96.06%,RSD为1.59%。

表4 桂皮胶总糖含量测定结果Table 4 Determination of total sugar content of Cinnamon gum

表5 稳定性实验结果Table 5 Results of stability assay
2.3.3 稳定性实验 取0.1 mg/mL的桂皮胶溶液1.0 mL,按1.2.6.4中总糖测定方法每隔一段时间测一次吸光度,观测其稳定性,结果表明在显色120 min时间内吸光度稳定性良好,结果见表5。
2.3.4 精密度实验 按1.2.6.4中总糖测定方法,吸取标准溶液(0.1 mg/mL)进行精密度实验,连续进行6次测量吸光度,得RSD=1.82%,小于5%,表明本实验精密度良好,具有可行性,结果见表6。

表6 精密度实验结果Table 6 Results of precision assay
3 结论
本研究采用在高温高压条件下以水作为提取剂的新工艺提取桂皮中的桂皮胶,通过高压条件改变胶体与木质素的结合形式,使桂皮胶释放出来,得到的桂皮胶粗品能够溶解于水,并迅速膨胀形成粘稠、滑腻的状态,未来可作为一种很好的天然食品增稠剂替代化学添加剂用在生湿面制品、肉类等食品的加工[27]。实验通过对桂皮胶的提取工艺进行研究,在单因素的实验基础上选择提取条件中的主要影响因素,采用Box-Behnken响应面设计四因素三水平中心组合实验,对桂皮胶提取工艺进行优化,建立了多元二次回归模型,能较好地预测桂皮胶的提取量,通过实验与模型验证,很好地证明了模型的可行性,并得到了桂皮胶的最佳提取工艺条件为pH5.0,料液比1∶44 (g/mL),提取温度125 ℃,提取时间31 min,在此条件下桂皮胶的提取量达到186.5 mg/g。纯化后的桂皮胶以苯酚-硫酸比色法测定总糖含量达到96.06%,测定结果稳定。优化后的提取工艺参数具有可行性,为桂皮胶主要成分的进一步研究提供一定的理论依据。
[1]贾琦,王瑞,吴喜民,等. 不同种类桂皮化学成分的比较[J]. 上海中医药杂志,2011,45(5):82-86.
[2]侯雪英,吴淳,周玉婷,等. 肉桂不同部位中4种有效成分的含量及其分布研究[J]. 世界科学技术-中医药现代化,2013,15(2):254-259.
[3]程丽娟. 天然药物桂皮的临床应用功效及药理分析[J]. 医学信息,2011(2):750.
[4]曾正渝,兰作平. 肉桂的研究现状及应用进展[J]. 现代医药卫生,2007,23(1):59-60.
[5]文福姬,俞庆善. 桂皮精油的化学成分及抗菌活性研究[J]. 中国调味品,2010,35(10):94-96.
[6]何秀娟,林燕,蒙玉娇,等. 桂皮醛抑制血管内皮细胞与中性粒细胞黏附及其分子机制[J]. 中国临床药理学与治疗学,2017,22(1):43-47.
[7]张慧芸,孔保华,李鑫玲. 桂皮提取物成分分析及抗菌活性的研究[J]. 食品研究与开发,2010,31(3):147-150.
[8]Zongwen Wu,Peiwen Zhou,Jingru Yang,et al. Determination of the optimal reaction conditions for the preparation of highly substituted carboxymethyl Cassia tora gum[J].Carbohydrate Polymers,2017,157:527-532.
[9]程慧娟,刘砚亭. 肉桂胶的特性及其毒理学研究进展[J]. 中国食品卫生杂志,1999,11(5):49-51.
[10]仝其根,苏亮,张艳,等.桂皮提取物的提取方法:中国,CN102379449A[P].2014-06-18.
[11]王一龙. 聚丙烯酸增稠剂的合成与性能研究[D]. 青岛:中国海洋大学,2010.
[12]李昌文,刘延奇,王章存,等. 添加剂对速冻水饺品质的影响[J]. 冷饮与速冻食品工业,2006,12(2):302-321.
[13]翟玮玮. 增稠剂对面条品质改良的研究[J]. 江苏农业科技,2008(4):242-244.
[14]毛汝婧. 鲜湿即食面品质改良及保鲜研究[D].兰州:甘肃农业大学,2016:20-23.
[15]刘红星,林森,黄初升,等. 肉桂三个不同部位提取肉桂油的化学成分比较分析[J]. 中国调味品,2011,36(4):102-104.
[16]格根塔娜,罗素琴,塔娜. 五倍子、桂皮、石榴皮中总鞣质的提取和氨基酸含量测定[J]. 内蒙古石油化工,2015(6):11-13.
[17]沈潘潘,常丽新,张会宜,等. 响应面优化微波法提取山菠菜多糖的工艺及不同采摘期多糖含量的测定[J]. 食品工业科技,2012,33(24):334-338.
[18]和法涛,刘光鹏,朱风涛,等. 响应面法优化热水法浸提猴头菇多糖工艺提高多糖得率[J]. 食品科技,2015,40(1):210-215.
[19]李丹丹,宋烨,吴茂玉,朱风涛,于滨,马晓燕. 植物多糖的水解及水解物结构的研究进展[J]. 食品与发酵工业,2013,39(7):165-170.
[20]闫景坤,吴建勇,金蓓,崔海英. 酸水解冬虫夏草胞外多糖的分子质量变化及动力学研究[J]. 食品科学,2012,33(11):82-85.
[21]胡海涛,王远兴,张娟,邓静. 大粒车前子多糖酸水解产物的分析[J]. 食品科学,2014,35(6):60-64.
[22]陶瑞霄,贾冬英,姚开,等. 高压提取银耳多糖研究[J]. 食品科技,2015(6):229-233.
[23]刘春娟.常温高压提取黄芪多糖的研究[D].长春:吉林大学,2005
[24]陈兵兵. 葛根多糖的提取分离、理化特性及生物活性研究[D].镇江:江苏大学,2016.
[25]赵亚红,王文侠,张显斌,等. 高温高压提取甜菜废粕多糖的工艺及其抗氧化性研究[J]. 食品与发酵工业,2015,41(4):230-235.
[26]周丽明,张勇,林国卫,等. 葛根多糖提取条件的优化及其抗氧化活性的研究[J]. 湖北农业科学,2012,51(19):4344-4347.
[27]黄来发. 食品增稠剂[M]. 北京:中国轻工业出版社,2009.
[28]Harshal A. Pawar,Priscilla M. D’Mello. Spectrophotometric estimation of total polysaccharides in Cassia tora gum[J].Journal of Applied Pharmaceutical Science,2011,1(3):93-95
[29]王文平,郭祀远,李琳,等. 苯酚-硫酸法测定野木瓜中多糖含量的研究[J]. 食品科学,2007(4):276-279.
[30]汲晨锋,季宇彬,王翀,等. 羊栖菜多糖含量测定及多糖组分分析[J]. 世界科学技术,2006(5):49-53.

