富硒青钱柳多糖对α-葡萄糖苷酶 及HepG2细胞葡萄糖消耗的影响
张 浩,李东山,谭开祥,向极钎,刘 卫,*
(1.华中科技大学生命科学与技术学院,湖北武汉 430074;2.湖北思慧生物科技有限公司,湖北恩施 445099;3.恩施州农业科学院,湖北恩施 445099)
青钱柳(Cyclocaryapaliurus(Batal)Ijinskaja)又名青钱李、甜茶树,为我国特有珍稀树种,系双子叶植物纲胡桃科青钱柳属落叶乔木,分布于湖南、湖北、江西、贵州等地区[1]。2014年,青钱柳被批准为食品新资源,研究表明,青钱柳叶富含多糖、黄酮等代谢产物,其中,青钱柳多糖(Cyclocaryapaliurus(Batal)Ijinskaja polysaccharide,CPP)具有降血糖、降血脂等生物活性[2-4]。硒为人体必需的一种微量元素,具有降血糖、免疫调节、抗肿瘤等生物活性[5-6]。国内外有学者对灰树花、茶树等进行富硒处理,得到具有较好生物活性的富硒多糖[7-8]。基于此,本文在前期工作中,采用人工喷雾施加有机硒肥的方式对青钱柳进行富硒处理,得到富硒青钱柳叶[9],并提取分离得到富硒青钱柳多糖(Se-CPP)和CPP[10]。对CPP降血糖活性及作用机制的研究现已较多,关于Se-CPP生物活性研究目前国内外尚无文献报道。本文主要探讨了Se-CPP对α-葡萄糖苷酶活性及HepG2细胞葡萄糖消耗的影响,并与CPP、CPP添加微量硒复配物进行比较,研究结果为富硒青钱柳多糖的开发利用提供实验依据。
1 材料与方法
1.1 材料与仪器
富硒青钱柳多糖(Se-CPP)、青钱柳多糖(CPP)参考文献[10]方法制备,检测硒含量分别为3.30和0.11 mg/kg[11];HepG2细胞株 国家纳米药物工程技术研究中心;α-葡萄糖苷酶(19.3 U/mg)、4-硝基苯-α-D吡喃葡萄糖苷(pNPG)、四甲基偶氮唑蓝(MTT)、胰岛素 美国Sigma公司;阿卡波糖片 拜耳医药保健有限公司;亚硒酸钠 上海天赐福生物工程有限公司;西维尔硒酵母片 牡丹江灵泰药业股份有限公司;胎牛血清(FBS)、青链霉素、DMEM高糖培养基、0.25%胰蛋白酶 美国Gibco公司;DMEM低糖培养基(含10%FBS、1%青链霉素) 美国HyClone公司;盐酸二甲双胍肠溶片 贵州天安药业股份有限公司;葡萄糖测定试剂盒 上海荣盛生物药业有限公司;其它试剂 均为国产分析纯。
TU-1901型双光束紫外可见光分光光度计 北京普析通用仪器有限责任公司;BPN-150CRH型二氧化碳培养箱 上海一恒科学仪器有限公司;DSZ2000X型倒置显微镜 重庆澳浦光电技术有限公司;318C型酶标仪 成都华衡仪器有限公司。
1.2 实验方法
1.2.1α-葡萄糖苷酶活力抑制实验 参考文献[12]方法,以磷酸盐缓冲液(PBS,0.1 mol/L,pH6.8)为溶剂配制酶液(α-葡萄糖苷酶溶液,浓度为1.0 U/mL)、底物(pNPG溶液,浓度为10 mmol/L)及抑制剂(各受试样品溶液,具体浓度见图1)。根据Se-CPP与CPP硒含量,向CPP溶液中分别加入微量的硒酵母或亚硒酸钠溶液(采用PBS溶液溶解配制,硒浓度为10 μg/mL),使溶液硒含量与等浓度Se-CPP相等,配制得到复配物溶液。根据文献方法[12-13]设计抑制实验流程如下:
取0.4 mL 酶液和0.8 mL PBS缓冲液于空白管,37 ℃预热10 min,加入0.4 mL 37 ℃预热(10 min)好的底物溶液,将反应体系迅速置于37 ℃水浴锅水浴,20 min后加入1.0 mL Na2CO3溶液(浓度为0.05 mol/L)终止反应,反应体系PBS稀释10倍后于405 nm处测定吸光度。根据上述反应程序及表1,分别向空白对照管、抑制管和背景对照管加入相应试剂进行反应。每个样品设置3个重复,计算抑制率和半抑制浓度IC50[12]。

式中:空白管、空白对照管、抑制管、背景对照管吸光度值分别为A1、A2、A3、A4。

表1 α-葡萄糖苷酶活力抑制实验反应体系Table 1 The reaction system of the inhibition effect on α-glucosidase
1.2.2 HepG2细胞存活率及葡萄糖消耗实验 Se-CPP、CPP及盐酸二甲双胍用DMEM低糖培养基溶解配制成所需浓度。另向CPP溶液中加入微量硒酵母或亚硒酸钠,使溶液硒含量与等浓度Se-CPP相等,采用孔径为0.22 μm的水溶性滤膜,针筒过滤除菌备用。
1.2.2.1 HepG2细胞的培养 HepG2细胞采用DMEM低糖培养基培养于37 ℃、5% CO2细胞培养箱,每隔3 d用0.25%胰蛋白酶消化传代。传代3次后取对数生长期细胞用于实验。
1.2.2.2 MTT实验 取对数生长期细胞培养于96孔细胞培养板,调整细胞密度为5000个/孔。细胞贴壁后弃去培养液,设置正常组、给药组(Se-CPP、CPP、CPP+硒酵母、CPP+亚硒酸钠)和盐酸二甲双胍对照组。其中,正常组每孔加入200 μL DMEM低糖培养基,给药组和盐酸二甲双胍对照组每孔加入200 μL含药DMEM低糖培养基(各组给药浓度均分别为400、200、100 μg/mL)。培养24 h弃上清液,加入100 μL MTT溶液(1.0 mg/mL)继续培养4 h弃上清液,加入150 μL二甲基亚砜振荡混匀,15 min后测定570 nm处OD值,计算细胞存活率。

1.2.2.3 葡萄糖消耗实验 取对数生长期细胞培养于96孔细胞培养板(5000个/孔)。细胞贴壁后弃去培养液,分组及给药同MTT实验过程。培养24 h后测定上清液葡萄糖浓度(测定过程依照试剂盒说明书),计算葡萄糖消耗量(DMEM低糖培养基葡萄糖浓度减去上清液葡萄糖浓度)。
方法[14-15],建立胰岛素抵抗(Insulin Resistance,IR)HepG2细胞模型。取对数生长期细胞培养于96孔细胞培养板(5000个/孔)。细胞贴壁后弃去培养液,设置正常组、IR模型组、给药组(Se-CPP、CPP、CPP+硒酵母、CPP+亚硒酸钠)和盐酸二甲双胍对照组。正常组每孔加入200 μL DMEM低糖培养基,IR模型组、给药组和盐酸二甲双胍对照组每孔加入200 μL含胰岛素和葡萄糖浓度分别为2×10-6mol/L和40 mmol/L的DMEM低糖培养基,培养24 h。培养结束弃去培养基,正常组和IR模型组每孔加入200 μL DMEM低糖培养基,给药组和盐酸二甲双胍组每孔加入200 μL含药DMEM低糖培养基(各组给药浓度均分别为400、200、100 μg/mL),继续培养24 h。培养结束弃去培养基,每孔加入200 μL DMEM高糖培养基,培养18 h后采用葡萄糖氧化酶法测定上清液葡萄糖浓度,计算葡萄糖消耗量。
2 结果与分析
2.1 Se-CPP对α-葡萄糖苷酶活力的影响
α-葡萄糖苷酶分布于小肠上皮细胞刷状边缘处,通过催化α-1,4糖苷键水解来促进对蔗糖、麦芽糖等糖类的消化吸收。抑制α-葡萄糖苷酶活性可减缓葡萄糖的生成与吸收,降低糖尿病患者餐后血糖[16]。

表2 各样品对α-葡萄糖苷酶的半抑制浓度Table 2 50% Inhibitory concentration of samples to α-glucosidase

表3 HepG2细胞存活率测定结果比较(n=6)Table 3 Comparing of cell viability of HepG2 cells(n=6)
注:与正常组(细胞存活率为100%)比较,*p<0.05,**p<0.01。由图1可知,各抑制剂对α-葡萄糖苷酶活力均有较好的抑制效果且呈明显的剂量依赖性。其中,在0.2 ~ 2.0 mg/mL浓度范围内,Se-CPP对α-葡萄糖苷酶活力抑制效果明显优于CPP、CPP+硒酵母、CPP+亚硒酸钠复配物。在0.2 ~ 4.0 mg/mL浓度范围内,CPP添加与Se-CPP同样硒剂量的硒酵母、亚硒酸钠后,对α-葡萄糖苷酶抑制活性没有明显影响,因此,向CPP人工添加微量硒,并不能增强其对α-葡萄糖苷酶活力的抑制活性。根据各抑制剂对α-葡萄糖苷酶的IC50(如表2),确定各抑制剂抑制活性强弱顺序为:Se-CPP>CPP+亚硒酸钠>CPP>CPP+硒酵母>阿卡波糖。

图1 样品对α-葡萄糖苷酶的抑制作用Fig.1 Inhibition effect of samples on α-glucosidase
有研究表明,α-葡萄糖苷酶抑制剂主要通过竞争性地与酶催化位点结合来抑制底物的分解,从而降低机体餐后血糖[17]。Se-CPP对α-葡萄糖苷酶抑制作用类型尚未明确,还有待研究。Se-CPP对α-葡萄糖苷酶的抑制活性明显强于CPP,可能是因为青钱柳多糖与硒元素结合后化学结构发生变化,生物活性有所提高,其中详细作用机制还有待后期深入研究。同时,我们前期研究发现,Se-CPP可明显降低糖尿病小鼠餐后血糖,效果优于CPP,原因可能与Se-CPP具有更好的α-葡萄糖苷酶抑制活性有关。向CPP添加与Se-CPP同样剂量硒元素对α-葡萄糖苷酶抑制活性未见明显变化。
2.2 Se-CPP对HepG2细胞存活率及葡萄糖消耗的影响
2.2.1 MTT实验 由表3可知,Se-CPP各剂量组细胞存活率均低于正常组,且当Se-CPP浓度为100 μg/mL时,差异具有显著性(p<0.05),表明Se-CPP对HepG2细胞生长具有微弱的抑制作用,HepG2细胞存活率随Se-CPP浓度的升高有所降低,原因可能与硒的U型剂量曲线有关,当剂量过高或过低时,生物活性反而降低[18-19]。CPP、CPP+硒酵母、CPP+亚硒酸钠各剂量组HepG2细胞存活率与正常组比较,差异无显著性。盐酸二甲双胍各剂量组细胞存活率均低于正常组(p<0.01),且具有明显的浓度依赖性,提示盐酸二甲双胍对HepG2细胞生长具有较强的抑制作用,此结果与相关文献报道相符[20-21]。
2.2.2 Se-CPP对HepG2葡萄糖消耗的影响 HepG2细胞葡萄糖消耗实验结果如表4所示,Se-CPP各剂量组均能显著促进HepG2细胞对葡萄糖的消耗(p<0.01或p<0.05),但不具备明显的浓度依赖性,具体原因还有待深入研究。当CPP浓度为400 μg/mL时,可显著提高HepG2细胞葡萄糖消耗量。CPP添加微量硒酵母或亚硒酸钠后,HepG2细胞葡萄糖消耗量有所提高,但与正常组比较差异无显著性。阳性对照盐酸二甲双胍各剂量组均能显著促进HepG2细胞对葡萄糖的消耗(p<0.01)且具有明显的浓度依赖性。
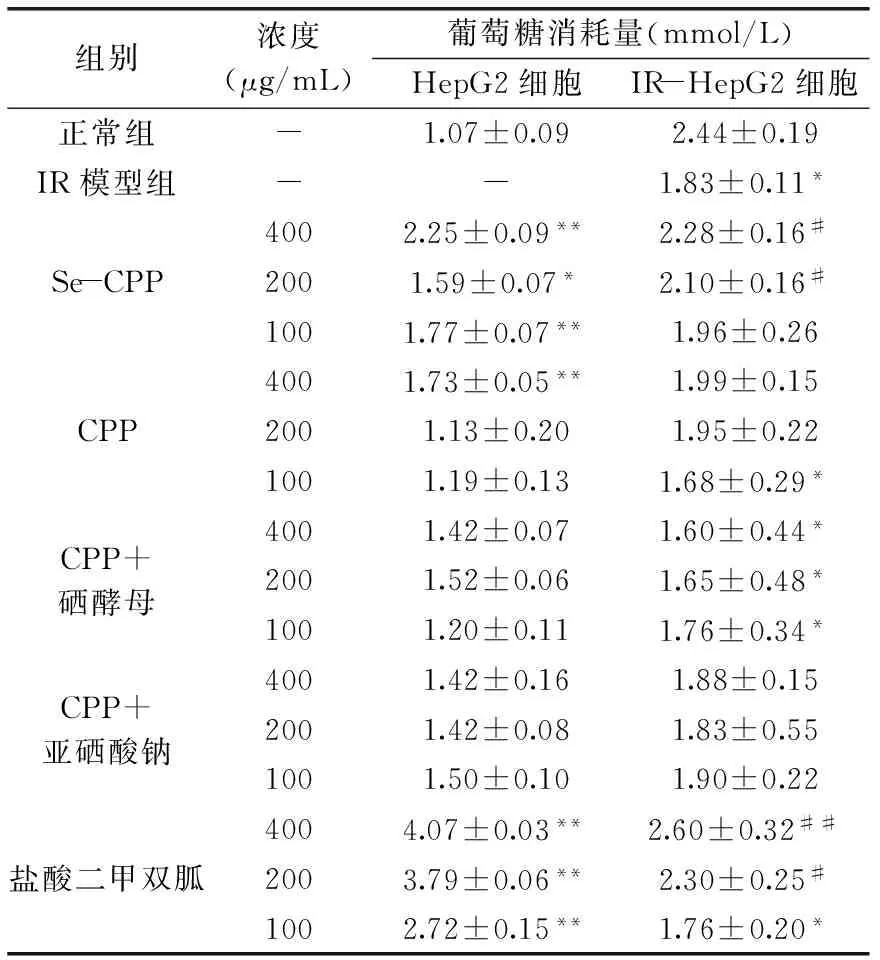
表4 HepG2细胞及IR-HepG2 细胞葡萄糖消耗量比较(n=6)Table 4 Comparison of glucose consumption of HepG2 cells and IR-HepG2 cells(n=6)
注:与正常组比较,*p<0.05,**p<0.01;与IR模型组比较,#p<0.05,##p<0.01。 胰岛素抵抗指胰岛素作用的靶组织或细胞对胰岛素敏感性降低,胰岛素促进靶组织细胞摄取利用葡萄糖、抑制糖原水解的能力降低[22]。IR的发生机制及药物改善IR的研究工作对于降血糖药物筛选与作用机制研究具有重要意义。肝脏是机体摄取利用葡萄糖的重要器官,肝细胞可将葡萄糖转化成肝糖原进行储存,从而维持机体血糖处于正常水平[23]。HepG2细胞源于人肝胚胎瘤细胞,是一种表型与肝细胞极为相似的细胞株,保留了肝细胞的许多生物学特性,是目前应用较广的研究IR的细胞模型。在高浓度胰岛素或葡萄糖作用下,HepG2细胞表面胰岛素受体数量降低,产生IR[24-25]。
采用高浓度葡萄糖和胰岛素处理后,HepG2细胞葡萄糖消耗量显著降低(p<0.05),表明IR模型建立成功。与IR模型组比较,Se-CPP各剂量组均能提高IR-HepG2细胞葡萄糖消耗量,且浓度为400和200 μg/mL时差异具有显著性(p<0.05)。CPP浓度为400和200 μg/mL时,可提高IR-HepG2细胞葡萄糖消耗量,但与模型组比较,差异无显著性(p>0.05)。CPP添加微量硒酵母或亚硒酸钠后,对IR-HepG2细胞葡萄糖消耗量没有明显影响。盐酸二甲双胍浓度为400和200 μg/mL时,可显著提高IR-HepG2细胞葡萄糖消耗量(p<0.05或p<0.01)。
3 结论
本文结果表明,适宜浓度的Se-CPP可以显著抑制α-葡萄糖苷酶活性,可促进HepG2细胞对葡萄糖的摄取利用,改善HepG2细胞胰岛素抵抗,效果优于CPP。CPP添加微量硒后,对HepG2细胞和IR-HepG2细胞葡萄糖的消耗未见明显影响。Se-CPP抑制α-葡萄糖苷酶活性及改善HepG2细胞胰岛素抵抗的详细作用机制还有待深入研究。
参考文献
[1]谢明勇,谢建华. 青钱柳研究进展[J]. 食品与生物技术学报,2008,27(1):113-121.
[2]Xie J H,Shen M Y,Nie S P,et al. Analysis of monosaccharide composition ofCyclocaryapaliuruspolysaccharide with anion exchange chromatography[J]. Carbohydrate Polymers,2013,98:976-981.
[3]Xie J H,Dong C J,Nie S P,et al. Extraction,chemical composition and antioxidant activity of flavonoids fromCyclocaryapaliurus(Batal.)Iljinskaja leaves[J]. Food Chemistry,2015,186:97-105.
[4]Xie J H,Liu X,Shen M Y,et al. Purification,physicochemical characterisation and anticancer activity of a polysaccharide fromCyclocaryapaliurusleaves[J]. Food Chemistry,2013,136:1453-1460.
[5]Mao G H,Ren Y,Li Q,et al. Anti-tumor and immunomodulatory activity of selenium(Se)-polysaccharide from Se-enrichedGrifolafrondosa[J]. International Journal of Biological Macromolecules,2016,82:607-613.
[6]Haque M M,Moghal M R,Sarwar M S,et al. Low serum selenium concentration is associated with preeclampsia inpregnant women from Bangladesh[J]. Journal of Trace Elements in Medicine and Biology,2016,33:21-25.
[7]Wang Y,Chen J,Zhang D,et al. Tumoricidal effects of a selenium(Se)-polysaccharide from Ziyang green tea on human osteosarcoma U-2 OS cells[J]. Carbohydrate Polymers,2013,98(1):1186-1190.
[8]Meng M,Cheng D,Han L,et al. Isolation,purification,structural analysis and immunostimulatory activity of water-soluble polysaccharides from Grifola frondosa fruiting body[J]. Carbohydrate Polymers,2017,157:1134-1143.
[9]吕萌,陈伟鸿,许琦,等. 有机富硒肥对青钱柳叶中硒、微量元素及功效成分的影响[J]. 农学学报,2016,6(5):39-42.
[10]谢建华,谢明勇,聂少平,等. 青钱柳多糖提取工艺的研究[J]. 食品科学,2007,28(10):188-191.
[11]高建忠,秦顺义,黄克和. 氢化物发生-原子荧光光谱法测定富硒酵母中的有机硒和无机硒[J]. 分析科学学报,2006,22(2):157-160.
[12]董义,王斯慧,曾里,等. 六种保健食品原料的辅助降血糖功效研究[J]. 食品研究与开发,2014(23):121-124.
[13]Adefegha S A,Oboh G,Omojokun O S,et al. Invitroantioxidant activities of African birch(Anogeissusleiocarpus)leaf and its effect on theα-amylase andα-glucosidase inhibitory properties of acarbose[J]. Journal of Taibah University Medical Sciences,2016,11(3):236-242.
[14]汤彬,薛平,李祥,等. 南方红豆杉多糖的含量测定及体外降血糖活性研究[J]. 食品工业科技,2013,34(9):128-131.
[15]Hwang Y P,Choi J H,Kim H G,et al. Saponins fromPlatycodongrandifloruminhibit hepatic lipogenesis through induction of SIRT1 and activation of AMP-activated protein kinase in high-glucose-induced HepG2 cells[J]. Food Chemistry,2013,140(1-2):115-123.
[16]戴甜甜,沈建福. 油茶果壳提取物及分级相对α-葡萄糖苷酶的抑制作用[J]. 食品科学,2011,32(9):107-110.
[17]张红城,孙庆申,王光新,等. 蜂胶乙醇提取物对α-葡萄糖苷酶的抑制作用[J]. 食品科学,2011,32(5):108-110.
[18]让欧艳,让蔚清. 低剂量兴奋效应及其医学应用[J]. 实用预防医学,2009,16(1):300-303.
[19]Harding L E. Non-linear uptake and hormesis effects of selenium in red-winged blackbirds(Agelaiusphoeniceus)[J]. Science of the Total Environment,2008,389(2-3):350-366.
[20]Kumar C S,Raja M D,Sundar D S,et al. Hyaluronic acid co-functionalized gold nanoparticle complex for the targeted delivery of metformin in the treatment of liver cancer(HepG2 cells)[J]. Carbohydrate Polymers,2015,128:63-74.
[21]彭晓韧,刘燕,邹大进. 二甲双胍对人肝癌细胞HepG2增殖及乙酰辅酶A羧化酶影响的实验研究[J]. 临床肿瘤学杂志,2015,20(3):203-207.
[22]张晓英,王鹏翔,张致英,等. 红景天苷改善胰岛素抵抗HepG2细胞糖代谢及分子机制初探[J]. 中药药理与临床,2014(1):28-31.
[23]盛军庆,章常华,涂秀英,等. 葛根素对HepG2细胞胰岛素抵抗状态的改善作用[J].时珍国医国药,2014(8):1831-1833.
[24]Gu J F,Zheng Z Y,Yuan J R,et al. Comparison on hypoglycemic and antioxidant activities of the fresh and driedPortulacaoleraceaL. in insulin-resistant HepG2 cells and streptozotocin-induced C57BL/6J diabetic mice[J]. Journal of Ethnopharmacology,2015,161:214-223.
[25]柳嘉,郭孝萱,吴薇,等. 高糖高脂诱导胰岛素抵抗HepG2细胞模型的建立及活性成分的功能评价[J]. 食品科技,2012(3):73-78.

