番茄果胶和半纤维素抗氧化活性分析
李倩倩,李武笋,桑伟娜,王丽敏,赵玉梅,曹建康
(中国农业大学食品科学与营养工程学院,北京 100083)
果胶是植物细胞壁的重要组成之一,是由β-D-半乳糖醛酸(β-D-Galacturonic Acid,GalUA)通过α-1,4-糖苷键连接而成、部分甲酯化的多聚物[1]。从植物细胞壁中提取的果胶已作为胶凝剂、增稠剂、稳定剂和乳化剂,广泛应用于食品、化妆品、保健品和药品等行业。此外,果胶还具有较好的抗氧化活性、降血糖、降低血清胆固醇和预防肠胃疾病、抗癌、抗炎等作用[2-3]。半纤维素以共价键连接到果胶或以氢键连接到纤维素上[4],在生物医药上也有应用潜力,尤其是木聚糖,具有较好的免疫刺激行为、抗补体行为、抑制肿瘤能力和抗发炎能力[5]。其中,抗氧化活性是很多生物活性功能的基础[2],得到了较多的关注。研究发现,柑橘[6]、苹果[3]、山楂[7]、南瓜[8]、山竹[9]等果实的果胶都具有一定的抗氧化活性。由于植物细胞壁中果胶存在状态与结合方式不同,利用不同方法提取的果胶在组成和性质上有较大的差异。根据在不同溶剂中的溶解性,可分步从果实细胞壁中分离提取得到WSP、CSP和SSP[10],还可继续分离提取得到不同结合程度的半纤维素组分。目前关于不同类型果胶和半纤维素的研究多集中在它们与果实质地变化之间的关系上[11-12],然而,到目前为止,还未见到不同类型果胶和半纤维素抗氧化活性的报道。
番茄是世界上种植量最多和消费量最大的果蔬作物之一。果胶对番茄鲜果品质和番茄加工制品如番茄酱、番茄汁等质量有很大影响。此外,果胶和半纤维素是提取番茄红素后皮渣中的重要成分。本文拟研究番茄细胞壁提取物中不同类型的果胶和半纤维素的体外抗氧化活性,为番茄的综合加工利用和作为功能性食品添加成分的开发提供了理论根据。
1 材料与方法
1.1 材料与仪器
番茄 市售坚熟期,品种为‘609’,选择成熟度、大小一致的果实,硬度为(4.14±0.86) kg/cm2,可溶性固形物含量为4.66%±0.45%;1,1-二苯基-2-三硝基苯肼(DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)(ABTS)、6-羟基-2,5,7,8-四甲基色烷-2-羧酸(Trolox) Sigma 试剂公司;2,4,6-三吡啶基-S-三嗪(TPTZ) 艾科试剂公司;荧光素钠、2,2-偶氮二(2-甲基丙基咪)二盐酸盐(AAPH) 麦克林试剂公司;乙醇、丙酮、α-萘酚、乙二胺四乙酸(EDTA)、硼氢化钠、碳酸钠、氢氧化钾、半乳糖醛酸、咔唑、蔗糖、蒽酮、乙酸乙酯、甲醇、过硫酸钾、三氯化铁、硫酸亚铁、氢氧化钠等 均为分析纯,北京试剂公司;浓硫酸 优级纯,北京试剂公司。
A11液氮研磨机 德国IKA;H/T 16 MM高速冷冻离心机 湖南赫西仪器装备有限公司;DZF-6050B真空干燥箱 上海一恒科学仪器有限公司;RE-52旋转蒸发器 上海亚荣生化仪器厂;LGJ-10B冷冻干燥机 北京四环科学仪器厂有限公司;紫外可见分光光度计(T6新世纪) 北京普析通用仪器有限责任公司;Cary Eclipse荧光分光光度计 美国VARIAN公司。
1.2 实验方法
1.2.1 番茄果胶和半纤维素的提取与分离
1.2.1.1 番茄乙醇不溶物质的制备 参照Huber等[13]的方法制备。称取番茄1 kg,去籽,切分后用液氮研磨机粉碎。称取200 g粉碎样品置于研钵中,加入800 mL 95%(v/v)乙醇溶液研磨成匀浆,转移至三角瓶中,煮沸30 min,冷却后抽滤,收集滤渣,再加入等量80%(v/v)乙醇溶液重复上述步骤3次,再用丙酮搅拌冲洗滤渣3次。最后将得到的滤渣在40 ℃烘干至恒重,即得乙醇不溶物质。
1.2.1.2 不同类型果胶和半纤维素的分离 参考Brummell等[14]的方法分离。称取上一步得到的乙醇不溶物质2 g,加入20 mL去离子水,室温下振荡提取4 h,抽滤,收集滤液。向滤渣中再加入去离子水重复提取2次,合并3次滤液即为WSP。收集滤渣,加入20 mL 50 mmol/L EDTA溶液(pH6.5,含100 mmol/L NaAc),按照上述方法提取3次,合并滤液即为CSP。收集滤渣,加入20 mL 50 mmol/L Na2CO3溶液(含20 mmol/L NaBH4),按照上述方法提取3次,合并滤液即为SSP。提取SSP之后的滤渣用来提取细胞壁半纤维素成分,根据Maclachlan等[15]的方法分别用20 mL 4%和24% KOH(W/V)(含20 mmol/L NaBH4)提取LH和TH,各提取3次,合并3次所得滤液。用醋酸分别中和所得SSP、LH和TH提取液至pH为6.5。将上述操作得到的五种提取液用去离子水透析,所用透析袋截留分子量为3000 Da。透析液经50 ℃旋转蒸发浓缩,再冷冻干燥后保存在干燥器中。
1.2.2 果胶和半纤维素含量的测定
1.2.2.1 果胶含量测定 采用咔唑比色法测定不同溶解性果胶的含量[16]。以每克鲜重番茄所含有的半乳糖醛酸(GalUA)的毫克数表示果胶含量。
1.2.2.2 半纤维素含量测定 采用蒽酮试剂法测定不同结合程度半纤维素的含量[16]。以每克鲜重番茄所含有的葡萄糖(Glu)的毫克数表示半纤维素含量。
1.2.3 体外抗氧化活性测定
1.2.3.1 ORAC的测定 参照Song 等[17]的方法测定。用75 mmol/L的磷酸钠缓冲溶液(pH7.4)分别配制不同浓度样品、100 μmol/L Trolox溶液、0.96 μmol/L荧光素钠溶液和119 mmol/L的AAPH溶液,以磷酸钠缓冲液代替样品为空白对照,以Trolox溶液为标准品。在96孔黑色板中先分别加入20 μL空白、标样或不同浓度样品,再加入200 μL荧光素钠溶液,37 ℃水浴 20 min并间歇振荡。然后加入20 μL现配的AAPH,迅速将96孔板放入荧光分光光度计,在激发波长485 nm,发射波长538 nm下测定荧光强度的动态变化,每4.5 min测定一次,共测定35次;以标样浓度为横坐标,以标样峰面积减去空白峰面积之差为纵坐标,制作标样ORAC曲线。计算各样品峰面积减去空白峰面积的值,通过查标准曲线,以具有相同氧自由基吸收能力的Trolox浓度表示不同样品的ORAC值。
1.2.3.2 DPPH·清除能力的测定 参照Li 等[18]的方法测定。
1.2.3.3 ABTS+·清除能力的测定 参照Li 等[18]的方法测定。
1.2.3.4 FRAP的测定 参照刘慧等[19]的方法测定。以FeSO4·7H2O为标准品,绘制标准曲线,不同浓度样品的铁离子还原能力表示为具有相同还原能力的FeSO4·7H2O的浓度。
1.3 数据分析
实验重复3次,采用Microsoft Excel 2013和SPSS 21.0软件进行数据分析,测定结果以平均值±标准误表示。采用ANOVA进行邓肯式(Duncan’s)多重比较差异分析,以p<0.05为差异显著。对各指标进行相关性分析,相关类型为pearson类型,相关系数显著性检验采用双侧检验,以p<0.05 为显著相关,以p<0.01 为极显著相关。
2 结果与分析
2.1 番茄不同溶解性果胶和半纤维素的含量
果胶和半纤维素是植物细胞壁中的重要成分。番茄细胞壁中不同溶解性的果胶和半纤维素含量如表1所示。番茄WSP、CSP和SSP含量分别为1.05、0.64和0.62 mg GalUA/g FW。WSP主要为溶解在质外体中的组分[20-21],能增强果实汁液粘稠状态。CSP又称离子结合型果胶,主要是与细胞壁其它成分以离子键或氢键相结合的果胶,往往能与钙桥相结合而形成“蛋壳模型”[22],在果实软化过程中逐渐溶解。SSP又称共价结合型果胶,主要是以共价键和纤维素等细胞壁成分紧密结合的果胶[23]。番茄LH与TH的含量分别为0.09和0.33 mg Glu/g FW,差异显著(p<0.05)。这与前人的报道结果一致[23]。细胞壁物质往往结合紧密,需要用强碱水解。24% KOH比4% KOH能够明显有效地水解番茄细胞壁,使紧密连接在细胞壁上的半纤维素与其它成分分离。

表1 番茄中不同类型果胶和半纤维素的含量Table 1 Contents of different pectins and hemicelluloses in tomato fruit
注:同列不同小写字母表示存在显著性差异(p<0.05);-表示未测定。
2.2 番茄不同溶解性果胶和半纤维素的体外抗氧化活性
2.2.1 ORAC ORAC法是目前生理相关性最高的测定试样总抗氧化活性的方法[24]。在番茄细胞壁各组分中,除TH外,果胶组分和LH均具有一定的ORAC活性(图1)。0.1 mg/mL WSP溶液的ORAC值相当于33.2 μmol/L Trolox,但随着浓度的增加,WSP溶液的ORAC活性并没有随之增加。然而,CSP溶液的ORAC活性随着浓度的增加而显著升高(p<0.05),特别是在浓度为1和5 mg/mL 时的ORAC值分别为71.0和76.1 μmol/L Trolox,显著高于其它组分的ORAC值(p<0.05)。相对而言,SSP和LH溶液的ORAC活性较低,甚至在低浓度时检测不到。目前仅Wang等报道了葡萄柚皮总果胶的ORAC活性[25],但有关不同类型果胶和半纤维素组分ORAC活性的研究尚未见报道。不同溶解性果胶的分子组成和多糖聚合物的构成不同,可能导致它们在总抗氧化活性上的差异,与细胞壁结合程度不同的半纤维素,也可能在组成上存在较大差异,引起总抗氧化活性的变化。抗氧化活性与反应物质的电子得失和反应溶液中电荷的转移有关。细胞壁组分为多糖大分子物质,多糖大分子物质溶液的物理特性如胶凝性、流变性、胶粒电荷分布特性等随着浓度的升高而变化[26]。因此,不同浓度的果胶和半纤维素抗氧化活性的变化还可能与大分子溶液在不同浓度的物理性质变化有关。

图1 番茄中不同类型果胶和半纤维素的氧自由基吸收能力Fig.1 Oxygen radical absorbance capacity of different pectins and hemicelluloses in tomato fruit注:相同的小写字母表示不存在 显著性差异(p>0.05);图2~图4同。
2.2.2 DPPH·清除能力 DPPH·清除能力是评价生物活性成分清除自由基能力最广泛使用的方法之一。如图2所示,WSP在5 mg/mL时清除DPPH·的能力为14.5%,在较低浓度时清除能力降低或消失。CSP清除DPPH·的能力随着浓度增大而增强,在5 mg/mL时DPPH·清除率达到61.0%,显著高于番茄细胞壁其它4种类型的组分的DPPH·清除能力(p<0.05)。不同浓度SSP、LH和TH都具有一定的DPPH·清除能力,但是却随着溶液浓度的增大而降低。SSP、LH和TH均是通过较强的碱溶液水解番茄细胞壁物质得到的产物,是结构复杂的大分子物质。较高浓度的SSP、LH和TH溶液由于物理性质的变化,可能阻碍了抗氧化基团与自由基反应,使得高浓度细胞壁组分溶液清除自由基的能力反而较低[27]。

图2 番茄中不同类型果胶和半纤维素的DPPH·清除能力Fig.2 DPPH radical scavenging capacity of different pectins and hemicelluloses in tomato fruit
2.2.3 ABTS+·清除能力 如图3所示,番茄细胞壁各组分都具有一定的ABTS+·清除能力,且均随着浓度的增加而增强。这与前人报道的苹果总果胶[28]、苹果渣总果胶[29]和黑莓果胶寡糖[30]等的规律一致。WSP在5 mg/mL时ABTS+·清除能力达到62.2%。浓度为5 mg/mL的CSP对ABTS+·清除能力分别达到66.4%、50.2%和13.6%。

表2 番茄不同类型果胶和半纤维素与抗氧化活性的相关系数(r)Table 2 Correlation coefficients(r)of different pectins,hemicelluloses and antioxidant activity of tomato fruit
注:*表示显著相关(p<0.05);**表示极显著相关(p<0.01);aTH未检测到ORAC值,未能计算。清除率达到99.8%,显著高于其它组分(p<0.05)。SSP、LH和TH在浓度为5 mg/mL时ABTS+·
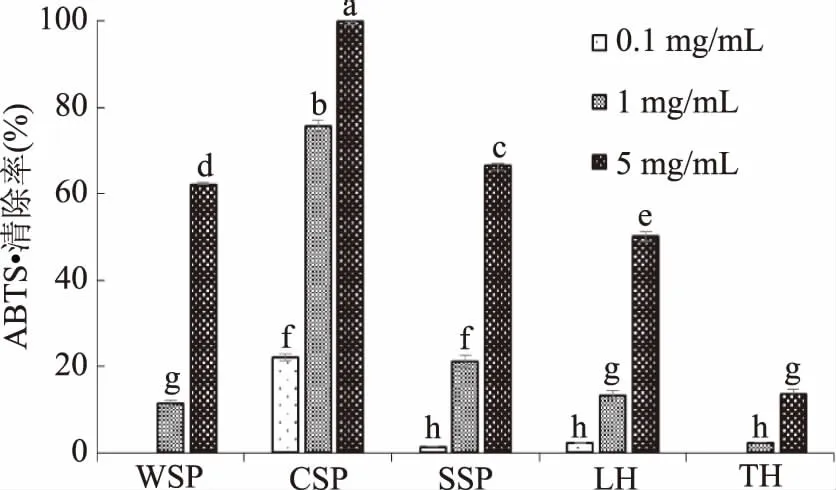
图3 番茄中不同溶解性果胶 和半纤维素的ABTS+·清除能力Fig.3 ABTS radical scavenging capacity of different pectins and hemicelluloses in tomato fruit
2.2.4 FRAP FRAP常用于评价生物活性成分的总抗氧化能力[31]。如图4所示,WSP和CSP的FRAP水平基本一致,随着浓度的增大而略有增强。SSP、LH和TH的FRAP能力随着浓度增大而显著增强(p<0.05)。其中5 mg/mL的SSP、LH和TH的FRAP值分别相当于1866.7、1851.9和1481.5 μmol/L FeSO4/mL。与前文番茄细胞壁各组分的ORAC、DPPH·清除能力和ABTS+·清除能力抗氧化指标相比较发现,CSP的FRAP能力较弱,而SSP、LH和TH却表现出较强的FRAP还原能力。这可能与体外抗氧化活性评价体系中,不同指标的反应原理不同有关[32]。

图4 番茄中不同溶解性细胞壁多糖的铁离子还原能力Fig.4 Ferric reducing antioxidant power of different pectins and hemicelluloses in tomato fruit
2.3 番茄果胶和半纤维素与抗氧化活性的相关性
对番茄中不同类型的果胶和半纤维素与抗氧化活性进行了相关性分析,结果如表2所示。WSP与DPPH·清除能力、ABTS+·清除能力存在极显著相关性(p<0.01)。CSP与DPPH·清除能力、ABTS+·清除能力存在极显著相关性(p<0.01),与ORAC、FRAP存在显著相关性(p<0.05)。SSP与ABTS+·清除能力、FRAP存在极显著相关性(p<0.01),但是与DPPH·清除能力存在显著负相关性(p<0.05)。LH与ABTS+·清除能力、FRAP存在极显著相关性(p<0.01),但与DPPH·清除能力存在显著负相关性(p<0.05)。TH与DPPH·清除能力存在极显著负相关性(p<0.01),与ABTS+·清除能力、FRAP具有显著相关性。不同抗氧化指标之间一般呈现显著或极显著正相关[33]。但是,由于不同测定方法的反应原理不同,以及番茄细胞壁各组分大分子溶液物理性质随浓度变化的影响,导致个别抗氧化指标间的相关性出现差异,如ORAC与FRAP存在极显著负相关(p<0.01)。
3 结论
利用溶解性和结合程度差异,分步提取番茄果皮细胞壁物质,得到WSP、CSP、SSP、LH和TH 5种组分,其中WSP含量显著高于CSP和SSP,TH含量显著高于LH(p<0.05)。这些果胶组分和半纤维素组分均表现出一定的ORAC、DPPH·清除能力、ABTS+·清除能力和FRAP体外抗氧化活性,并且相关性分析表明各组分与抗氧化活性密切相关。由于各组分之间结构和组成的差异,导致它们的功能特性存在差异。其中,CSP的ORAC、DPPH·清除能力和ABTS+·清除能力较强,综合抗氧化活性较强,而SSP、LH和TH具有较强的FRAP能力。番茄果皮的果胶和半纤维素具有较强的综合加工利用潜力,未来可开发为功能性食品添加成分。
[1]Christiaens S,Buggenhout S V,Houben K,et al. Process-Structure-Function Relations of Pectin in Food[J]. Critical Reviews in Food Science and Nutrition,2015,56(6):1021-1042.
[2]胡艳,张文林,周志钦. 柑橘果胶的生物学功能及其在生物医学中的应用[J]. 果树学报,2016,33(12):1567-1575.
[3]马惠玲,盛义保,张丽萍,等. 苹果渣果胶多糖的分离纯化与抗氧化活性研究[J]. 农业工程学报,2008(1):218-222.
[4]Scheller H V,Ulvskov P. Hemicelluloses[J]. Annual Review of Plant Biology,2010,61(4):263-289.
[5]张盆,胡惠仁,石淑兰. 半纤维素的应用[J]. 天津造纸,2006(2):16-18.
[6]田长城,许晖,孟海涛. 不同提取方法对柑橘皮果胶组分和抗氧化性的影响[J]. 食品科学,2013(13):83-86.
[7]董银萍,李拖平. 山楂果胶的抗氧化活性[J]. 食品科学,2014,35(3):29-32.
[8]常海军,王小燕. 南瓜多糖的提取及其抗氧化性研究[J]. 甘肃农业大学学报,2016(3):135-139+149.
[9]黄文烨. 山竹壳中果胶和酚类物质的提取纯化及理化性质研究[D]. 广州:暨南大学硕士学位论文,2016.
[10]Brett C,Waldron K. Physiology and biochemistry of plant cell walls[M]. Springer Netherlands,1996:198-211.
[11]Zhang L,Chen F,Yang H,et al. Changes in firmness,pectin content and nanostructure of two crisp peach cultivars after storage[J]. LWT-Food Science and Technology,2010,43(1):26-32.
[12]Gwanpua S G,Verlinden B E,Hertog M L A T M,et al. Slow softening of Kanzi apples(Malusdomestica,L.)is associated with preservation of pectin integrity in middle lamella[J]. Food Chemistry,2016,211:883-891.
[13]Huber D J,O’Donoghue E M. Polyuronides in Avocado(Perseaamericana)and Tomato(Lycopersiconesculentum)Fruits Exhibit Markedly Different Patterns of Molecular Weight Downshifts during Ripening[J]. Plant Physiology,1993,102(2):473.
[14]Brummell D A,Labavitch J M. Effect of Antisense Suppression of Endopolygalacturonase Activity on Polyuronide Molecular Weight in Ripening Tomato Fruit and in Fruit Homogenates[J]. Plant Physiology,1997,115(2):717-725.
[15]Maclachlan G. Endo-1,4-β-Glucanase,Xyloglucanase,and Xyloglucan Endo-Transglycosylase Activities versus Potential Substrates in Ripening Tomatoes[J]. Plant Physiology,1994,105(3):965-974.
[16]曹建康,姜微波,赵玉梅. 果蔬采后生理生化实验指导[M]. 北京:中国轻工业出版社,2007:84-87.
[17]Song W,Derito C M,Liu M K,et al. Cellular antioxidant activity of common vegetables[J]. Journal of Agricultural & Food Chemistry,2010,58(11):6621-6629.
[18]Li C,Huang Q,Fu X,et al. Characterization,antioxidant and immunomodulatory activities of polysaccharides from Prunella vulgaris Linn[J]. International Journal of Biological Macromolecules,2015,75:298-305.
[19]Liu H,Cao J,Jiang W. Evaluation of physiochemical and antioxidant activity changes during fruit on-tree ripening for the potential values of unripe peaches[J]. Scientia Horticulturae,2015,193:32-39.
[20]Redgwell R J,Melton L D,Brasch D J. Cell Wall Dissolution in Ripening Kiwifruit(Actinidiadeliciosa):Solubilization of the Pectic Polymers[J]. Plant physiology,1992,98(1):71-81.
[21]Paniagua C,Posé S,Morris V J,et al. Fruit softening and pectin disassembly:an overview of nanostructural pectin modifications assessed by atomic force microscopy[J]. Annals of Botany,2014,114(6):1375-1383.
[22]Brummell D A. Cell wall disassembly in ripening fruit[J]. Functional Plant Biology,2006,33(2):103-119.
[23]Xie F,Yuan S,Pan H,et al. Effect of yeast mannan treatments on ripening progress and modification of cell wall polysaccharides in tomato fruit[J]. Food Chemistry,2017,218:509-517.
[24]Cao G,Alessio H M,Cutler R G. Oxygen-radical absorbance capacity assay for antioxidants[J]. Free Radical Biology & Medicine,1993,14(3):303-311.
[25]Wang W,Ma X,Jiang P,et al. Characterization of pectin from grapefruit peel:A comparison of ultrasound-assisted and conventional heating extractions[J]. Food Hydrocolloids,2016,(61):730-739.
[26]傅献彩. 物理化学(第五版)[M]. 北京:高等教育出版社,2005:51-57.
[27]Jieun R,Yeongseok K,Hyeongmin K,et al. Anti-Oxidative Activity of Pectin and Its Stabilizing Effect on Retinyl Palmitate[J]. Korean Journal of Physiology & Pharmacology,2013,17(3):197-201.
[28]马丽苹,焦昆鹏,罗磊,等. 改性苹果果胶性质及抗氧化活性[J]. 食品科学,2016,1-11.
[29]王欣. 亚临界水法提取果渣果胶及其品质研究[D]. 杨凌:西北农林科技大学,2014.
[30]丁鹏,沈照鹏,张京良,等. 酶法制备黑莓果胶寡糖及其抗氧化活性研究[J]. 食品工业科技,2016,37(11):76-79.
[31]Benzie F,Strain J. Ferric reducing ability of plasma(FRAP)as a measure of “antioxidant power”:the FRAP assay[J]. Analytical Biochemistry,1996,239(1):70-76.
[32]Huang D,Ou B,Prior R L. The chemistry behind antioxidant capacity assays[J]. Journal of Agricultural & Food Chemistry,2005,53(6):1841-56.
[33]丁胜华. 生长成熟与干制对枣果品质特性及其果胶多糖的形成规律研究[D]. 北京:中国农业大学博士学位论文,2014.

