ABR-MBR组合工艺短程硝化过程的微生物种群
赵诗惠,吕 亮,蒋志云,吴忆宁,吴 鹏,3,沈耀良,3* (1.苏州科技大学环境科学与工程学院,江苏 苏州 215009;2.江苏省水处理技术与材料协同创新中心,江苏 苏州 215009;3.江苏省环境科学与工程重点实验室,江苏 苏州 215009)
目前,废水生物处理中的短程硝化是污水处理领域的研究热点[1-2],而微生物在系统中的种群特征研究有待进一步深入开展.已有的研究表明,在污水处理系统活性污泥中AOB是占主导地位的优势菌群[3-4],可通过控制水力停留时间[5-6]、溶解氧[7-8]、pH值[9]、温度[10-11]等因素使AOB大量富集以实现短程硝化[12].微生态系统的特征直接影响废水处理的效果,因此,分析和研究微生物的特性十分重要,这不仅对短程硝化工艺的优化和控制提供依据,也为开发新型短程硝化工艺具有很重要作用.
现代分子生物学技术可以较精确的分析微生物多样性,且广泛应用于微生物群落结构、功能菌分布特征等方面[13-14],如聚合酶链反应(PCR)、荧光原位杂交技术(FISH)、实时荧光定量PCR、高通量测序和克隆测序等方法[15-19].高通量测序技术作为新一代微生物种群鉴定技术,具有分析结果准确、高效和高灵敏度等特点,在环境微生物领域应用广泛.本研究采用Miseq高通量测序手段对ABR-MBR组合工艺短程硝化过程中微生物种群丰度、多样性及优势菌群分布特征进行分析,以期为短程硝化过程提供理论支持.
1 材料与方法
1.1 试验装置

图1 ABR-MBR组合工艺实验装置Fig.1 Schematic diagram of ABR-MBR setup
采用的ABR-MBR组合工艺试验装置如图1所示.该装置由4个隔室的ABR反应器和MBR好氧池耦合而成,均采用有机玻璃制成.ABR反应器和MBR好氧池的有效容积分别为7.2L和3.6L,MBR好氧池底部采用微孔曝气装置.
1.2 试验水质和接种污泥
试验用水为低C/N模拟生活污水,详见表1.反应器的接种污泥取自苏州市某城市污水处理厂,为全程硝化污泥,硝化性能良好.ABR和MBR反应器接种污泥MLSS分别约为28000mg/L和4000mg/L.

表1 ABR-MBR组合工艺进水水质Table 1 Characteristics of the influent wastewater in ABR-MBR process
1.3 ABR-MBR组合工艺的运行
本研究的ABR-MBR反应器运行数据取自第41d~179d,根据运行参数将试验分为9个阶段(Ⅰ~Ⅸ)如表2所示.研究过程中,通过水浴加热控制温度为28~32℃、pH值为7.1~7.4、保持MBR溶解氧浓度为0.5~1mg/L.
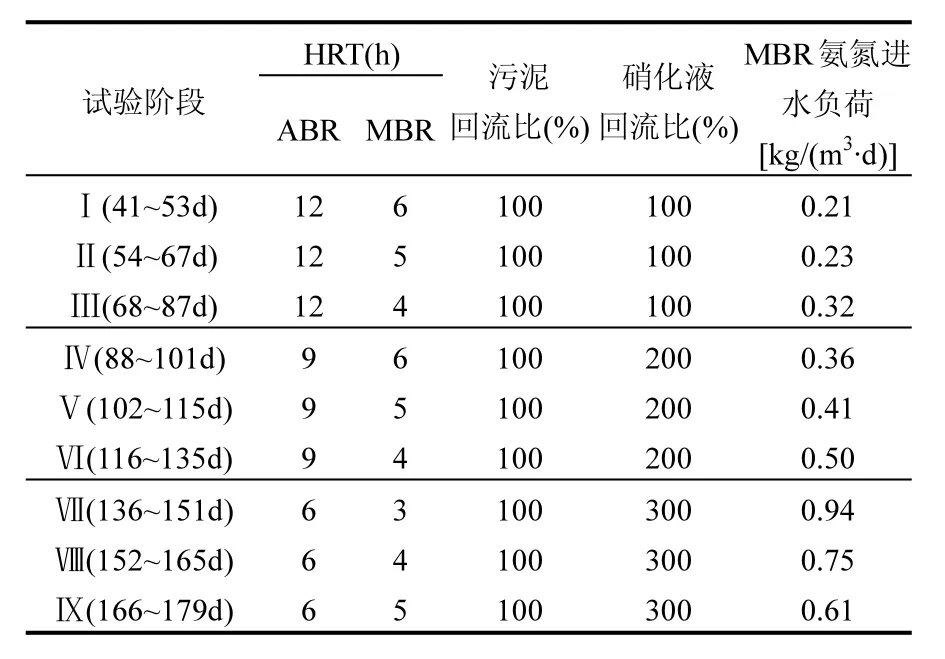
表2 ABR-MBR组合工艺试验方案及运行参数Table 2 Experimental schemes and parameter of ABR-MBR processes
1.4 水质指标的检测和方法
反应器运行期间,定期采集水样经0.45μm中性滤纸过滤后,按照国家环保部规定的标准方法《水质和废水监测分析方法》[20]对COD、氨氮()、硝酸盐氮()、亚硝酸盐氮()和磷酸盐()指标进行测定分析.其中COD采用快速消解法,采用纳氏试剂光度法,N采用紫外分光光度法,采用N-(1-萘基)-乙二胺分光光度法,采用钼锑抗分光光度法.为方便数据分析,定义亚硝酸盐积累率(NAR)如式(1):

1.5 微生物多样性的检测和方法
样品采集:为研究短程硝化系统中的微生物种群,在MBR氨氮进水负荷为0.32、0.50、0.94kg/(m3·d)且稳定运行时期,于MBR中部进行取样,污泥样品对应编号为M1、M2和M3.
总DNA的提取与PCR扩增:采用FastPrep DNA提取试剂盒法(QBIOGENE,USA)DNA,完成基因组DNA抽提,并利用1%琼脂糖凝胶电泳检测抽提的基因组DNA.PCR扩增测序区域为338F_806R,扩增引物采用16S RNA基因V3~V4区通用引物(338F/806R).引物名称和引物序列分别是338F(ACTCCTACGGGAGGCAGCAG)和806R(GGACT ACHVGGGTWTCTAAT).PCR正式试验采用TransGen AP 221-02:TransStartFastpfu DNA Polymerase,20μL反应体系.全部样本按照正式实验条件进行,每个样本3个重复,将同一样本的PCR产物混合后用2%琼脂糖凝胶电泳检测,使用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)切胶回收PCR产物,Tris_HCl洗脱;2%琼脂糖电泳检测.参照电泳初步定量结果,将PCR产物用QuantiFluor™ -ST蓝色荧光定量系统(Promega公司)进行检测定量,之后按照每个样本的测序量要求,进行相应比例的混合.
Miseq文库构建与测序:1) Miseq文库构建:通过PCR将Illumina官方接头序列添加至目标区域外端并回收PCR产物;Tris-HCl缓冲液洗脱,2%琼脂糖电泳检测;氢氧化钠变性,产生单链DNA片段.2)Miseq测序:按照高通量测序平台的操作说明对形成的cDNA文库进行Miseq高通量测序,将测序得到的DNA序列进行拼接,同时进行质量控制,对区分样品后得到的有效数据进行操作分类单元(OUT)分类.并利用i-sanger生信分析云平台对有效数据进行在线处理和分析.
生物多样性和分类学分析:将序列按照彼此的相似性归为操作分类单元(OTU),按照97%相似性对非重复序列(不含单序列)进行OTU聚类,在聚类过程中去除嵌合体,得到OTU的代表序列.为了得到每个OTU对应的物种分类信息,采用RDP classifier贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析,分别在各个分类水平:domain(域)、kingdom(界)、phylum(门)、class(纲)、order(目)、family(科)、genus(属)和species(种)统计各样本的群落组成.通过单样本的多样性(Alpha多样性)分析反映微生物群落的丰度和多样性,如Chao指数、ACE指数可以反映群落丰富度;shannon指数、simpson指数和coverage指数可以反映群落多样性.
2 结果与讨论
2.1 ABR-MBR反应器运行状况分析
由图2可见,在Ⅰ~Ⅶ阶段,随着MBR氨氮进水负荷的提高,ABR-MBR反应器中平均出水由24.1mg/L降为4.6mg/L,平均出水由2.5mg/L升至8.2mg/L,同时亚硝酸盐积累率整体呈上升趋势,逐步向短程硝化转变.在MBR氨氮进水负荷为0.21~0.32kg/(m3·d)时(Ⅰ~Ⅲ),亚硝酸盐积累率维持在10%~20%;缩短ABR水力停留时间,从而提高MBR氨氮进水负荷为0.36~0.50kg/(m3·d)(Ⅳ~Ⅵ),此时亚硝酸盐积累率上升并接近40%;继续缩短ABR水力停留时间为6h,MBR水力停留时间为3h,此时氨氮负荷为0.94kg/(m3·d),亚硝酸盐积累率进一步提高到60%以上,同时氨氮去除率稳定在90%以上,即MBR实现了短程硝化的稳定运行.继而通过调控MBR池中液位高度增加MBR水力停留时间为4h和5h(Ⅷ、Ⅸ),进水氨氮负荷随之降低,亚硝酸盐积累率降低到40%甚至一度低于20%以下.由于较低的氨氮负荷使NOB的活性抑制减小,使较多的转化为,导致亚硝酸盐积累率降低[21],从另一个角度也说明短程硝化过程受环境影响较大.侯爱月等[22]对模拟无机城市污水采用SBR反应器控制温度在20~22℃,pH值在7.2~7.9,溶解氧在0.5~1mg/L,运行至第80个周期,NAR达到90%,实现了稳定的短程硝化.本研究中,控制温度为28~32℃、pH值为7.1~7.4、采用低溶解氧浓度(0.5~1mg/L)的运行条件,逐步提高MBR氨氮进水负荷是ABR-MBR组合工艺实现短程硝化的主要原因.

图2 不同MBR氨氮进水负荷下、和NAR的变化Fig.2 Variations of 、 and NAR at different influent ALR
2.2 Miseq高通量测序结果分析
2.2.1 微生物种群多样性分析 利用Miseq平台对MBR氨氮进水负荷分别为0.32、0.50、0.94kg/(m3·d)时的3个样品进行高通量测序,分别获得40201、38167、39827条优化序列,将优化序列在97%的相似性下进行聚类,分别获得409、512、588个OTU数(如表3).并且3个样品的Coverage(物种覆盖度)均大于99%,表明本次测序结果能够代表样本中微生物的真实情况.
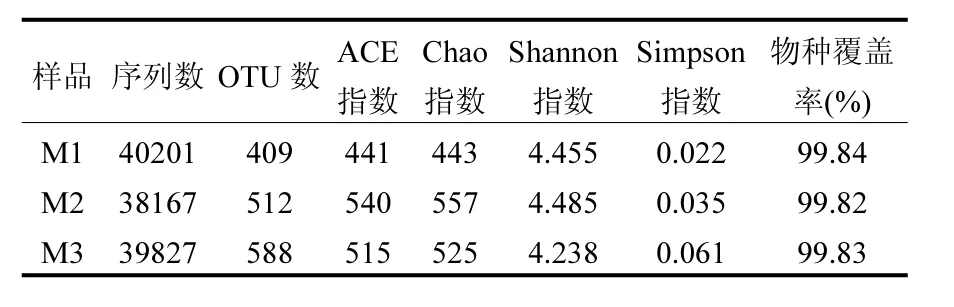
表3 MBR池微生物种群丰度和多样性分析Table 3 Species abundance and diversity of microbial communities in the MBR
ACE指数和Chao指数是用来估计群落中OTU数目的指数,反映微生物种群的丰富度,值越高表明微生物种群丰富度越高;Shannon指数和Simpson指数是用来估算样本中微生物多样性的指数,Shannon值越大,说明微生物种群多样性越高,Simpson指数值越大,说明微生物种群多样性越低,同时也说明优势微生物占总生物量的比例越大.
表3显示,3个污泥样品的ACE指数、Chao指数和Shannon指数均为M2>M3>M1,结果表明,当MBR氨氮进水负荷为0.50kg/(m3·d)时,系统中微生物种群的丰富度和多样性均高于其他两种情况.该条件提供给大量微生物适宜生长的环境和基质,使大量微生物共存.此外,3个样品的丰富度指数波动变化较小,表明氨氮负荷对MBR池微生物种群的丰富度影响较小.另一方面,3个污泥样品的Simpson指数为M3>M2>M1,结果表明,随氨氮负荷升高,系统中优势微生物占总生物量比重逐渐增大,即优势微生物愈来愈明显.当MBR氨氮进水负荷为0.940kg/(m3·d)时(污泥样品为M3),MBR池中微生物种群多样性呈较低水平,优势微生物种群比例较大且明显.由于较高的氨氮进水负荷为微生物提供较充足的基质浓度,使Nitrosomonas菌逐渐富集, Nitrosomona菌可有效地将转化为,同时亚硝酸盐积累率稳定在60%以上,但较低的氨氮负荷下优势微生物种群不明显.因此,在不同氨氮负荷条件下,微生物种群的丰度指数和多样性指数均较高,使系统微生物结构较稳定,保证了ABR-MBR组合工艺的稳定运行.
2.2.2 门水平优势微生物种群分析 图3给出了污泥样品在门水平微生物种群组成,表明其具有较高的多样性,且存在7~8个门.主要包括变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi)、绿菌门(Chlorobi)、酸杆菌门(Acidobacteria)、硝化螺旋菌门(Nitrospirae)等,并以变形菌门和拟杆菌门微生物为主,二者的相对丰度比例约占73%~85%.除此之外,厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)和芽单胞菌门(Gemmatimonadetes)是M2和M3特有的菌群.

图3 微生物种群分类(门)的群落组成相对百分比Fig.3 Precent of microbial communities on phylun level
从中可知,变形菌门为3个污泥样品中占比最大的菌群,丰度分别为60.04%、41.04%和67.77%,结果表明,变形菌门在系统中为优势菌群,这一结果与侯爱月等的研究结果一致即变形菌门所占比例最大为35%.国内外研究表明,大多数在生物脱氮及诸多污染物降解过程中起重要作用的微生物均归属于变形菌门[23-24].因此,测试结果也说明MBR池中的污泥具有较好的生物脱氮及去除污染物的能力.其次为拟杆菌门,在3个样品中的丰度比例分别为19.67%、26.12%和16.53%.其常存在于城市或工业污水处理厂的活性污泥中,是一种特殊的细菌,包括糖的降解,并可能参与多糖和肽的转化[25].厚壁菌门存在于M2和M3样品中,所占比例为5.84%和1.60%,其主要以芽孢杆菌为主,另外含有少量的微杆菌和葡萄球菌,值得一提的是,芽孢杆菌具有促硝化作用,能够降解废水中的氨氮,因此具有较好的污水净化能力[26].除此之外,硝化螺菌属(Nitrospira)所在的硝化螺旋菌门在各个样品中所占比例较小,而Nitrospira是绝大多数文献中报道的在生物脱氮过程中占主导地位的亚硝酸盐氧化菌(NOB)[27-28].
为进一步探索脱氮微生物所在的变形菌门在不同MBR氨氮进水负荷下微生物的分布特征,现对MBR池中变形菌门在纲分类水平的分布特征进行分析,结果见表4.从中可知,3个样品中β-变形菌纲(Bataproteobacteria)是变形菌门丰度最大的菌群,其占细菌总量的比例分别为51.64%、62.73%和57.05%.另外,β-变形菌纲中存在的部分反硝化细菌和亚硝化细菌在脱氮及污染物去除中起着重要作用[29].其次为γ-变形菌纲(Gamaproteobacteria),占比为26.53%、18.86%和18.24%,而δ-变形菌纲(Deltaproteobacteria)和α-变形菌纲(Alphaproteobacteria)占比最低.
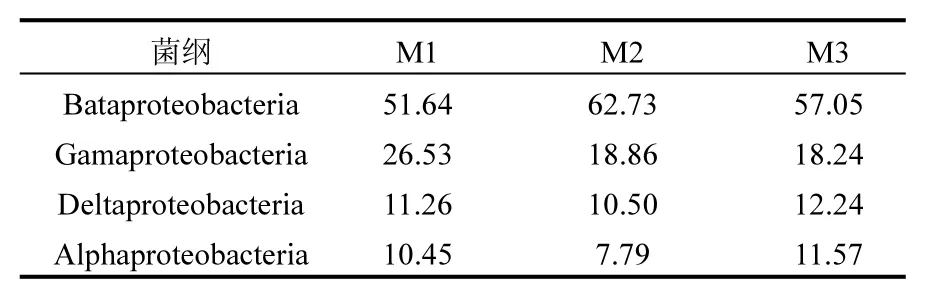
表4 MBR池中变形菌门微生物的群落组成相对百分比(%)Table 4 Precent of microbial communities on Proteobacteria in the MBR on class levle (%)
2.2.3 属水平优势微生物种群分析 为进一步阐明系统在运行过程中微生物种群的变化情况,在属的水平上对3个样品的功能微生物及优势菌群进行分析.
如图4所示,在属分类水平上,3个样品中主要属类为亚硝化单胞菌属(Nitrosomonas)、硝化螺菌属(Nitrospira)、甲基球菌属(Methyloparacoccus)和Denitratisoma.其功能微生物为脱氮微生物,主要包括亚硝化单胞菌属(Nitrosomonas),硝化螺菌属(Nitrospira)和Denitratisoma,还包括属于β-变形菌纲的陶厄氏菌属(Thauera)和硫杆菌属(Thiobacillus)等反硝化菌.由于MBR池内COD较低,同时存在充足的和,且存在曝气不完全的缺氧微环境,为自养反硝化菌提供了适宜的生长环境.

图4 微生物种群分类(属)的群落组成相对百分比Fig.4 Precent of microbial communities on genus leve
该短程硝化系统中,存在亚硝化单胞菌属(Nitrosomonas),无亚硝化螺菌属(Nitrosospira),可以推断AOB为Nitrosomonas,占总生物量的比例为4.62%~22.56%,且为优势菌种,而NOB为硝化螺旋菌门(Nitrospirae)的硝化螺菌属(Nitrospira),所占比例为0.06%~2.12%.另外,侯爱月等人的研究结果中AOB所占比例为22.5%,NOB仅为3.75%,证实了AOB的大量富集有利于短程硝化的实现.这一结果与多数污水处理系统中占优势的AOB为Nitrosomonas,NOB所占比例较小的研究结果相吻合[30].系统中Denitratisoma具有反硝化性能,占总生物量的1.13%~5.27%.此时,ABRMBR组合工艺的出水氨氮浓度低于2mg/L.因此,功能微生物的结构稳定性保证了底物有效降解,同时为系统的处理效果提供了保证.
亚硝化单胞菌属(Nitrosomonas)和硝化螺菌属(Nitrospira)是脱氮系统中常见的亚硝化和硝化细菌.图5给出了AOB和NOB的分布特征,在不同MBR氨氮进水负荷下,其占总细菌的分布比例不同,当氨氮负荷由0.21kg/(m3·d)的增加至0.94kg/(m3·d)时,Nitrosomonas和Nitrospira占总生物量比例都在逐渐增加,相对来说,Nitrosomonas的增加幅度较大,而Nitrospira的增加幅度较小且以较低的丰度水平存在于系统中.在氨氮负荷为0.94kg/(m3·d)时,Nitrosomonas占总生物量比例达到22.56%,Nitrospira占2.12%.此时,亚硝酸盐积累率达到60%以上,氨氮去除率稳定在90%以上,结果表明短程硝化的实现来自于AOB的大量富集,而NOB的小幅度增长不会影响短程硝化的实现.
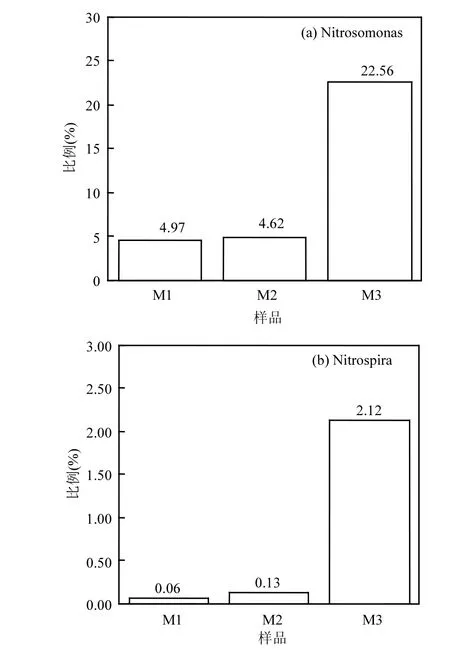
图5 AOB和NOB分布特征Fig.5 Distribution characteristics of AOB and NOB
3 结论
3.1 在ABR-MBR组合工艺中,控制温度为28~32℃、pH值为7.1~7.4、DO为0.5~1mg/L,逐步提高MBR氨氮进水负荷,可促进AOB菌群大量富集,实现短程硝化的稳定运行.在氨氮负荷为0.94kg/(m3·d)时,Nitrosomonas的相对丰度为22.56%,亚硝酸盐积累率稳定在60%以上.
3.2 该短程硝化系统中,AOB为亚硝化单胞菌属(Nitrosomonas),无亚硝化螺菌属(Nitrosospira),Nitrosomonas一直存在于MBR好氧池中并逐渐成为优势菌种,而NOB为硝化螺菌属(Nitrospira).当MBR氨氮进水负荷由0.21kg/(m3·d)升至0.94kg/(m3·d)时,Nitrosomonas占总细菌比例由4.97%升高至22.56%,而Nitrospira占总细菌比例一直保持较低水平,仅为0.06%~2.12%.
3.3 ABR-MBR组合工艺中,亚硝酸盐积累率与AOB的活性、相对丰度密切相关.AOB的大量富集有利于短程硝化的实现,NOB的小幅度增长不会影响短程硝化的实现.
[1] Ciudad G, Munoz O R, Ruiz G, et al. Partial nitrification of high ammonia concentration wastewater as a part of a shortcut biological nitrogen removal process. Process Biochem [J].Process Biochemistry, 2005,40(5):1715-1719.
[2] Wang C C, Lee P H, Kumar M, et al. Simultaneous partial nitrification, anaerobic ammonium oxidation and denitrification(SNAD) in a full-scale landfill-leachate treatment plant. [J].Journal of Hazardous Materials, 2010,175(1-3):622-628.
[3] Limpiyakorn T, Shinohara Y, Kurisu F, et al. Communities of ammonia-oxidizing bacteria in activated sludge of various sewage treatment plants in Tokyo [J]. Fems Microbiology Ecology, 2005,54(2):205-217.
[4] Criddle C, Wells G. Community analysis of ammonia-oxidizing bacteria in activated sludge of eight wastewater treatment systems[J]. Journal of Environmental Sciences, 2010,22(4):627-634.
[5] 李 磊,张立东,刘晶茹,等.实时荧光定量PCR对A2/O短程硝化系统内氨氧化菌的定量分析 [J]. 环境工程学报, 2012,6(10):3597-3602.
[6] Hallin S, Lydmark P, Kokalj S, et al. Community survey of ammonia-oxidizing bacteria in full-scale activated sludge processes with different solids retention time [J]. Journal of Applied Microbiology, 2005,99(3):629-640.
[7] 曾 薇,李 磊,杨莹莹军,等. A2/O工艺处理生活污水短程硝化反硝化的研究 [J]. 中国环境科学, 2010,30(5):625-632.
[8] Guo J, Peng Y, Wang S, et al. Long-term effect of dissolved oxygen on partial nitrification performance and microbial community structure. [J]. Bioresource Technology, 2009,100(11):2796-2802.
[9] Ciudad G, González R, Bornhardt C, et al. Modes of operation and pH control as enhancement factors for partial nitrification with oxygen transport limitation. [J]. Water Research, 2007,41(20):4621-4629.
[10] 吴 鹏,陆爽君,徐乐中,等.温度对ABR-MBR复合工艺处理生活污水的影响及其微生物群落分析 [J]. 环境科学, 2014,35(9):3466-3472.
[11] 徐 浩,李 捷,罗 凡,等.低C/N比城市污水短程硝化特性及微生物种群分布 [J]. 环境工程学报, 2017,11(3):1477-1481.
[12] Turk O, Mavinic D S. Benefits of using selective inhibition to remove nitrogen from highly nitrogenous wastes [J].Environmental Technology, 1987,8(1-12):419-426.
[13] 蔡言安,李 冬,毕学军,等.基于不同测序技术的生物群落结构及功能菌分析 [J]. 中国环境科学, 2016,36(6):1830-1834.
[14] Pace N R. A molecular view of microbial diversity and the biosphere [J]. Science, 1997,276(5313):734-740.
[15] Lyautey E, Lacoste B N D, Ten-Hage L C, et al. Analysis of bacterial diversity in river biofilms using 16S rDNA PCR-DGGE:methodological settings and fingerprints interpretation [J]. Water Research, 2005,39(2/3):380-388.
[16] Wu P, Ji X, Song X, et al. Nutrient removal performance and microbial community analysis of a combined ABR–MBR(CAMBR) process [J]. Chemical Engineering Journal, 2013,232(9):273-279.
[17] López-Gutiérrez J C, Henry S, Hallet S, et al. Quantification of a novel group of nitrate-reducing bacteria in the environment by real-time PCR [J]. Journal of Microbiological Methods, 2004,57(3):399-407.
[18] 曾 薇,杨 庆,张树军,等.采用FISH、DGGE和Cloning对短程脱氮系统中硝化菌群的比较分析 [J]. 环境科学学报, 2006,26(5):734-739.
[19] 陈重军,张海芹,汪瑶琪,等.基于高通量测序的ABR厌氧氨氧化反应器各隔室细菌群落特征分析 [J]. 环境科学, 2016,37(7):2652-2658.
[20] 编委会国家环境保护总局水和废水监测分析方法.水和废水监测分析方法 [M]. 4版.中国环境科学出版社, 2002.
[21] Jubany I, Lafuente J, Baeza J A, et al. Total and stable washout of nitrite oxidizing bacteria from a nitrifying continuous activated sludge system using automatic control based on Oxygen Uptake Rate measurements. [J]. Water Research, 2009,43(11):2761-2772.
[22] 侯爱月,李 军,卞 伟,等.不同短程硝化系统中微生物群落结构的对比分析 [J]. 中国环境科学, 2016,36(2):428-436.
[23] Chang Y M, Yang Q, Hao C B, et al. [Experimental study of autotrophic denitrification bacteria through bioaugmentation of activated sludge from municipal wastewater plant]. [J].Environmental Science, 2011,32(4):1210-1216.
[24] 赵志瑞,马 斌,张树军,等.高氨氮废水与城市生活污水短程硝化系统菌群比较 [J]. 环境科学, 2013,34(4):1448-1456.
[25] Kragelund C, Levantesi C, Borger A. Identity, abundance and ecophysiology of filamentous bacteria belonging to the Bacteroidetes present in activated sludge plants [J]. Microbiology,2008,154(Pt 3):886-894.
[26] Yang C, Zhang W, Liu R, et al. Phylogenetic diversity and metabolic potential of activated sludge microbial communities in full-scale wastewater treatment plants. [J]. Environmental Science & Technology, 2011,45(17):7408-7415.
[27] Park H D, Noguera D R. Nitrospira community composition in nitrifying reactors operated with two different dissolved oxygen levels [J]. Journal of Microbiology & Biotechnology, 2008,18(8):1470-1474.
[28] Burrell P, Keller J, Blackall L L. Characterisation of the bacterial consortium involved in nitrite oxidation in activated sludge [J].Water Science & Technology, 1999,39(6):45-52.
[29] Thomsen T R, Kong Y, Nielsen P H. Ecophysiology of abundant denitrifying bacteria in activated sludge [J]. Fems Microbiology Ecology, 2007,60(3):370-382.
[30] 高晨晨,郑兴灿,游 佳,等.城市污水脱氮除磷系统的活性污泥菌群结构特征 [J]. 中国给水排水, 2015,31(23):37-42.

