转录因子7类似物2在胃癌中的表达及其与铂类药物耐药性的关系
付翠群,丁西平,沈国栋,侯冠峰,戴朦,沈干,胡世莲
[中国科学技术大学附属第一医院(安徽省立医院),安徽省老年医学研究所,肿瘤免疫与营养治疗安徽省重点实验室,安徽省循证医学中心,合肥 230001]
胃癌是全世界最常见的恶性肿瘤之一,我国胃癌发病率与致死率在恶性肿瘤中均居前列,严重危害人类健康[1]。早期胃癌经外科手术和药物化疗可治愈,但是我国大多数胃癌患者确诊时已经是晚期,失去了手术治疗的最佳时期。对于晚期胃癌患者,化疗是其最主要的治疗方法,然而很多患者对多种化疗药物产生耐受,导致化疗结果不理想,降低患者的生存质量和生存年限。因此,寻找与胃癌化疗耐药相关的分子标记物,对胃癌的化学治疗有很重要的临床意义。已有研究显示Wnt通路在结肠癌与乳腺癌等多种肿瘤细胞中呈活化状态,其中转录因子7类似物2(TCF7L2)是该信号通路中关键的下游靶基因之一[2]。国内外对TCF7L2的研究主要在糖尿病和乳腺癌方面,在胃癌中的表达情况尚无研究,本研究主要研究TCF7L2在胃癌中的表达情况及其与胃癌化疗耐药的关系。如果TCF7L2在胃癌中异常高表达,并与胃癌的化疗耐药存在相关性,为日后胃癌的靶向治疗提供新的靶点,提高胃癌化疗患者的存活率。
1 材料与方法
1.1 药物及试剂 RPMI-1640培养基和胎牛血清(美国GIBCL公司);TCF7L2 兔mAb、β-actin 兔 mAb、抗兔IgG(美国CST公司);RIPA裂解液(上海碧云天生物技术有限公司);蛋白磷酸酶抑制剂、蛋白酶抑制剂混合物(瑞士Roche公司);显影液(上海天能科技有限公司);BCA试剂盒(上海碧云天生物技术有限公司)RNeasy mini Kit(德国Qiagen GmbH,Hilden公司);High Capacity cDNA Reverse Transcription Kit(美国生命技术公司);引物TCF7L2、β-actin(日本TaKaRa Clon Tech公司)。
1.2 实验方法
1.2.1 临床标本获取 人胃癌组织和胃癌旁组织均取自安徽省立医院普外科胃癌患者手术切除的组织中,其中胃癌组织最后病理结果均为腺癌,胃癌旁组织取距离癌巢≥2 cm远处。在无菌的环境下取组织标本,用无菌0.9%氯化钠注射溶液将组织清洗,并剔除脂肪组织,获得最终本研究需要的组织,总共收集15例胃癌患者的胃癌组织和胃癌旁正常组织。标本的获取及其用途经患者本人知情同意,所有标本仅用于科研实验。
1.2.2 质粒稳定转染 转染24 h前,在30 mm培养皿中接种适量密度的SGC7901细胞(约2×105/mL),待细胞生长面积达50%~80%时即可用于转染。配制溶液1∶240 μL无血清培养基+10 μL LP2000,室温孵育5 min;溶液2∶250 μL无血清培养基+2 μg TCF7L2表达质粒,室温孵育5 min;将溶液1与溶液2混合,室温下放置20 min;将6孔板中的细胞用无血清培养基冲洗细胞两遍后,加入2 mL无血清培养基;将溶液1与溶液2的混合液逐滴加入孔中,摇动培养板,轻轻混匀;置于37 ℃,5%CO2细胞培养箱中保温4~6 h;更换含有血清的全培养基,置于37 ℃,5%CO2细胞培养箱中培养24 h,将六孔板中转染的细胞用0.25%的胰酶消化成单细胞悬液,按照每孔一个细胞比例稀释后加入96孔板,并加入适量purocymin进行筛选,最终获得knock-in TCF7L2 的SGC-7901/TCF7L2细胞和对照组SGC-7901/CON细胞株[3]。
1.2.3 细胞培养 人胃癌SGC-7901/CON和SGC-7901/TCF7L2细胞株分别在含10 %小牛血清RPMI-1640完全培养基、37 ℃、体积分数为5%CO2及饱和湿度条件下进行常规培养[4]。
1.2.4 免疫印迹检测 应用RIPA裂解液、蛋白磷酸酶抑制剂和蛋白酶抑制剂混合物制成的混合物裂解细胞提取蛋白和组织蛋白,具体实验步骤见说明书;应用BCA试剂盒测蛋白浓度,加蛋白上样缓冲液,于100 ℃水中煮沸5~10 min,冰上冷却上样;取出凝胶常规转膜后在5%的脱脂奶中封闭2 h,加1∶1000稀释的β-actin Rabbit mAb,摇床摇荡孵育4 ℃过夜,PBST漂洗过后将膜与HRP结合的二抗(Anti-Rabbit IgG)1∶1000稀释室温摇荡孵育2 h[5-6]。然后用PBST充分洗膜后将显影液加于PVDF膜上,在显影仪上显影。
1.2.5 实时定量PCR 应用RNeasy mini Kit试剂盒提取RNA,具体步骤见该试剂盒说明书;核酸蛋白测定仪测定抽提RNA的浓度,根据High Capacity cDNA Reverse Transcription Kit说明书操作步骤进行逆转录得到cDNA;以cDNA为模板,扩增TCF7L2片段,选β-actin作为内参[7-8]。引物序列:TCF7L2上游为AAACAGGAATCGTCCCAGAGTG,下游为CTCAGCTACGACCTTTGCTCTCA;β-actin上游为TTG CCG ACA GGA TGC AGA A,下游为GCC GAT CCA CAC GGA GTA CTT,结果进行计算,采用2-△△Ct进行表示。
1.2.6 耐药实验 收集SGC-7901/CON及SGC-7901/TCF7L2细胞株,分别制成浓度为10×104/mL的单细胞悬液,接种6孔板,每孔2 mL。分别加入5种不同浓度的化疗药物,即顺铂(DDP,0.01、0.1、1、10、100 μmol/L),卡铂(DBP,0.01、0.1、1、10、100 μmol/L),每个药物浓度设2个复孔,另设2个复孔不加药物作为空白对照组。37 ℃、5%CO2饱和湿度孵箱中培养48 h[9]。用PBS洗2次,用500 μL的0.25%胰酶消化10 min,再加入500 mL PBS,用1 mL移液枪吹打均匀,在显微镜下计数,结果取用2复孔的均值进行表示。
1.2.7 免疫组织化学 将由甲醛固定、石蜡包埋后的切片行2 μm连续切片,经免疫组织化学SP法:在电烘箱内以60 ℃的条件烘烤10~20 min后,放入二甲苯中脱蜡以及梯度酒精中脱水,在枸橼酸(pH7.2)溶液中通过高温高压的方式进行抗原修复,自然冷却至室温,经3%的过氧化氢溶液清除内源性氧化酶,用山羊血清室温封闭30 min,弃去,加入TCF7L2抗体工作液(1∶150)4 ℃过夜,次日经PBS(pH 7.2)洗净后,二抗孵育1 h,DAB染色剂,染色时间控制在6 min以内,清水终止,放入苏木精中复染,最后进行梯度酒精二甲苯脱水透明化,进行封片,并在显微镜下拍照。
1.3 统计学处理 采用SPSS17.0软件分析数据,多组样本均数的比较采用单因素方差分析,方差齐者采用LSDt检验,方差不齐者采用Games Howell检验。两组独立样本的比较,数据服从正态分布者采用独立样本t检验,若数据不服从正态分布者采用秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 胃癌组织中的TCF7L2表达量明显高于癌旁组织 共收集15例患者胃癌组织和胃癌旁组织,并对其进行研究。如图1所示,15例患者胃癌组织中的TCF7L2 mRNA量明显高于胃癌旁组织(P=0.001)。
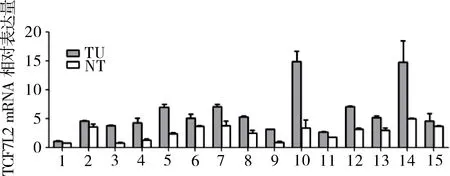
TU:胃癌组织,NT:胃癌癌旁组织
2.2 胃癌细胞株中TCF7L2高表达 选取6个胃癌细胞株(SGC-7901、HSC44、44AS3、N87、MKN45、MGC803)和一个人正常胃黏膜细胞株(GES-1)进行检测。结果显示与正常细胞株相比TCF7L2基因在胃癌细胞株均异常高表达,但是表达的量因细胞株不同的而不同,其中SGC-7901细胞株TCF7L2的表达量最低,44AS3细胞株表达量最高(见图2)。

图2 人胃癌细胞株western blot结果
2.3 SGC-7901/TCF7L2细胞株中TCF7L2表达 选取TCF7L2表达最低的细胞株SGC-7901经过稳定转染技术获得SGC-7901/TCF7L2和SGC-7901/CON(对照组)两细胞株。SGC-7901/TCF7L2中TCF7L2 mRNA的量明显高于对照组,差异有统计学意义,P=0.029;SGC-7901/TCF7L2中TCF7L2蛋白表达量也明显高于对照组(见图3)。
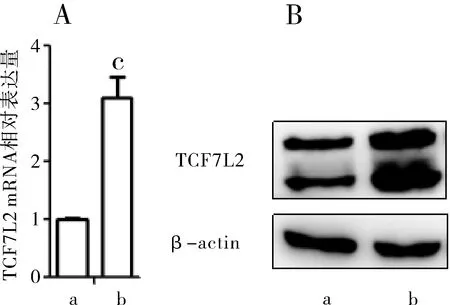
A:细胞株qRT-PCR结果图;B:细胞株western blot结果图;a:SGC-7901/CON细胞株,b:SGC-7901/TCF7L2细胞株;与SGC-7901/CON比较,cP<0.05
图3SGC-7901/CON细胞株和SGC-7901/TCF7L2细胞株qRT-PCR、western blot结果
2.4 SGC-7901/TCF7L2细胞株对铂类的耐药性 分析显示顺铂对SGC-7901/CON细胞株和SGC-7901/TCF7L2细胞株的IC50值分别是2.85 μmol/L和12.21 μmol/L,与SGC-7901/CON细胞株相比较,SGC-7901/TCF7L2细胞株对顺铂的耐药性是4.28倍,两者差异有统计学意义(P=0.007);卡铂对SGC-7901/CON细胞株和SGC-7901/TCF7L2细胞株的IC50值分别是2.82 μmol/L和5.81 μmol/L,与SGC-7901/CON细胞株相比较,SGC-7901/TCF7L2细胞株对顺铂的耐药性是2.06倍,两者差异有统计学意义(P=0.008)(见图4)。
3 讨论
有研究[10]显示Wnt信号通路与肿瘤化疗耐药有关。在胃癌的发展过程中Wnt信号异常激活,包括Wnt表达的频率上调[11],以及β-catenin/TCF4的核异位现象,初步确认了Wnt通路参与了胃癌的发生发展[12]。TCF7L2是TCF家族的一员,是Wnt通路中最为重要的下游转录因子[13-14]。当Wnt信号通路异常激活时,未被降解的β-catenin进入核内,与TCF7L2的相关结构域结合形成转录复合物,并与其他转录因子结合使下游靶基因过度表达,促进了肿瘤的发生发展[15-16]。因此,TCF7L2基因在胃癌中是否异常表达与胃癌的发生发展可能存在相关性。
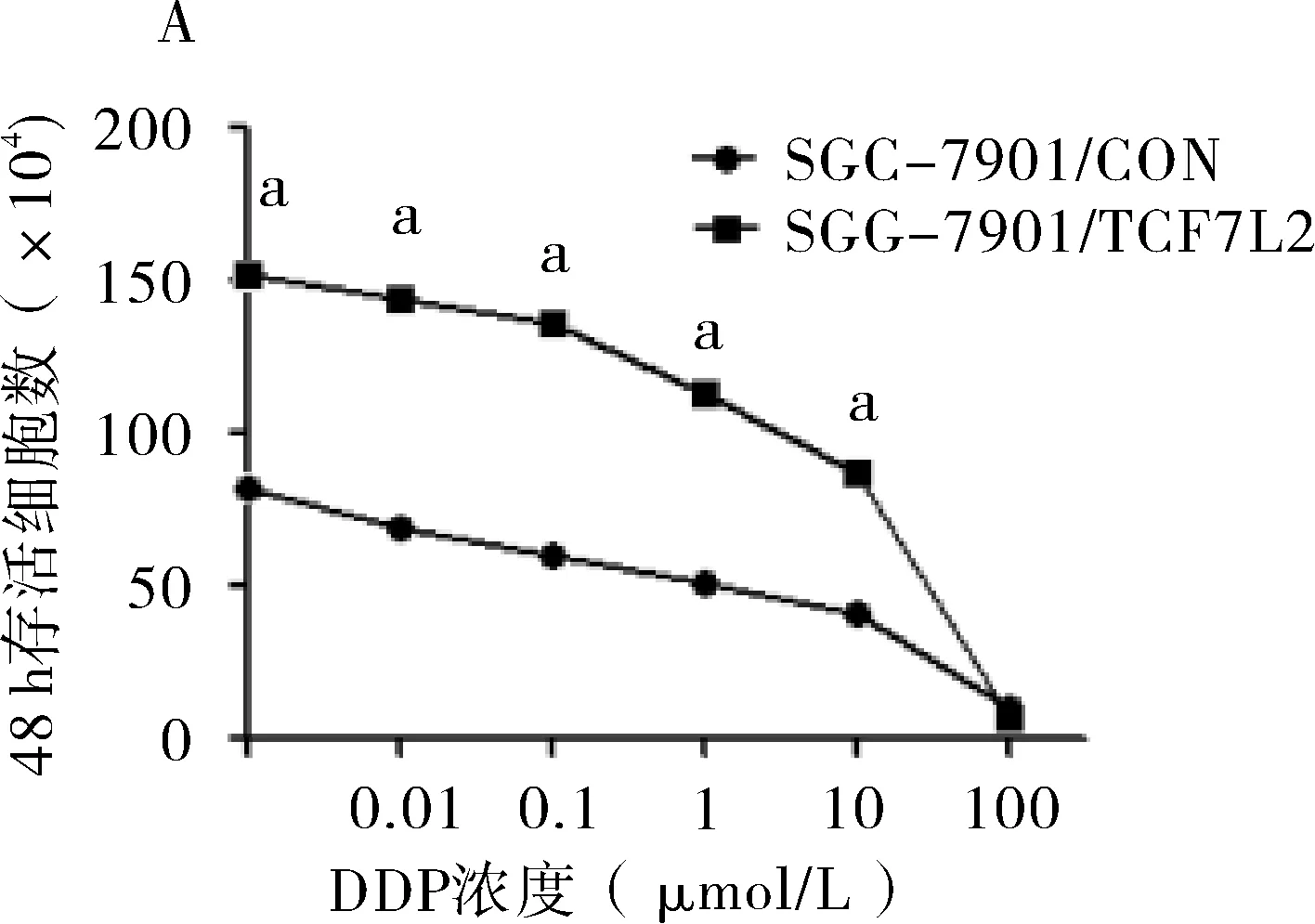
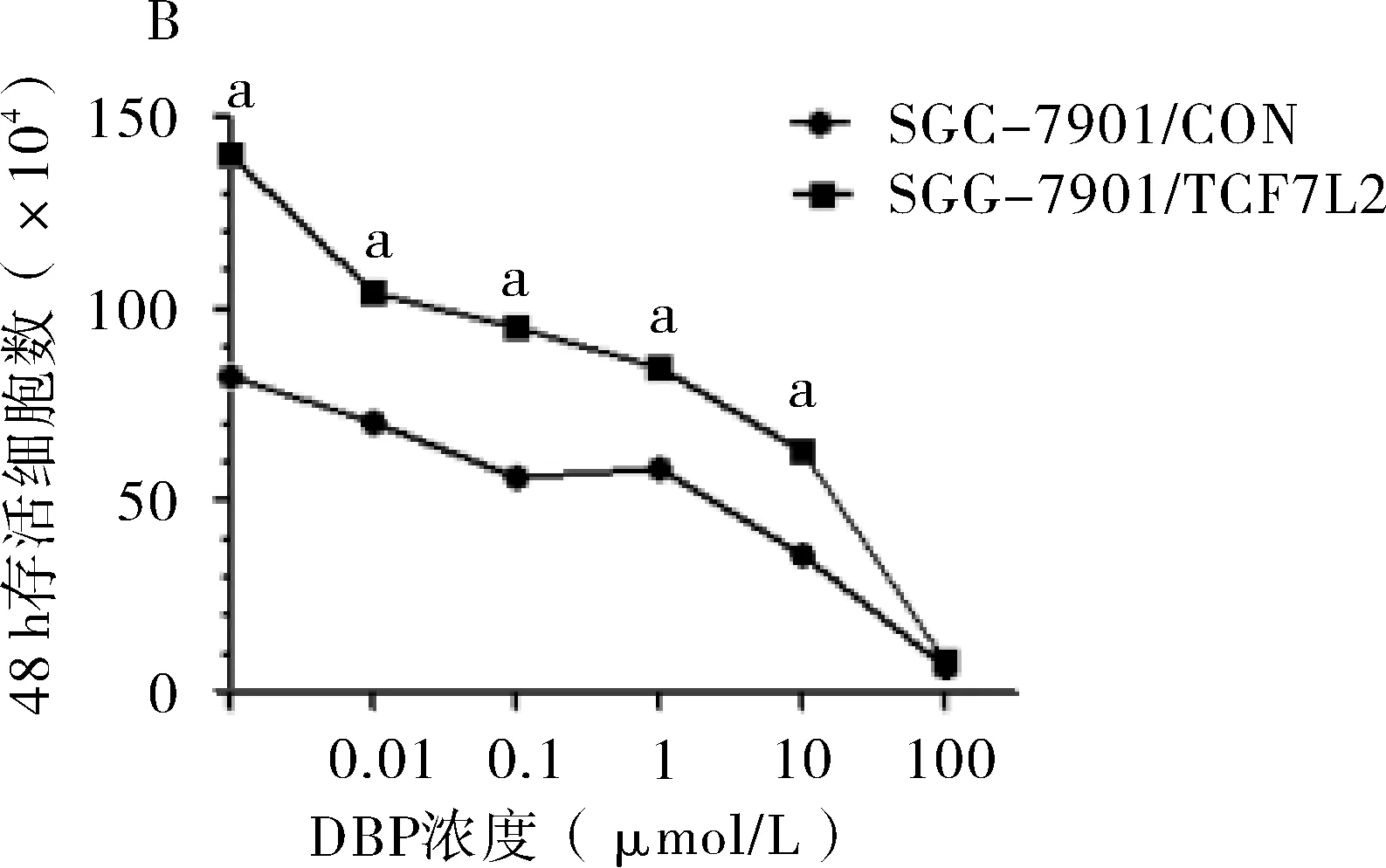
A:细胞株对顺铂耐药实验;B:细胞株对卡铂耐药实验;与SGC-7901/CON比较,aP<0.05
图4TCF7L2基因表达对胃癌细胞对铂类药物耐药性的影响
研究结果显示,TCF7L2基因和蛋白在同一患者胃癌组织中的表达量明显高于其胃癌旁组织中的,TCF7L2蛋白在胃癌细胞株中的表达较正常胃细胞株明显增高。选取TCF7L2表达最低的细胞株SGC-7901经过稳定转染技术获得SGC-7901/CON和SGC-7901/TCF7L2两细胞株,SGC-7901/TCF7L2细胞株的TCF7L2基因较对照组的明显上调,细胞耐药实验结果显示SGC-7901/TCF7L2细胞株对铂类的耐药性明显强于对照组细胞株。因此,TCF7L2基因在胃癌细胞株中异常高表达,TCF7L2能够增强胃癌细胞株对铂类化疗药物的耐受性。
本研究证实,TCF7L2与胃癌的发生发展有着密切的关系,它能增强胃癌细胞株对铂类化疗药物的耐受性。细胞耐药实验证实TCF7L2表达增强胃癌细胞株对铂类化疗药物的耐受性,其机制目前尚未明确。有研究[17]显示,可能与TCF7L2异常高表达促进下游肿瘤细胞干性标志物基因过表达,增强肿瘤细胞干性导致胃癌细胞株对铂类化疗药物耐受,确切机制有待进一步研究。本研究中发现TCF7L2基因的高表达将增强胃癌细胞株对铂类的耐药性这一现象,为下一步深入研究TCF7L2增强胃癌细胞株对铂类耐药性的作用机制提供了基础和方向,TCF7L2有可能成为靶向治疗的新靶点。
[1] BERT V,NICKOLAS P,VELCULESCU VE,et al.Cancer genome landscapes.[J].Science,2013,339(6127):1546-1558.
[2] WANG F,JIANG L,LI J,et al.Association between TCF7L2 polymorphisms and breast cancer susceptibility:a meta-analysis[J].Inter J Clin Exp Med,2015,8(6):9355-9361.
[3] CHONG C,FENGQI C,LIPENG B,et al.IKKβ enforces a LIN28B/TCF7L2 positive feedback loop that promotes cancer cell stemness and metastasis[J].Cancer Res,2015,75(8):1725-1735.
[4] JU X,ISHIKAWA TO,NAKA K,et al.Context-dependent activation of Wnt signaling by tumor suppressor RUNX3 in gastric cancer cells[J].Cancer Sci,2014,105(4):418-424.
[5] SHAFER SL,TOWLER D.Transcriptional regulation of SM22α by Wnt3a:Convergence with TGFβ1/Smad signaling at a novel regulatory element[J].J Mol Cell Cardiol,2009,46(5):621-635.
[6] XIN T,LI LL,LI XY,et al.SOX10,a novel HMG-box-containing tumor suppressor,inhibits growth and metastasis of digestive cancers by suppressing the Wnt/β-catenin pathway[J].Oncotarget,2014,5(21):10571-10583.
[7] GUDRUN M,SANDRA H,PETER H,et al.Wnt-dependent T-cell factor-4 controls human etravillous trophoblast motility[J].Endocrinology,2014,155(5):1908-1920.
[8] MEERA S,RENNOLL SA,RAUP-KONSAVAGE WM,et al.A dynamic exchange of TCF3 and TCF4 transcription factors controls MYC expression in colorectal cancer cells[J].Cell Cycle,2015,14(3):323-332.
[9] GUO P,PENG DX,XIONG XP,et al.Expression of microRNA-100 and its correlation with drug resistance in human ovarian cancer SKOV3/DDP cells[J].J South Med Univ,2015,35(11):1624-1627.
[10] YUAN G,REGEL I,LIAN F,et al.WNT6 is a novel target gene of caveolin-1 promoting chemoresistance to epirubicin in human gastric cancer cells[J].Oncogene,2012,32(3):375-387.
[11] QI Y,GUANGMIN Y,MENGKE Z,et al.A novel ent-kaurane diterpenoid executes antitumor function in colorectal cancer cells by inhibiting Wnt/β-catenin signaling[J].Carcinogenesis,2015,36(3):318-326.
[12] ZHOU Y,LAN J,WANG W,et al.ZNRF3 acts as a tumour suppressor by the Wnt signalling pathway in human gastric adenocarcinoma[J].J Mol Histol,2013,44(5):555-563.
[13] CHEN ZL,SHAO WJ,XU F,et al.Acute Wnt pathway activation positively regulates leptin gene expression in mature adipocytes[J].Cell Signal,2015,27(3):587-597.
[14] YU XW,XU Q,XU Y,et al.Expression of the E-cadherin/β-catenin/tcf-4 pathway in gastric diseases with relation to Helicobacter pylori infection:clinical and pathological implications[J].Asian Pac J Cancer Prev,2014,15(1):215-220.
[15] SRIVASTAVA R,ZHANG J,GO GW,et al.Impaired LRP6-TCF7L2 activity enhances smooth muscle cell plasticity and causes coronary artery disease[J].Cell Reports,2015,13(4):746-759.
[16] ZHAO CT,DENG YP,LIU L,et al.Dual regulatory switch through interactions of Tcf7l2/Tcf4 with stage-specific partners propels oligodendroglial maturation[J].Nat Commun,2016,9(7):1-15.
[17] YAMAKAWA-KARAKIDA N,SUGITA K,INUKAI T,et al.Ligand activation of peroxisome proliferator-activated receptor γ induces apoptosis of leukemia cells by down-regulating the c-myc gene expression via blockade of the Tcf-4 activity[J]. Cell Death Differ,2002,9(5):513-526.

