LncRNA RP11-79H23.3在膀胱癌细胞中的作用及其发生、发展的研究
池 虹,陈俊霞
重庆医科大学细胞生物学与遗传学教研室,重庆 400016
膀胱癌是世界上最常见的泌尿系统肿瘤之一,发病率和死亡率日益增加,已经成为全球第9大癌症和第14大死因[1]。在欧洲、北美、西亚和北非等地区的发病率最高[2]。虽然膀胱癌患者可以通过放射、手术和化疗等方法治疗,但5年生存率仍然不尽如人意,因此,揭示膀胱癌发生、发展的分子机制是十分重要的[3-4]。而众所周知,长链非编码RNA(long non-coding RNA,lncRNA)是长度大于200个核苷酸的RNA转录物,lncRNA在各种生物调节过程中起非常重要的作用,参与一系列生物过程和调控机制。由LncRNA调控的生物过程包括DNA损伤、血管生成、微小RNA沉默、侵袭、转移及程序性细胞死亡等[5]。此外,lncRNA还可以调节胚胎发育、免疫细胞发育和肿瘤发生[6-7]。目前有研究发现,lncRNA已经成为癌症研究中的参与者,许多lncRNA被报道在膀胱癌的发生、发展中发挥不可替代的作用[8]。lncRNA RP11-79H23.3是一个长度为2 994 bp的非编码单链RNA,但目前关于lncRNA RP11-79H23.3的功能研究暂未见报道,且其在膀胱癌中的作用机制研究暂也暂未见报道,通过检测lncRNA RP11-79H23.3的表达及验证其在膀胱癌EJ细胞增殖、凋亡过程中所起的调控作用,探讨lncRNA RP11-79H23.3在膀胱癌生长中的临床意义及作用机制,希望为治疗膀胱癌寻找到新的药物作用靶点。
1 材料和方法
1.1 材料
1.1.1 细胞株和组织标本
膀胱癌EJ细胞、正常人膀胱上皮细胞sv-HUC-1由重庆医科大学分子医学与肿瘤研究中心保存。该研究中膀胱癌组织和癌旁组织均来自重庆医科大学附属第一医院,待患者签署知情同意书后手术切除,立即放于液氮中,用于提取RNA进行表达量检测,临床资料和人膀胱癌癌组织标本的收集由重庆医科大学伦理委员会批准。
1.1.2 主要试剂
pIRES2-RP11-79H23.3及对应的pIRES2-EGFP(正常对照)由上海艾博思生物科技有限公司合成,引物由上海英骏生物技术有限公司合成,转染试剂LipofectamineTM2000购自美国Invitrogen公司,Transwell小室购自美国Millipore公司,Matrigel基质购自美国BD Biosciences公司,培养基RPMI-1640购自美国Gibico公司,胎牛血清(fetal bovine serum,FBS)购自重庆博美康生物科技有限公司,反转录试剂盒和SYBR Green试剂购自宝生物工程(大连)有限公司,EdU试剂盒购自广州市锐博生物科技有限公司,鬼笔环肽购自美国Progema公司,牛血清白蛋白(bovine serum albumin,BSA)、细胞计数试剂盒(cell counting kit-8,CCK-8)及Hoechst试剂购自北京鼎国昌盛生物技术有限责任公司,Tunel一步法测凋亡试剂盒购自上海碧云天生物技术有限公司。
1.2 实验方法
1.2.1 芯片筛选
通过收集4对膀胱癌组织及癌旁组织,提取RNA,在上海康成生物工程有限公司进行Arraystar lncRNA芯片及数据分析后,通过检测结果筛选出膀胱癌和癌旁组织中差异表达的lncRNA,表达谱结果显示,在膀胱癌组织(n=4)中检测到总共6 137个差异表达的lncRNA(3 217个上调和2 920个下调),并使用微阵列对包括lncRNA RP11-79H23.3在内具有明显差异表达的lncRNA进行了聚类分析。
1.2.2 实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQ-PCR)检测lncRNA RP11-79H23.3的表达
用TRIzol法提取膀胱癌组织、癌旁组织总RNA,反转录成cDNA,RP11-79H23.3的上游引物序列为TGGCCTCAGTTAGGACTGCT,下游引物序列为CTGCTTCCGCTCTCTTTCTC,以cDNA为模版,GAPDH为内参。RTFQ-PCR扩增条件为95 ℃、3 min预变性后,95 ℃、5 s变性,60 ℃、30 s退火和72 ℃、30 s延伸(共39个循环),每个样品设置3个复孔,RP11-79H23.3的表达量由2-△△Ct值表示。
1.2.3 CCK8、EDU检测细胞增殖
在96孔板中接种100 μL的细胞悬液,在培养箱内温育24、48、72和96 h后向每孔加入10 μL CCK8溶液混匀,将细胞放置在37 ℃下培养2 h,用酶标仪测定在450 nm处的吸光度(D)值,每组设置3个复孔。根据Cell-Light TM EdU DNA细胞增殖试剂盒进行EdU分析来检测细胞增殖。
1.2.4 细胞骨架
将转染pIRES2-EGFP及pIRES2-RP11-79H23.3的EJ细胞培养48 h后,用PBS洗3次,每次5 min,4%多聚甲醛固定细胞30 min,然后用PBS洗3次,每次5 min,0.5%Triton X-100在冰上透膜5 min。用3%BSA在37 ℃下封闭30 min。之后细胞在桩蛋白抗体(3%BSA 1∶ 200 稀释)中4 ℃温育过夜。PBS洗3次,每次5 min,然后用羊抗兔IgG-TRITC标记的二抗(1∶100)37 ℃避光温育1 h。再用PBS洗3次,每次5 min,每孔滴加150 μL FITC标记的鬼笔环肽到载玻片上,37 ℃避光温育40 min,PBS洗3次,每次10 min,接下来用DAPI温育10 min,PBS洗3次,每次5 min,用抗荧光淬灭剂封片,在Leica TCS-SP2激光共聚焦显微镜下观察并拍照。
1.2.5 Transwell、平板划痕检测细胞侵袭及迁移
使用BD基质胶侵袭小室进行细胞侵袭实验,用基质胶与不含血清的RPMI-1640培养基1∶8混合的稀释液包被Transwell 8 μm小室基底膜的上室面,4 ℃风干过夜,将细胞密度为2×106/mL(无血清、含0.1%BSA)的重悬细胞接种200 μL到上室中,在下室加入600 μL含10%FBS的RPMI-1640培养基。将细胞培养24 h,用牙签轻轻擦去基质胶和上室内细胞,甲醇固定15 min,0.1%结晶紫染色,光镜下随机选取4个视野观察计数,取平均值。平板划痕实验检测细胞迁移能力,将每孔2×106/mL的细胞悬液接种到6孔板中至汇合度达到90%时,用200 μL的枪头在每个处理组中划痕,更换无血清培养基培养,在0和24 h时轻轻放置于倒置显微镜下观察细胞迁移程度。
1.2.6 细胞凋亡检测
在EJ细胞中pIRES2-RP11-79H23.3和pIRES2-EGFP转染24 h后分别采用Hoechst 33342染色、Tunel一步法测凋亡试剂盒及收集细胞上机检测细胞凋亡率。
1.2.7 细胞免疫荧光检测PTEN在膀胱癌细胞中的定位
24孔板中pIRES2-RP11-79H23.3和pIRES2-EGFP转染24 h后细胞长至85%密度时,PBS洗3次,每次5 min,用4%多聚甲醛固定30 min,然后24孔板在0.5%PBS配置的TritonX-100通透5 min,PBS洗3次,每次5 min,用含3%BSA的PBS封闭30 min。在盖玻片上加入3%BSA稀释好的PTEN抗体(1∶100),在4 ℃湿盒中温育过夜,PBS洗3次,每次5 min,细胞用羊抗兔IgG-TRITC标记的二抗(1∶100)37 ℃避光温育1 h。再用PBS洗3次,每次5 min,DAPI染色10 min,用PBS洗3次,每次5 min后用抗荧光淬灭剂封片。在激光共聚焦显微镜下拍照,并分析各组细胞的荧光强度和定位情况。
1.2.8 蛋白[质]印迹法(Western blot)检测蛋白表达
向每孔加入转染pIRES2-RP11-79H23.3或pIRES2-EGFP后的约30 μg蛋白质,经过SDSPAGE后将蛋白转到PVDF膜上,在封闭液中37 ℃慢摇封闭2 h,然后一抗4 ℃温育过夜(兔抗β-actin 1∶3 000;一抗兔抗PTEN 1∶500,封闭液稀释),接下来用羊抗兔二抗37 ℃温育2 h(1∶5 000用封闭液稀释),ECL化学发光显色。
1.3 统计学处理
采用SPSS 18.0和GraphPad Prism5.0统计软件进行数据分析,计量资料的比较采用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 LncRNA RP11-79H23.3在膀胱癌中低表达
应用聚类分析图分析样品间的关系,显示部分差异表达的lncRNA(图1)。通过RTFQPCR验证膀胱癌组织、癌旁组织及正常人膀胱上皮细胞sv-HUC-1、膀胱癌EJ细胞RP11-79H23.3的表达,结果显示,RP11-79H23.3在膀胱癌组织和膀胱癌EJ细胞中表达下调(P<0.001,P<0.01,图2A),而EJ细胞转染pIRES2-RP11-79H23.3后RP11-79H23.3的表达量为4.541±0.079,相较于转染前RP11-79H23.3的表达量(0.081±0.004)显著增加(图2B)。该结果与芯片数据一致,因此,选择lncRNA RP11-79H23.3作为与膀胱癌相关性研究的对象。
2.2 过表达pIRES2-RP11-79H23.3抑制膀胱癌细胞EJ的增殖及促进细胞凋亡

图 1 芯片分析显示部分异常表达的lncRNA聚类图Fig. 1 Heat map of differentially expressed lncRNA in bladder cancer tissues (T) and adjacent non-tumor tissues (N)
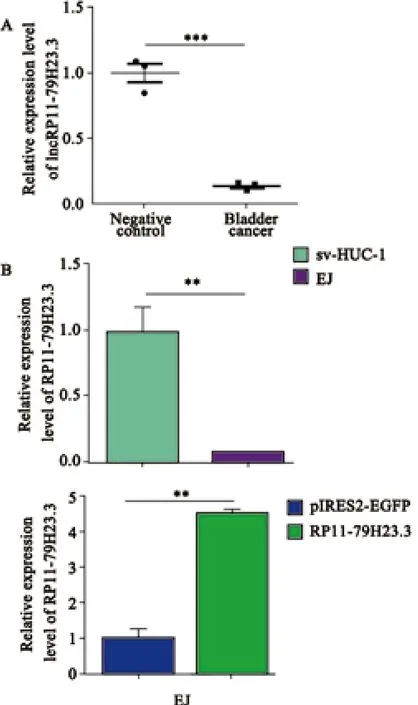
图 2 RTFQ-PCR检测lncRNA RP11-79H23.3的表达变化Fig. 2 The expression level of lncRNA RP11-79H23.3 was detected by RTFQ-PCR
用C C K 8和E D U实验来测定过表达lncRNA RP11-79H23.3后对膀胱癌EJ细胞的增殖能力的影响。EdU实验发现,pIRES2-RP11-79H23.3转染EJ细胞24h后细胞增殖率约为(28.62±5.38)%,明显低于对照组[(80.76±4.64)%,图3]。而流式细胞术检测结果显示,约23.51%的细胞在pIRES2-RP11-79H23.3组中出现凋亡,仅1.20%的细胞在对照组pIRES2-EGFP中出现凋亡(图4A),Hoechst33342染色结果相比于对照组,转染pIRES2-RP11-79H23.3组细胞出现凋亡特征,细胞核呈致密浓染,细胞核和染色质皱缩(图4B)。而Tunel检测结果表明,pIRES2-RP11-79H23.3组出现大量带有高亮荧光的凋亡细胞,而pIRES2-EGFP组有少量高亮的荧光细胞,即细胞凋亡少,进一步说明RP11-79H23.3基因的上调可以促进膀胱癌EJ细胞发生凋亡(图4C)。

图 3 EdU和CCK8实验分别检测pIRES2-EGFP、pIRES2-RP11-79H23.3转染后膀胱癌EJ细胞的增殖能力Fig. 3 The cell viability of bladder cancer EJ cells transfected with pIRES2-EGFP or pIRES2-RP11-79H23.3 detected by EdU and CCK8 experiments, respectively

图 4 流式细胞凋亡术(A)、Hoechst 33342染色法(B,×800)及Tunel实验(C,×200),检测转染pIRES2-EGFP或pIRES2-RP11-79H23.3后膀胱癌EJ细胞的凋亡情况Fig. 4 Apoptosis of EJ cells transfected with pIRES2-RP11-79H23.3 by fl ow cytometry and Annexin V-PI double staining (A), Hoechst staining assay (B, ×800) and tunel assay (C, ×200) was adopted to detect the apoptosis in RP11-79H23.3 overexpressed cells
2.3 转染pIRES2-RP11-79H23.3抑制细胞侵袭、转移及细胞骨架形成
Transwell小室实验直接检测了细胞的侵袭能力,pIRES2-RP11-79H23.3转染组细胞降解基质胶并且迁出的数量[(38.94±7.42)个]较pIRES2-EGFP转染组[(93.62±11.36)个]亦明显减少,证明过表达RP11-79H23.3后,膀胱癌细胞EJ的侵袭能力明显减弱(图5A)。平板划痕实验结果显示,转染pIRES2-RP11-79H23.3质粒的EJ细胞的划痕的愈合明显小于对照组。测定每组迁移距离,统计得出实验组RP11-79H23.3 EJ细胞的迁移距离为(194.23±18.36) μm,而对照组的迁移距离为(892.46±43.84) μm,RP11-79H23.3 EJ细胞的迁移能力显著低于对照组细胞,提示转染pIRES2-RP11-79H23.3质粒的细胞的运动能力降低(图5B)。细胞骨架实验检测显示,上调RP11-79H23.3明显抑制了桩蛋白的表达,而对照组pIRES2-EGFP则使细胞中产生更丰富的肌动蛋白丝束和更亮的桩蛋白荧光信号(图6)。

图 5 Transwell小室实验(A,结晶紫染色,×40)、细胞平板划痕法(B,×10)分别检测转染pIRES2-EGFP或RP11-79H23.3后膀胱癌EJ细胞的侵袭和迁移能力Fig. 5 The invasion and migration of EJ cells transfected with pIRES2-EGFP or RP11-79H23.3 were detected by wound healing assay (A,crystal violet staining, ×40) and Transwell assay (B, ×10), respectively

图 6 鬼笔环肽FITC荧光染色法检测细胞骨架Fig. 6 Phalloidine FITC staining of RP11-79H23.3 overexpressed cells
2.4 过表达pIRES2-RP11-79H23.3增加PTEN表达量
细胞免疫荧光实验结果显示,转染pIRES2-RP11-79H23.3实验组细胞比对照组细胞的PTEN表达高,而与体外pIRES2-EGFP对照组相比,在pIRES2-RP11-79H23.3细胞组中观察到较强的PTEN荧光信号(图7)。
2.5 LncRNA RP11-79H23.3通过靶向PTEN调控PI3K信号通路
在EJ细胞中转染pIRES2-RP11-79H23.3和pIRES2-EGFP后用Western blot验证了PTEN蛋白的表达量受到RP11-79H23.3的负调控,同时PTEN也是PI3K信号通路的负调节物,过表达RP11-79H23.3后PTEN表达增加,同时也减少了p-pI3k、p-Gsk3β及p-AKT等通路蛋白的表达量(图8)。

图 7 细胞免疫荧光检测EJ细胞转染RP11-79H23.3后PTEN表达情况Fig. 7 Immunof l uorescent assays were used to detect the expression of PTEN in EJ cells transfected with pIRES2-RP11-79H23.3

图 8 应用Western blot检测过表达RP11-79H23.3后EJ细胞中PI3K/AKT信号通路中相关蛋白的表达Fig. 8 Western blot analysis of PI3K/AKT signals-related protein in EJ cells transfected with pIRES2-EGFP or pIRES2-RP11-79H23.3
3 讨 论
膀胱癌在人类最常见的恶性肿瘤中占据着重要的位置,也是最常见的泌尿系统肿瘤之一[9]。据调查,近年来,膀胱癌的发病率呈现逐年上升的趋势,情况堪忧,在中国,膀胱癌位列男性最常见的恶性肿瘤第7位,因其预后差导致患者5年存活率明显降低[10-11]。有研究证实,lncRNA在一些生物学事件中充当信号标志的角色,在某些生理或病理条件下表现出特殊的表达模式[12]。有研究报道,许多lncRNA参与不同类型的癌症发生[13],如胃癌、肝癌、乳腺癌及膀胱癌等,参与大量恶性肿瘤和几乎所有的肿瘤发生阶段,因此,lncRNA的发现为研究膀胱癌的诊断和治疗提供新的途径。我们结合lncRNA芯片组学分析和RTFQ-PCR检测,提示lncRNA-RP11-79H23.3在膀胱癌组织和膀胱癌EJ细胞中表达下调,体外实验进一步证实,当过表达RP11-79H23.3后,EJ细胞的增殖、侵袭迁移及细胞骨架形成能力明显受到抑制,同时伴有细胞凋亡率显著增加的现象,而当转染pIRES2-EGFP后膀胱癌细胞凋亡减弱,细胞运动能力增强。通过Western blot进一步证明,RP11-79H23.3可以在膀胱癌细胞中靶向调节PTEN的表达量从而激活PTEN/PI3K/Akt信号通路。
根据目前对于lncRNA的研究来看,从肿瘤细胞或循环系统分离的lncRNA易于获得,更能容易地检测出癌症和癌症亚型[14]。LncRNA似乎参与癌症发展的所有阶段,包括肿瘤发生、发展和转移,并且lncRNA的失调是某些癌症的主要特征[15],因此,随着越来越多的lncRNA的功能被验证,大量的证据表明,失调或突变的lncRNA在各种神经变性、心血管疾病、代谢疾病和各种器官癌症的病因学及预后中起重要作用。lncRNA与肿瘤发生、临床分期、转移及预后密切相关,表明lncRNA具有成为膀胱癌诊断的靶向肿瘤标志物的前景。因此,本研究中的lncRNA RP11-79H23.3作为在膀胱癌中低表达的lncRNA,有望成为膀胱癌转移、侵袭发生的新药物作用靶点,为之后的临床和药物研究奠定一定的理论基础。
[1] MAHDAVIFAR N, GHONCHEH M, PAKAAD R, et al.Epidemiology, incidence and mortality of bladder cancer and their relationship with the development index in the world,2015[J]. Asian Pac J Cancer Prev, 2016, 17(1): 381-386.
[2] TORRE L A, BRAY F, SIEGEL R L, et al. Global cancer statistics, 2012[J]. CA Cancer Clin, 2015, 65(2): 87-108.
[3] CHEN H, LIN Y W, MAO Y Q, et al. MicroRNA-449a acts as a tumor suppressor in human bladder cancer through the regulation of pocket proteins[J]. Cancer Lett, 2012, 320(1):40-47.
[4] HIRATA H, HINODA Y, UENO K, et al. MicroRNA-1826 targets VEGFC, beta-catenin (CTNNB1) and MEK1(MAP2K1) in human bladder cancer[J]. Carcinogenesis,2012, 33(1): 41-48.
[5] YANG Z, LI X, Y Y, et al. Long noncoding RNAs in the progression, metastasis, and prognosis of osteosarcoma[J].Cell Death Dis, 2016, 7(9): e2389.
[6] GENG H, TAN X D. Functional diversity of long non-coding RNAs in immune regulation[J]. Genes Dis, 2016, 3(1): 72-81.
[7] BOUCKENHEIMER J, ASSOU S, RIQUIER S, et al. Long non-coding RNAs in human early embryonic development and their potential in ART[J]. Hum Reprod Update, 2016,23(1): 19-40.
[8] 郑文雯, 张淑芳. 长链非编码RNA在膀胱癌中的进展[J]. 现代肿瘤医学, 2015, 23(24): 3685-3689.
[9] ABDOLLAH F, GANDAGLIA G, THURET R, et al.Incidence, survival and mortality rates of stage-specific bladder cancer in United States: a trend analysis[J]. Cancer Epidemiol, 2013, 37(3): 219-225.
[10] CHEN W, ZHENG R, ZENG H, et al. Annual report on status of cancer in China, 2011[J]. Chin J Cancer Res, 2015,27(1): 2-12.
[11] HUARTE M, GUTTMAN M, FELDSER D, et al. A large intergenic noncoding RNA induced by p53 mediates global gene repression in the p53 response[J]. Cell, 2010, 142(3):409-419.
[12] CAO W J, WU H L, HE B S, et al. Analysis of long noncoding RNA expression profiles in gastric cancer[J]. World J Gastroenterol, 2013, 19(23): 3658-3664.
[13] MALEK E, JAGANNATHAN S, DRISCOLL J J. Correlation of long non-coding RNA expression with metastasis, drug resistance and clinical outcome in cancer[J]. Oncotarget,2014, 5(18): 8027-8038.
[14] WAPINSKI O, CHANG H Y. Long noncoding RNAs and human disease[J]. Trends Cell Biol, 2011, 21(6): 354-361.
[15] WANG Y, XUE D, LI Y. et al. The long noncoding RNA MALAT-1 is a novel biomarker in various cancers: a metaanalysis based on the GEO database and literature[J]. J Cancer, 2016, 7(8): 991-1001.

