萝卜籽粕蛋白质的组成及功能性质
赵功玲,梁新红,郭延成,孔 瑾*,李柯柯,康超娣,时翠萍
萝卜为十字花科植物,在中国已有2 700多年的栽培历史,是我国城乡居民的大众化蔬菜,其成熟的种子——萝卜籽又名莱菔子、萝白子、菜头子等。中医认为干燥成熟的萝卜籽,具有多种药理功效,可调节老化的皮肤,防止皱纹的产生,并且还具有祛斑和改善肤色等美容功效[1-3]。现代研究表明,萝卜籽中含有丰富的异硫氰酸盐,在异硫氰酸盐的种类中,莱菔素的含量最高,约占总异硫氰酸盐的60%以上,有很强的抗氧化活性[4-6];萝卜籽中含油量可达45%,且油脂质量优良,是生产食用油的优良原料[7-9]。和许多油料种子如大豆、油菜籽等相同,萝卜籽中蛋白质的含量也很高[10],且蛋白品质优良,有很好的应用价值及前景[11]。在我国优质植物蛋白质资源匮乏的情况下,把生产萝卜籽油的副产品——萝卜籽粕作为肥料使用,甚是可惜。
本研究拟采用碱溶酸沉法提取脱脂萝卜籽饼粕中的蛋白质,研究提取出的粗蛋白的组成、功能性质、抗氧化性能,以期揭示萝卜籽粕蛋白质的结构组成和功能特性之间的关系,为萝卜籽饼粕蛋白质的进一步开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
萝卜籽粕:亚临界萃取油脂后的残渣,经高速粉碎机粉碎,避光低温保存备用;大豆蛋白粉为市售。
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 山东西亚化学工业有限公司;对氨基苯磺酸钠、盐酸萘乙二胺、NaNO2、邻二氮菲、FeSO4、H2O2、十二烷基硫酸钠(sodium dodecyl sulfate,SDS) 北京化工厂;无水乙醇、浓硫酸、硼酸、硫酸钾、硫酸铜、氢氧化钠、盐酸 天津科密欧化学试剂有限公司。
1.2 仪器与设备
高速粉碎机 浙江武义县屹立工具有限公司;恒温磁力搅拌器 金坛市杰瑞尔电器有限公司;LGJ-10冷冻干燥机 北京松原华兴科技发展有限公司;320P-063-Star型pH计 美国奥立龙公司;T6紫外-可见分光光度计 北京普析通用仪器有限责任;TDL-5-A低速大容量离心机 北京安亭科学仪器厂;L8800氨基酸分析仪日本日立公司。
1.3 方法
1.3.1 萝卜籽粕蛋白质的制备方法
按料液比1∶50(m/V)的比例将萝卜籽粕粉与水混合,调pH值至10,60 ℃下搅拌90 min后,11 000 r/min离心6 min,取上清液调pH值至4.5,静置30 min后,11 000 r/min离心6 min,去上清液,冷冻干燥沉淀,获得干燥蛋白质粉。在此提取条件下,萝卜籽粕中蛋白质提取率可达80.2%,蛋白质纯度为89.5%。
1.3.2 萝卜籽粕蛋白组分分离方法
采用Osborne法[12-13]分离蛋白质组分。取10 g萝卜籽粕蛋白质,依次用蒸馏水、3% NaCl溶液、70%乙醇溶液和0.2% NaOH溶液分别提取清蛋白、球蛋白、醇溶蛋白和谷蛋白。
1.3.2.1 清蛋白的提取
准确快速称取一定量的萝卜籽粕蛋白质于预冷的研钵中,加少量蒸馏水和石英砂研磨成匀浆,用10 倍体积的蒸馏水分几次将匀浆液转移至三角瓶中,置于磁力搅拌器上低温搅拌提取1 h,4 ℃、11 000 r/min离心10 min,残渣用相同的方法重复提取2 次。合并上清液,调pH值至4.5,以下按1.3.1节中方法制备干燥清蛋白粉,并称质量。
1.3.2.2 球蛋白的提取
用3% NaCl溶液作溶剂,按照1.3.1节中方法,制取提取清蛋白后残渣中的球蛋白,称质量。
1.3.2.3 醇溶蛋白的提取
用70%乙醇溶液作溶剂,按照1.3.1节中方法,制取提取球蛋白后的残渣中的醇溶蛋白,称质量。
1.3.2.4 谷蛋白的提取
用0.2% NaOH溶液作溶剂,按照1.3.1节中方法,制取提取醇溶蛋白后的残渣中的谷蛋白,称质量。以提取出的4 种蛋白为总蛋白质量,分别计算谷蛋白、清蛋白、醇溶蛋白及球蛋白占萝卜籽粕蛋白质的百分比。
1.3.3 蛋白质含量的测定方法
参照GB 5009.5—2010《食品中蛋白质的测定》的方法,采用凯氏定氮法测定蛋白质的含量,蛋白质换算系数取6.25。
1.3.4 蛋白质氨基酸组成测定方法及蛋白质营养价值评价
用氨基酸自动分析仪,按照GB/T 5009.124—2003《食品中氨基酸的测定》方法测定氨基酸含量。色氨酸按照NY/T 57—1987《谷物籽粒色氨酸测定法》方法测定。
蛋白质营养价值评价:采用FAO/WHO氨基酸评分法(1973)评价[14]。
按照公式(1)计算出8 种必需氨基酸的评分(amino acid score,AAS),以最低分记为该蛋白质的AAS。

1.3.5 蛋白质的功能性质分析
[15-16],测定蛋白质的溶解性、水合能力、吸油能力、乳化性(emulsifying activity index,EAI)、乳化稳定性(emulsifying stability index,ESI)、起泡性和泡沫稳定性。
1.3.5.1 溶解性的测定
准确称取1.0 g萝卜籽粕蛋白质,加入50 mL蒸馏水,室温下搅拌40 min,使蛋白质充分溶解,然后11 000 r/min离心15 min,取上清液。凯氏定氮法测定上清液中蛋白质量。按式(2)计算蛋白质样品的溶解性。

以大豆蛋白替代萝卜籽粕蛋白质,做相同实验,加以比较。
1.3.5.2 水合能力的测定
准确称取3.0 g萝卜籽粕蛋白于100 mL的烧杯中,加入30 mL水搅拌1 h,使之充分吸水后移至50 mL的离心管中,11 000 r/min离心20 min,去上清液,称质量。按公式(3)计算水合能力。
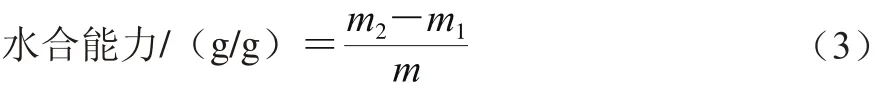
式中:m为萝卜籽粕蛋白质量/g;m1为吸水前萝卜籽粕蛋白和离心管总质量/g;m2为吸水后萝卜籽粕蛋白和离心管总质量/g。
以大豆蛋白替代萝卜籽粕蛋白质,做相同实验。
1.3.5.3 吸油能力的测定
准确称取5.0 g萝卜籽粕蛋白于已经称质量的离心管中,加入30 mL的一级大豆油,振荡2 min,置于60 ℃的水浴锅中保温30 min,使之充分吸油,11 000 r/min离心20 min后,将离心管上层的油全部除去,称质量。按式(4)计算蛋白质样品的吸油能力。

式中:m为萝卜籽粕蛋白质量/g;m1为吸油前萝卜籽粕蛋白质和离心管总质量/g;m2为吸油后萝卜籽粕蛋白质和离心管质量/g。
以大豆蛋白替代萝卜籽粕蛋白,做相同实验。
1.3.5.4 EAI与ESI的测定
取2 g的萝卜籽粕蛋白溶于40 mL 0.05 mol/L pH 7.0的磷酸盐缓冲液中,然后与40 mL一级大豆油混合,在10 000 r/min搅拌机中搅拌3 min,形成均一的乳化液后,立即用移液管从底部取1.0 mL该乳化液,加入20 mL 0.1%的SDS溶液,快速摇匀后在500 nm波长处测定吸光度,记为A0(以SDS溶液为空白),将乳化液静置30 min后,从底部取1.0 mL,同样稀释、比色,记录吸光度A30。按式(5)、(6)计算蛋白样品的EAI及ESI。

式中:m为萝卜籽粕蛋白质量/mg;φ为油相所占的体积分数(5.66%)。
以大豆蛋白替代萝卜籽粕蛋白质,做相同实验。
1.3.5.5 起泡性和泡沫稳定性的测定
准确称取1.0 g萝卜籽粕蛋白,溶于100 mL蒸馏水中,调pH值至7.0,然后在8 000 r/min搅拌机中均质2 min,快速倒入500 mL量筒中,在室温下记录泡沫总体积V0/mL,静置30 min后记录泡沫总体积V30/mL。然后按式(7)、(8)计算萝卜籽粕蛋白的起泡性和泡沫稳定性。

以大豆蛋白替代萝卜籽粕蛋白,做相同实验。
1.3.6 萝卜籽粕蛋白体外抗氧化活性测定
1.3.6.1 萝卜籽粕蛋白质清除DPPH自由基活性测定
取不同含量的萝卜籽粕蛋白质溶液3.0 mL于试管中,分别加入0.6 mL的0.4 mmol/L DPPH溶液,再加6.0 mL蒸馏水。混匀反应体系,置于黑暗中反应30 min,于517 nm波长处测定吸光度A1;将不同含量的萝卜籽粕蛋白质溶液与无水乙醇等体积混合于试管中,摇匀,于黑暗处反应30 min,于517 nm波长处测定吸光度A2;再将DPPH与蒸馏水等体积混合,测517 nm波长处的吸光度A0;以蒸馏水和无水乙醇的等体积混合溶液作空白用于仪器调零,每个实验做3 次平行实验,按式(9)计算萝卜籽粕蛋白质对DPPH自由基的清除率。

在反应体系中依次加入1 mL 0.2%亚硝酸钠标准使用液,加入蛋白质液1 mL,置于37 ℃水浴锅中10 min后取出,分别加入2 mL 0.4%对氨基苯磺酸溶液,充分混匀后,反应3 min,再加入1 mL 0.2%盐酸萘乙二胺溶液,反应15 min后,在538 nm波长处测定溶液的吸光度A1;同时做空白实验,测定吸光度A0;每个实验做3 次平行实验,按式(10)计算萝卜籽粕蛋白质对NO2-的清除率。

1.3.6.3 萝卜籽粕蛋白质清除H2O2活性测定
取不同浓度蛋白溶液2.0 mL于试管中,分别加入4.8 mL磷酸盐缓冲液(0.1 mol/L,pH 7.4)和1.2 mL 40 mmol/L H2O2溶液,混匀,于室温下放置10 min,230 nm波长处吸光度A1。以蒸馏水替代样品做相同实验,吸光度A0。以蒸馏水替代H2O2和样品做相同实验,吸光度A2。每个实验做3 次平行实验。按式(11)计算萝卜籽粕蛋白质对H2O2的清除率。

1.3.6.4 萝卜籽粕蛋白质清除·OH活性测定
在反应体系中依次加入1 mL 0.75 mmol/L的邻二氮菲溶液,1.5 mL 150 mmol/L(pH 7.5)的磷酸盐缓冲液,充分混匀后,再加入1 mL 0.75 mmol/L硫酸亚铁溶液,立即摇匀,再向反应体系中加入不同浓度的蛋白质溶液1 mL,均匀后,加入1 mL 0.01%的H2O2溶液,混匀后37℃反应30 min,于536 nm波长处测吸光度A2。以等体积蒸馏水代替蛋白质样品做相同实验,测定吸光度A1。以等体积蒸馏水代替蛋白质和H2O2溶液做相同实验,测定吸光度A0。重复上述实验3 次,按公式(12)计算萝卜籽粕蛋白质对·OH的清除率。
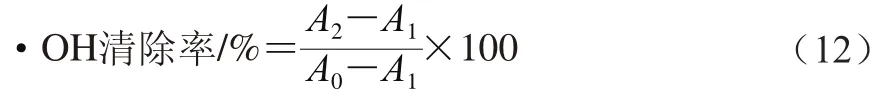
1.4 数据分析
2 结果与分析
2.1 萝卜籽粕蛋白组分组成
萝卜籽粕蛋白主要以球蛋白、谷蛋白和清蛋白为主,分别占总蛋白质量的44%、33%、21%,醇溶蛋白含量很少,只占总蛋白质的2%。Ikeda等[20]研究认为,球蛋白、谷蛋白对胃蛋白酶和胰蛋白酶敏感,属易消化蛋白,萝卜籽粕蛋白中的球蛋白和谷蛋白占总蛋白质量的77%,预示萝卜籽粕蛋白易被人体消化吸收。醇溶蛋白和谷蛋白是构成面筋蛋白的主要成分,它们在萝卜籽粕蛋白中的比例只有35%,在一定程度上会制约萝卜籽粕蛋白的食品加工特性。
2.2 萝卜籽粕蛋白氨基酸组成及营养价值评价

表1 萝卜籽粕蛋白的氨基酸组成及含量Table 1 Amino acid composition of radish seed meal protein isolate
从表1可以看出,萝卜籽粕蛋白含18 种氨基酸。功能性氨基酸中的谷氨酸含量最高,为157 mg/g,其次是精氨酸、天冬氨酸和亮氨酸,分别为70、62、61 mg/g,再次是赖氨酸、甘氨酸、脯氨酸,分别为49、49、47 mg/g。必需氨基酸含量(342 mg/g)占氨基酸总量(798 mg/g)的43%,必需氨基酸与非必需氨基酸含量的比值为0.75,接近或超过FAO/ WHO建议的40%和0.6[14]。亲水性氨基酸总量为518 mg/g,远大于疏水基氨基酸总量(280 mg/g),有利于在食品工业中应用。根据文献[21-22],天冬氨酸和谷氨酸都有较强的抗氧化能力,另一些氨基酸,如脯氨酸、精氨酸等也具有一定的抗氧化能力,而在萝卜籽粕蛋白中,这些氨基酸的含量很高,预示萝卜籽粕蛋白可能具有很好的抗氧化能力。
以FAO/WHO模式为参考,根据公式(1)及表1计算出的萝卜籽粕蛋白的AAS值见表2。与大豆蛋白相似,萝卜籽粕蛋白中的第一限制氨基酸为蛋氨酸,其AAS值为57,而大豆蛋白为51。对于一种蛋白质来说,若仅从化学的角度评价其营养价值,一般AAS值越高,说明其营养价值越高,可以认为萝卜籽粕蛋白的营养价值稍高于大豆蛋白。还可以看出,除蛋氨酸外,萝卜籽粕蛋白中的其他AAS值都在80~90之间,说明了氨基酸之间的配比较平衡,有利于人体利用。而大豆蛋白的其他AAS值在75~120之间,较萝卜籽粕蛋白稍显不平衡。也再一次说明,萝卜籽粕蛋白的营养价值稍高于大豆蛋白。当然,综合评价两种蛋白的营养价值需要多种指标,有望在今后的研究中完善。
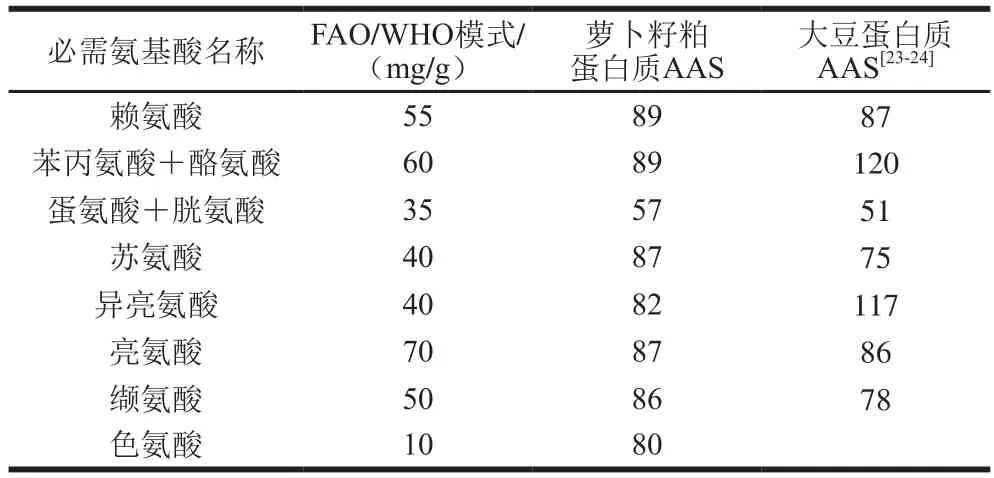
表2 萝卜籽粕蛋白质AASTable 2 AAS of radish seed meal protein isolate
2.3 蛋白质的功能性质

表3 萝卜籽粕蛋白的功能性质Table 3 Functional properties in radish seed meal protein isolate
由表3可知,萝卜籽粕蛋白的溶解性和水合能力分别为(38.55±0.38)%和(3.78±0.36)g/g,高于大豆蛋白,可能与萝卜籽粕蛋白的亲水性基团的数量较多有关。蛋白质的起泡能力和稳定性取决于其溶解性,萝卜籽粕蛋白的高溶解性,已经决定了其良好的起泡性和泡沫稳定[25-26];萝卜籽粕蛋白的起泡性为(115.00±1.97)%,泡沫稳定性为(56.00±0.46)%,均高于大豆蛋白,也验证了这一理论。
萝卜籽粕蛋白的EAI为(29.12±0.29)cm2/mg,ESI为(4.83±0.74)min,与大豆蛋白相比,萝卜籽粕蛋白的EAI及ESI都较大豆蛋白好,在食品工业的应用中,萝卜籽粕蛋白应具有更高的价值[27]。萝卜籽粕蛋白的吸油能力为(1.84±0.11)g/g,稍低于大豆蛋白。
2.4 萝卜籽粕蛋白质的抗氧化能力
由图1可知,萝卜籽粕粗蛋白及其4 种蛋白组分对DPPH自由基、•OH、NO2-、H2O2都有一定的清除能力,且随蛋白质含量的升高,清除率也随之上升。其中,对DPPH自由基的清除能力按强弱排序依次为清蛋白>粗蛋白、醇溶蛋白>球蛋白>谷蛋白;对·OH、NO2-、H2O2的清除率按强弱排序依次为谷蛋白>粗蛋白>球蛋白>清蛋白>醇溶蛋白。

图1 萝卜籽粕蛋白对DPPH自由基(A)、•OH(B)、(C)、H2O2(D)的清除率Fig. 1 Scavenging effects of radish seed protein isolate on DPPH free radicals (A), ·OH (B), (C), H2O2 (D)
由图1A可知,在蛋白质含量为0.14 mg/g时,清蛋白对DPPH自由基的清除率可达(77.2±1.7)%,粗蛋白、醇溶蛋白、球蛋白分别仅为(31.8±1.7)%、(27.4±2.0)%和(22.4±1.8)%,谷蛋白只有(6.1±1.4)%。粗蛋白清除DPPH自由基的能力差于清蛋白,与其中的谷蛋白和球蛋白占比例较大,而清除DPPH自由基的能力较差有关。由图1B可知,醇溶蛋白对•OH的清除能力远低于其他4 种蛋白,在最大蛋白质含量0.14 mg/g处,醇溶蛋白对•OH的清除率只有(46.4±2.1)%,而清蛋白为(88.5±1.8)%,球蛋白为(92.4±2.2)%,谷蛋白与粗蛋白为100%。图1C显示,清蛋白和醇溶蛋白对NO2-的清除能力相近,但远低于其他3 种蛋白,在最大蛋白质含量0.14 mg/g,清蛋白和醇溶蛋白对的清除率分别只有(35.4±1.4)%和(32.5±1.9)%,而球蛋白、粗蛋白、谷蛋白分别为(72.3±1.5)%、(80.5±1.6)%和(85.3±2.0)%。由图1D可知,在最大蛋白质含量0.14 mg/g,醇溶蛋白对H2O2的清除率远低于其他4 种蛋白,醇溶蛋白对H2O2的清除率只有(44.4±2.0)%,而清蛋白、球蛋白、粗蛋白、谷蛋白分别为(76.9±2.1)%、(83.2±1.7)%、(86.1±2.2)%和(96.4±1.6)%。
相同蛋白含量下,粗蛋白、谷蛋白、球蛋白对•OH、H2O2、、DPPH自由基的清除有相同的规律,清除率由大到小分别为•OH、H2O2、DPPH自由基;粗蛋白、谷蛋白、球蛋白对DPPH自由基的清除率远低于对•OH、H2O2、NO2-的清除率。清蛋白清除•OH、H2O2、、DPPH自由基的能力中,对•OH的清除能力最强,清除的能力最差,清除H2O2、DPPH自由基的能力相近。醇溶蛋白清除•OH、H2O2、、DPPH自由基的能力由大到小分别为H2O2、•OH、、DPPH自由基,由于在最大含量0.14 mg/g处,对H2O2的清除率只有(44.4±2.0)%,可以认为,萝卜籽粕蛋白的4 种组分中,醇溶蛋白的抗氧化能力最差。萝卜籽粕蛋白蛋比菜籽粕蛋白[28]、荞麦蛋白[29]、铁棍山药蛋白质[30]具有更好的清除DPPH自由基、•OH的能力。
3 结 论
萝卜籽粕蛋白的组成中球蛋白、谷蛋白、清蛋白和醇溶蛋白分别占总蛋白质的44%、33%、21%和2%。萝卜籽粕蛋白中含18 种氨基酸,其中谷氨酸含量最高,其次是精氨酸、天冬氨酸、亮氨酸、赖氨酸等,第一限制氨基酸为蛋氨酸,AAS评分值为57;必需氨基酸的构成比及AAS评分都优于大豆蛋白。与大豆蛋白相比,萝卜籽粕蛋白具有很好的溶解性、水合能力、起泡性、泡沫稳、EAI和ESI,吸油能力稍差于大豆蛋白。萝卜籽粕蛋白质及其四组分对DPPH自由基、•OH、及H2O2都具有清除能力。粗蛋白、谷蛋白、球蛋白对•OH、及H2O2有很好的清除能力。清蛋白对•OH、H2O2、DPPH自由基有较好的清除能力。4 种蛋白质中,醇溶蛋白的抗氧化能力最差。如今,人们应用较多的优质植物蛋白源只有大豆蛋白,显得很单一。由于萝卜籽粕蛋白营养价值高,并且有很好的功能性质及一定的抗氧化能力,因此萝卜籽粕蛋白具有很高的开发价值。
参考文献:
[1] 国家药典委员会. 中华人民共和国药典(一部)[M]. 北京: 化学化工出版社, 2005: 192.
[2] 宋哲娥. 莱菔子的药性与临床应用[J]. 山西中医, 2007, 23(3): 22-24.DOI:10.3969/j.issn.1000-7156.2007.03.041.
[3] 王春丽, 张雪清, 张贵生. 萝卜的研究价值及开发应用前景[J]. 长江蔬菜, 2011(10): 11-14. DOI:10.3865/j.issn.1001-3547.2011.10.003.
[4] 吴元锋, 毛建卫, 袁海娜, 等. 气质联用分析芸苔属种子水解液中的异硫氰酸盐[J]. 分析试验室, 2008, 27(9): 53-56. DOI:10.3969/j.issn.1000-0720.2008.09.014.
[5] SHISHU, KAUR I P. Inhibition of cooked food-induced mutagenesis by dietary constituents: comparison of two natural isothiocyanates[J]. Food Chemistry, 2009, 112: 977-981. DOI:10.1016/j.foodchem.2008.07.019.
[6] KUANG P, SONG D, YUAN Q, et al. Separation and purification of sulforaphene from radish seeds using macroporous resin and preparative high-performance liquid chromatography[J]. Food Chemistry, 2013, 136: 342-347. DOI:10.1016/j.foodchem.2012.08.082.
[7] ZHANG J, ZHOU X, FU M. Integrated utilization of red radish seeds for the efficient production of seed oil and sulforaphene[J]. Food Chemistry, 2016, 192: 541-547. DOI:10.1016/j.foodchem.2015.07.051.
[8] 余跃东, 郁建平. 萝卜籽油成分研究[J]. 食品科学, 2005, 26(8): 331-333.
[9] 李燕杰, 陈月坤, 乔路, 等. 不同产地白萝卜籽油的理化性质及脂肪酸组成分析[J]. 中国油脂, 2014, 39(4): 100-101.
[10] 朱涵彬, 齐玉堂, 张维农, 等. 萝卜籽及油的活性成分分析[J]. 农业机械, 2012(18): 39-41.
[11] FRANKY R G T, GODERIS I J, VAN LEUVEN F, et al. In vitro antifungal activity of a radish (Raphanus sativus L.) seed protein homologous to nonspeciベc lipid transfer proteins[J]. Plant Physiology,1992, 100(2): 1055-1058.
[12] PEARCE K N, KINSELLA J E. Emulsifying properties of proteins:evaluation of a turbidimetric technique[J]. Journal of Agricultural and Food Chemistry, 1978, 26(3): 716-723.
[13] 张涛. 汉麻籽分离蛋白的制备工艺、功能性质及应用研究[D]. 无锡: 江南大学, 2008: 7.
[14] FAO/WHO. Special joint FAO/WHO expert committee on energy and protein requirements[R]. Geneva: WHO, 1973: 380.
[15] 盘赛昆, 朱强, 王淑军, 等. 条浒苔蛋白质的超声波辅助提取及其性质[J]. 食品科学, 2013, 34(18): 12-17. DOI:10.7506/spkx1002-6630-201318003.
[16] 王楠, 冯志彪. 两种油料蛋白制备及其功能性研究[J]. 中国油脂,2012, 37(3): 18-23. DOI:10.3969/j.issn.1003-7969.2012.03.005.
[17] AMAROWICZ R, ESTRELLA I, HERNANDEZ T, et al. Free radicalscavenging capacity, antioxidant activity, and phenolic composition of green lentil (Lens culinaris)[J]. Food Chemistry, 2010, 121: 705-711.DOI:10.1016/j.foodchem.2010.01.009.
[18] 胡翠珍, 李胜, 马绍英, 等. 响应面试验优化葡萄籽油提取工艺及其抗氧化性[J]. 食品科学, 2015, 36(20): 56-61. DOI:10.7506/spkx1002-6630-201520010.
[19] 王茂广. 沙棘籽蛋白酶解物抗氧化作用初探[J]. 中国粮油学报,2014, 29(4): 42-45.
[20] IKEDA K, SAKAGUEHI T, KUSANO T, et al. Endogenous factors affecting protein digestibility in buckwheat[J]. Cereal Chemistry,1991, 68(4): 424-427.
[21] SAIGA A, TANABE S, NISHIMURA T. Antioxidant activity of peptides obtained from porcine myofibrillar proteins by protease treatment[J]. Journal of Agricultural and Food Chemistry, 2003,51(12): 3661-3667. DOI:10.1021/jf021156g.
[22] CHEN H M, MURAMOTO K, YAMAUCHI F, et al. Antioxidant activity of designed peptides based on the antioxidative peptide isolated from digests of a soybean protein[J]. Journal of Agricultural and Food Chemistry, 1996, 44(9): 2619-2623. DOI:S0021-8561(95)00833-8.
[23] 王旻, 梁玉, 王欣欣, 等. 即墨野生大豆主要成分及其营养价值分析[J].大豆科学, 2013, 32(3): 355-360. DOI:10.11861/j.issn.1000-9841.2013.03.0355.
[24] 蒋涛, 杨文钰, 刘卫国, 等. 套作大豆贮藏蛋白、氨基酸组成分析及营养评价[J]. 食品科学, 2012, 33(21): 275-279.
[25] 王艳玲. 米糠中四种蛋白的提取工艺及特性研究[D]. 哈尔滨: 东北农业大学, 2013: 7.
[26] 郭兴峰, 陈计峦, 林燕, 等. 热榨和冷榨核桃饼粕中蛋白质提取及其性质研究[J]. 农业工程学报, 2012, 28(18): 287-291. DOI:10.3969/j.issn.1002-6819.2012.18.041.
[27] 崔淼, 唐年初, 陈聪颖, 等. 沙棘籽粕蛋白的功能性质研究[J]. 中国油脂, 2012, 37(4): 52-56. DOI:10.3969/j.issn.1003-7969.2012.04.013.
[28] 胡振瀛, 史卿, 熊华, 等. 富硒菜籽粕蛋白与普通菜籽粕蛋白功能性质的比较[J]. 食品工业科技, 2014, 35(14): 157-160; 165.DOI:10.13386/j.issn1002-0306.2014.14.026.
[29] 张美莉, 赵广华, 胡小松. 荞麦蛋白和类黄酮提取物清除自由基的ESR研究[J]. 营养学报, 2005, 27(1): 21-24. DOI:10.3321/j.issn:0512-7955.2005.01.006.
[30] 周晓薇, 王静, 段浩, 等. 铁棍山药蛋白质的分离纯化及体外抗氧化活性[J]. 食品科学, 2011, 32(9): 31-35.

