关节置换术后发生急性肾损伤的危险因素分析
张虹 张宇 苏震
近年来,关节置换术在我国普及迅速,年手术量呈逐年增长趋势。大部分关节置换患者是老年人,伴有活动受限,同时多伴有其他基础疾病如高血压、糖尿病等,此类患者术后易发生急性肾损伤(AKI)。文献报道,患者关节置换术后AKI发生率<2%[1-3],但也有学者通过病例回顾分析发现关节置换术后AKI发生率高达14.8%[4]。明确关节置换术后发生AKI的危险因素,有利于指导临床作好对AKI高危患者的预防措施,减少围术期的并发症、降低病死率。本研究通过回顾行髋或膝关节置换术患者的临床资料,分析关节置换术后发生AKI的危险因素,现报道如下。
1 对象和方法
1.1 对象 回顾性选取2009年1月至2016年12月在温州医科大学附属第一医院(温附一)及温州医科大学附属第二医院(温附二)进行髋或膝关节置换术的患者共3 238例,其中温附一1 731例,温附二1 507例,剔除尿毒症患者及术后7d内未复查肾功能的患者。患者的临床资料从医院的病案数据库中获得,收集的资料包括:一般资料(性别、年龄、诊断、身高、体重等)、化验数据(血常规、生化、尿常规等)、围术期情况(手术日期、手术主刀医师、手术部位、手术持续时间、术中血压及有无骨水泥固定、输血等)。
1.2 分组方法 对3 238例患者进行筛选,筛选出所有术后发生AKI的患者。将所有术后发生AKI的患者(AKI组)与未发生AKI的患者(对照组)按1∶3进行配对。为减少不同医院之间、不同主刀医师之间由于医疗技术水平差异对术后发生AKI的影响,以及消除不同麻醉方式对术后AKI发生的影响,本研究配对标准要求手术医院、手术主刀医师、麻醉方式等方面相同,从数据库中找出每例术后发生AKI患者最接近的匹配对象。
1.3 AKI诊断标准 AKI诊断及分期标准参照2012年KDIGO提出的AKI临床指南[5]。符合下列情形之一者即诊断为 AKI:(1)在 48h 内血清肌酐(Scr)增加≥0.3mg/dl(≥26.5μmol/L);(2)已知或假定肾功能损害发生在 7d之内,Scr上升至>基础值的1.5倍;(3)尿量<0.5ml/(kg·h),持续6h。AKI分期标准见表1。

表1 AKI分期标准
1.4 观察及分析方法 观察关节置换术后发生AKI的患者临床情况;比较AKI组与对照组患者临床资料;多因素分析关节置换术后发生AKI的危险因素。
1.5 统计学处理 应用SPSS20.0统计软件;符合正态分布的计量资料以表示,组间比较采用两独立样本t检验;不符合正态分布的计量资料以M(P25,P75)表示,组间比较采用Mann-Whitney U检验;计数资料以频数和构成比表示,组间比较采用χ2检验或Fisher确切概率法;采用logistic回归分析关节置换术后发生AKI的危险因素;P<0.05为差异有统计学意义。
2 结果
2.1 关节置换术后发生AKI的患者临床情况 本研究患者关节置换术中术后发生AKI 71例(2.2%),其中男40 例,女 31 例;年龄 32~90(73.9±9.5)岁;合并高血压者58例,合并糖尿病者20例,合并高尿酸血症者33例,术前肾功能异常(以eGFR<60%为标准)19例、肝功能受损者(ALT男>50U/L、女>40U/L为标准)8例、冠心病者1例、贫血者(Hb男<120g/L、女<110g/L为标准)25例、严重低蛋白血症者(血浆白蛋白<30g/L)3例;AKI 1期患者61例(85.9%),AKI 2期9例(12.7%),AKI 3期1例(1.4%),该例AKI 3期的患者术后出现感染伴有全身多器官衰竭,并出现无尿等现象,患者家属拒绝透析及进一步其他治疗,自动出院后死亡。
2.2 AKI组与对照组患者临床资料比较 见表2。
由表2可见,AKI组患者与对照组在年龄、BMI、高血压、糖尿病、高尿酸血症、术前肾功能异常、术前eGFR下降、术前肝功能受损、低蛋白血症、围术期输血等方面的比较差异均有统计学意义(均P<0.05)。
2.3 关节置换术后发生AKI的危险因素多因素分析结果 将年龄、BMI、高血压、糖尿病、高尿酸血症、术前肾功能异常、术前eGFR下降、术前肝功能受损、低蛋白血症、围术期输血等因素纳入多因素分析,结果见表3。
由表3可见,高龄、高BMI、高血压、术前肾功能异常、围术期输血均是关节置换术后发生AKI的独立危险因素(均 P<0.05)。
3 讨论
AKI发生率近年呈上升趋势,不同手术类型的患者术后AKI发生率波动较大。在关节置换术方面,Jafari等[6]根据RIFLE分级来定义AKI,回顾分析了17 938例患者,发现AKI发生率为0.10%~0.55%。而本研究是参照2012年KDIGO提出的AKI指南,发现AKI发生率为2.20%。
AKI是临床常见急症之一,除引起尿素氮、肌酐和其他代谢废物的蓄积外,还可伴随代谢紊乱导致代谢性酸中毒、高钾血症、体内液体失衡以及其他脏器功能的减退。研究显示,AKI与病死率上升有关[6]。本研究有1例处于AKI 3期的患者拒绝透析等治疗,自动出院后死亡。目前临床所能采取的减少AKI所致并发症的措施仍非常有限,关键在于预防,明确关节置换术后AKI发生的危险因素意义重大。
本研究结果显示高BMI是关节置换术后发生AKI的独立危险因素,这与Kimmel等[4]研究结果一致。有文献证实,BMI升高与心脏手术、非心脏手术术后发生AKI均有关[7]。另有报道指出,肥胖患者与非肥胖患者相比,在30d的住院日内AKI发生率增加65%[8]。Kimmel等[4]发现患者BMI每增加1kg/m2,AKI的发生风险增加14%[4]。这提示临床对肥胖患者关节置换术后更需加强肾功能监测。
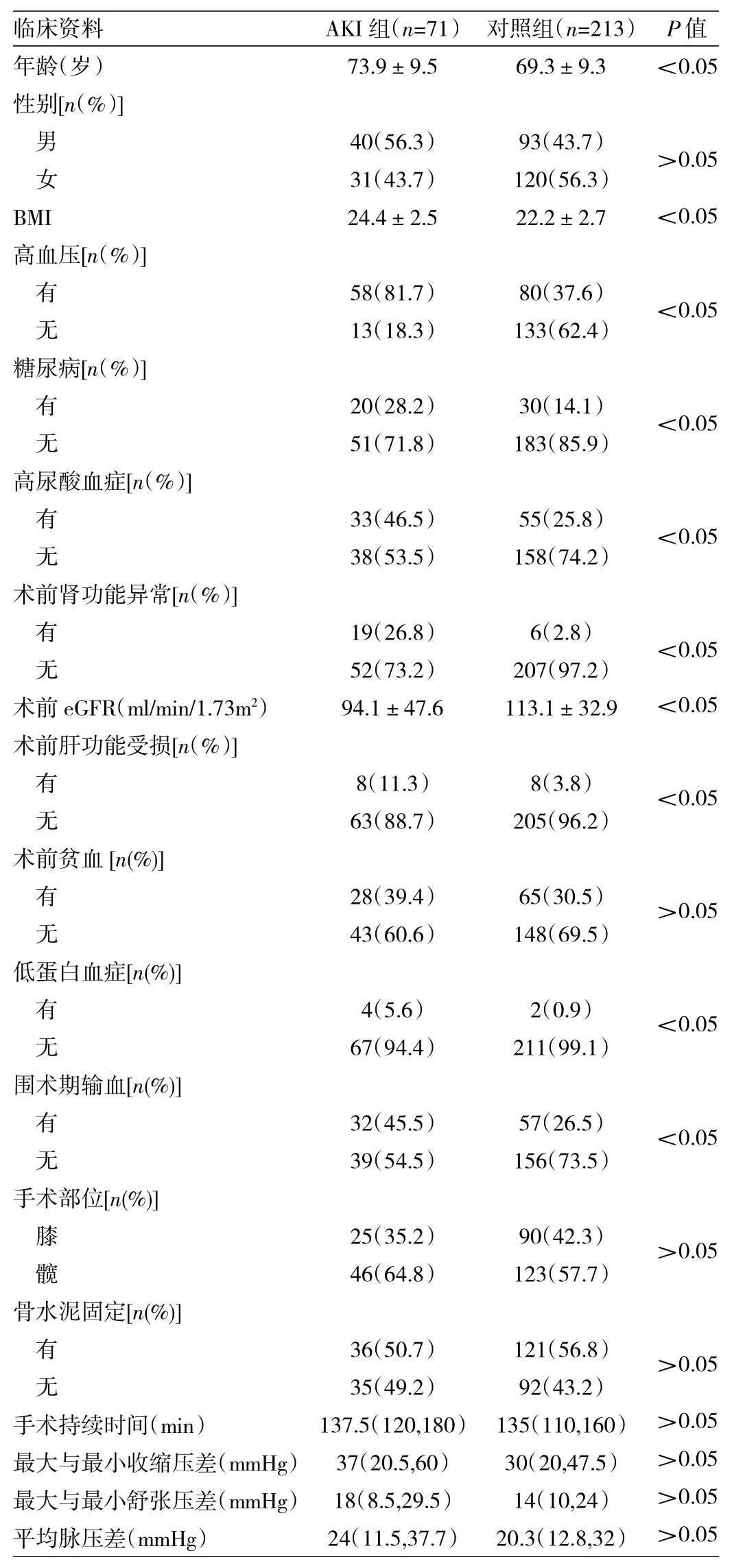
表2 AKI组与对照组患者临床资料比较
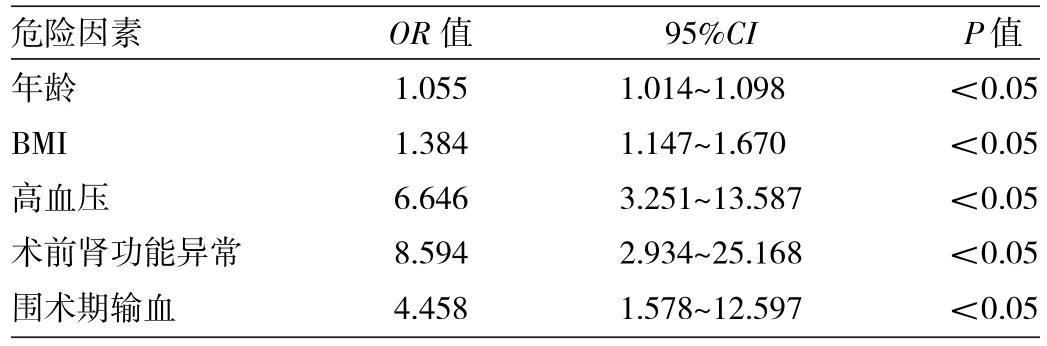
表3 关节置换术后发生AKI的危险因素多因素分析结果
Novis等[9]在对28项研究的荟萃分析发现,术前肾功能不全是术后发生肾衰竭的独立预测因子。本研究结果也显示,术前肾功能异常是关节置换术后发生AKI的独立危险因素,AKI组患者较对照组术前eGFR下降更明显。本研究还发现,AKI组患者围术期输血率比对照组高。由于骨科的很多手术记录里没有具体量化失血量,导致失血量与AKI的关系无法在本研究中进一步研究。两组患者术前贫血无统计学差异,故从围术期输血间接说明了AKI组患者在术中失血量大于对照组。当患者术前已存在肾功能异常,术中大量失血加重肾缺血,术后更容易发生AKI。
本研究发现,AKI组患者存在年龄偏大、营养不良等情况,AKI组患者年龄明显高于对照组,高龄是关节置换术后发生AKI的独立危险因素。AKI组患者低蛋白血症者比率明显高于对照组。蛋白质是机体组织细胞的基本成分,也是酶、激素、抗体等不可缺少的重要成分。低蛋白营养不良可影响机体免疫功能,导致血清补体水平、总IgG水平下降,加大术中及术后感染机会。同时蛋白质是保持体内水分和控制水分分布的决定因素。当蛋白质水平低下时,血管内的水分向组织间隙积聚,可引起血容量下降等情况。虽然本研究结果未显示低蛋白血症为AKI发生的独立危险因素,但笔者仍建议术前尽量纠正低蛋白血症,改善患者的营养状况。
本研究患者使用的骨水泥均为抗生素骨水泥(美国强生公司),单因素分析提示在两组间无统计学差异。但Jafari等[6]指出抗生素骨水泥可能是患者关节置换术后发生AKI的危险因素。抗生素骨水泥含有氨基糖苷类抗生素和/或万古霉素,均具有肾毒性。但国内使用的通常为低剂量抗生素骨水泥,即每40g骨水泥掺入≤1g抗生素,一般认为是安全的。国外使用的抗生素骨水泥其抗生素剂量明显高于国内,1例国外个案报道中使用的抗生素骨水泥为120g骨水泥混合10.8g妥布霉素和12g万古霉素[10]。McGlothan等[11]研究发现AKI患者移除高剂量抗生素骨水泥后肾功能很快恢复,因此他们考虑高剂量骨水泥是引起AKI的可能原因。笔者总结临床需对抗生素骨水泥的应用提高警惕,建议AKI高危患者尽量避免使用抗生素骨水泥,尤其是高剂量抗生素骨水泥。
血压的突然下降可能引起肾脏缺血损伤,导致肾功能下降。本研究显示,虽然术中最大与最小收缩压差、最大与最小舒张压差、平均脉压差及手术持续时间在两组间无统计学差异,但从平均值及四分位数可以看出AKI组患者比对照组有血压波动更大、手术持续时间更长的趋势。有报道指出,使用升压药、最高血压和最低血压在术中变异较高、手术时间长均增加了术后患者肾功能损害发生的风险[6]。因此,笔者认为在术前控制患者的血压平稳,术中及时补液、输血减少术中血压波动也是预防术后发生AKI的重要措施。
本研究还对高尿酸血症、贫血等方面进行了统计分析,发现高尿酸血症在AKI组与对照组患者存在统计学差异,而贫血则差异无统计学意义,但经多因素分析显示高尿酸血症不是独立危险因素。
当然,本研究存在一定的局限性。本研究AKI是基于Scr值,但Scr只有在肾小球滤过率下降到60%左右才开始升高,早期反应肾损伤的指标如血清光抑素C在骨科未行常规检查,导致早期肾损伤患者未被发现。因此,笔者认为实际的肾脏受损的发生率可能要更高,这值得临床医师注意并加强对AKI的预防。
综上所述,本研究结果显示关节置换术后AKI发生率为2.2%,高龄、高BMI、高血压、术前肾功能异常、围术期输血均是关节置换术后发生AKI的独立危险因素。鉴于术后AKI直接影响患者短期及长期生存质量,致力于前瞻性研究是必要的,有助于预测关节置换术后发生AKI的风险,从而有针对性的干预。早期反应肾损伤的指标未在临床上常规开展,导致早期肾损伤未被发现而未及时干预。本研究结果提示,临床开展术后检测早期肾损伤的指标也极为重要。
[1] Pulido L,Parvizi,Macgibeny M,et al.In hospital complications after total joint arthroplasty[J].J Arthroplasty,2008,23(Suppl 1):139-145.
[2] Belmont PJ,Goodman GP,Waterman BR,et al.Thirty-day postoperative complications and mortality following total knee arthroplasty:incidence and risk factors among a national sample of 15,321 patients[J].J Bone Joint Surg Am,2014,96(1):20-26.
[3] Weingarten TN,Gurrieri C,Jarett PD,et al.Acute kidney injury following total joint arthroplasty:retrospective analysis[J].Can J Anaesth,2012,59(12):1111-1118.
[4] Kimmel LA,Wilson S,Janardan JD,et al.Incidence of acute kidney injury following total joint arthroplasty:A retrospective review by RIFLE criteria[J].Clin Kidney J,2014,7(6):546-551.
[5] Arif Khwja.KDIGO clinical practice guidekines for acute kidney injury[J].Nephron Clin Pract,2012,120:c179-c184.
[6] Jafari SM,Huang R,Joshi A,et al.Renal impairment following total joint arthroplasty:Who is at risk?[J].J Arthroplasty,2010,25(6 suppl):49-53.
[7] Kheterpal S,Tremper KK,Englesbe MJ,et al.Predictors of postoperative acute renal failure after noncardiac surgery in patients with previously normal renal function[J].Anesthesiology,2007,107(6):892.
[8] Kelz RR,Reinke CE,Zubizarreta JR,et al.Acute kidney injury,renal function,and the elderlyobese surgical patient:a matched casecontrol study[J].Ann Surg,2013,258(2):359-363.
[9] Novis BK,Roizen MF,Aronson S,et al.Association of preoperative risk factors with postoperative acute renal failure[J].Anesth Analg,1994,78(1):143.
[10] Alexia James,Trent Larson.Acute renal failure after high-dose antibiotic bone cement:case report and review of the literature[J].Ren Fail,2015,37(6):1061-1066.
[11]McGlothan KR,Gosmanova EO.A case report of acute interstitial nephritis associated with antibiotic-impregnated orthopedic bone cement spacer[J].Tenn Med,2012,105(9):37-40.

