转谷氨酰胺酶对大豆蛋白凝胶特性及结构的影响
臧学丽,陈 光
(1 吉林农业大学 生命科学学院,吉林 长春 130118 ;2 长春医学高等专科学校,吉林 长春 130031)
大豆是我国传统的植物蛋白源食物[1],具有使用范围广、制品种类多等特点[2]。大豆中蛋白质含量较高[3],且必需氨基酸含量丰富[4]。大豆蛋白具有溶解性、凝胶性、乳化性等功能特性,添加到食品中可以提高食品的营养价值,改善食品的感官,具有降血脂、保护心血管及美容等功效[5]。但天然的大豆蛋白功能特性不突出,如形成凝胶的强度差等,难以满足食品体系对大豆蛋白的需求,需要用一定的方法改善大豆蛋白的功能特性。目前,大豆蛋白改性的方法有物理法、酶法、化学法等。其中酶法改性大豆蛋白不但可以提高大豆蛋白的功能特性,还能提高其营养价值,被认为是一种理想的改性方法,成为人们研究的热点。但目前酶法改性大豆分离蛋白的改性结果仍然不能满足工业生产需要,如曲玲等[6]对大豆分离蛋白进行复合改性,改性后的大豆分离蛋白的凝胶性能虽然得到了提高,但提高效果并不显著。酶法改性大豆蛋白过程极其复杂,大豆品质[7]及大豆蛋白凝固酶的种类[8]、作用时间[9]、作用温度、添加量和pH等,均为影响大豆制品口感[10]、品质及外观的重要因素[11],改性过程中氨基酸的组成、比例、蛋白的空间结构均会发生很大变化,如何控制酶凝固过程,使改性后大豆蛋白的功能特性满足人们的需求,是酶改性大豆蛋白的关键,但目前对该问题的研究尚显薄弱。本研究从大豆蛋白和酶两个方面进行分析,包括优质大豆的选择[12]及大豆蛋白凝固酶种类的选择[13]等,利用响应面法优化转谷氨酰胺酶凝固大豆蛋白的最佳作用时间[14]、温度、pH和酶添加量,旨在提高大豆蛋白的凝胶性,并对转谷氨酰胺酶聚合大豆蛋白结构[15]的变化进行分析,以期为大豆蛋白的分离和大豆制品的开发利用提供依据。
1 材料与方法
1.1 供试大豆品种
大豆品种吉农 34、吉农 28、吉农18、吉农 17、吉农芽豆及北豆28,由吉林农业大学生命科学学院提供。
1.2 试验用酶
碱性蛋白酶、木瓜蛋白酶、中性蛋白酶及转谷氨酰胺酶,均购于Sigama。
1.3 试验方法
1.3.1 大豆分离蛋白的制备 以6种大豆粉碎的大豆粉为原料,经石油醚脱脂制得脱脂大豆粉,然后采用碱提酸沉法[16]制备大豆分离蛋白。
1.3.2 6种大豆的蛋白质含量及凝胶强度分析 精选6种不同大豆,利用近红外谷物分析仪对大豆蛋白质、脂肪及水分含量进行分析,并用上述4种凝固酶对6种大豆分离蛋白进行凝固反应,利用SMSTA.XTPlus质构仪测定大豆蛋白的凝胶强度,分析大豆蛋白质含量对大豆分离蛋白凝胶的影响。凝胶强度为破断力与凹陷距离的乘积:凝胶强度(g·mm)=破断力×凹陷距离。
1.3.3 4种酶对大豆分离蛋白凝固能力的比较 准确称取7 g大豆分离蛋白,放入烧杯中,加入50 mL蒸馏水,充分搅拌均匀,使大豆分离蛋白达到均匀、稳定状态,在0.1 MPa、121 ℃高温下蒸煮20 min,置室温条件下冷却。将冷却后的大豆分离蛋白在40 ℃水浴1 h,然后分别加入转谷氨酰胺酶、碱性蛋白酶、中性蛋白酶、木瓜蛋白酶,酶加入后迅速搅拌,使酶与大豆分离蛋白迅速混合, 1 h 后取出,放入冰水混合物中冷却1 h,置于4 ℃冰箱保存,即得大豆蛋白凝胶,测定大豆蛋白的凝胶强度。同时以未添加酶的处理为空白对照。每组3个平行。
1.4 大豆分离蛋白凝胶强度的影响因素
1.4.1 反应时间 控制反应条件为反应温度50 ℃,酶添加量36 U/g,pH 7.0,测定反应时间为1,2,3,4和5 h时大豆蛋白的凝胶强度。
1.4.2 反应温度 控制反应条件为酶添加量36 U/g,pH 7.0,分别在30,40,50,60和70 ℃的温度条件下反应2 h,测定大豆蛋白的凝胶强度。
1.4.3 酶添加量 控制反应条件为反应温度50 ℃,pH 7.0,在转谷氨酰胺酶添加量分别为24,30,36,42和48 U/g的条件下反应2 h,测定大豆蛋白的凝胶强度。
1.4.4 pH 控制反应条件为反应温度50 ℃,酶添加量36 U/g,在pH分别为5.0,6.0,7.0,8.0和9.0的条件下反应2 h,测定大豆蛋白的凝胶强度。
1.5 高强度大豆分离蛋白凝胶制作工艺的响应面法优化
在单因素试验的基础上,选取酶添加量(X1)、反应时间(X2)、反应温度(X3)和pH(X4)作为自变量,以大豆分离蛋白的凝胶强度为因变量(Y)进行响应面(表1)分析,对大豆蛋白凝胶的最佳制作工艺条件[17]进行优化。
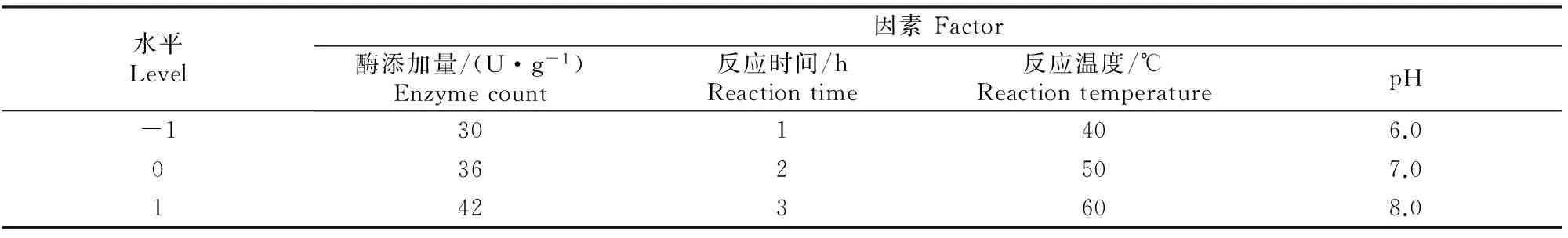
表1 高强度大豆分离蛋白凝胶制作工艺响应面优化试验的因素及水平Table 1 The factors and levels of response surface methodology on preparation of high strength soybean protein isolate gel
1.6 加入转谷氨酰胺酶前后大豆分离蛋白凝胶的扫描电镜分析
取加入转谷氨酰胺酶后制得的大豆蛋白及未加转谷氨酰胺酶的大豆蛋白样品各适量,5 000 r/min离心10 min,保留沉淀并均匀分散于体积分数4%的戊二醛中,4 ℃冰箱中过夜固定。取固定的沉淀用pH 7.4的磷酸盐缓冲液冲洗3次,用体积分数30%,50%,70%,85%,95%的乙醇溶液逐级脱水,再用体积分数100%的乙醇脱水2次,每次脱水15 min。脱水后的样品5 000 r/min离心10 min,收集沉淀,于真空冷冻干燥机中冷冻干燥,最后电镜检测。
1.7 大豆分离蛋白结构的圆二光谱分析
1.7.1 Near-UV CD光谱检测 主要用于大豆分离蛋白的三级结构分析。称取5 mg大豆分离蛋白样品,溶于5 mL pH 7.2的5 mmol/L磷酸盐缓冲液中,室温条件下搅拌25 min,8 000 r/min离心10 min,收集上清液,稀释至1 mg/mL进行CD光谱检测。圆二光谱的检测波长为250~320 nm。
1.7.2 Fear-UV CD光谱检测 主要用于大豆分离蛋白的二级结构分析。称取5 mg大豆分离蛋白样品,溶于5 mL pH 7.2的5 mmol/L磷酸盐缓冲液中,室温条件下搅拌25 min,8 000 r/min离心10 min,收集上清液,稀释至0.1 mg/mL进行CD光谱检测。圆二光谱的检测波长为190~250 nm。
2 结果与分析
2.1 6种大豆的蛋白质含量及凝胶强度
大豆分离蛋白的凝胶强度与大豆中所含的蛋白质含量密切相关。由表2可知,6种大豆的蛋白质含量均较高,其中吉农芽豆中的蛋白质含量最高,达到了383.9 g/kg。对图1和表2进行对照分析得知,大豆蛋白含量与所形成凝胶的强度呈正相关性,蛋白质含量越高,凝胶强度值越大,吉农芽豆所形成的大豆蛋白凝胶强度最强,与理论上高蛋白有利于提高大豆分离蛋白的凝胶强度相一致[18]。所以在后续试验中选择吉农芽豆作为原材料。
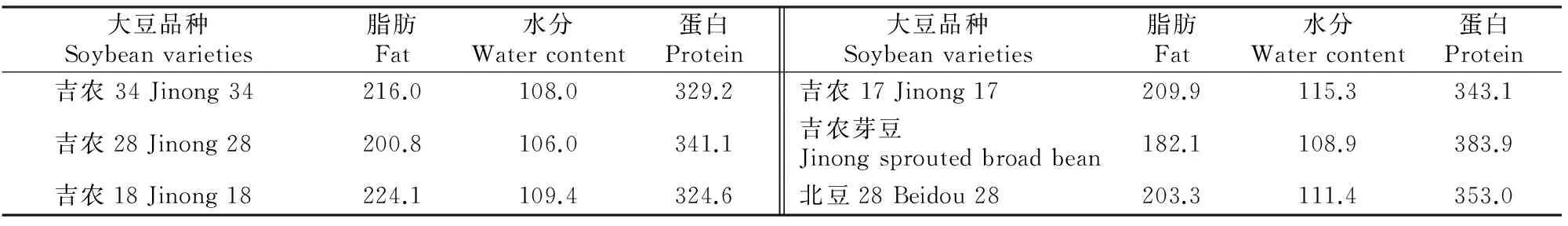
表2 6种供试大豆主要成分的含量Table 2 Main components of six selected soybeans g/kg
2.2 4种蛋白酶对大豆分离蛋白凝固能力的影响
试验观察发现,未添加蛋白酶的对照组未形成大豆蛋白凝胶。由图2可以看出,相较于对照,蛋白酶的加入使得大豆蛋白的凝胶强度得到了明显提高,但每种蛋白酶对大豆分离蛋白的凝固能力也不尽相同,其中以转谷氨酰胺酶对大豆分离蛋白凝固的影响作用最强,所以选择转谷氨酰胺酶进行后续试验。
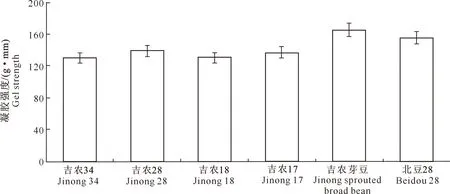
图1 6种大豆分离蛋白凝胶强度的比较Fig.1 Comparison of six soy protein isolate gel strengths

图2 不同蛋白酶对大豆分离蛋白凝胶强度的影响Fig.2 Effect of different proteases on strength of soy protein isolate gel
2.3 大豆分离蛋白凝胶强度的影响因素
2.3.1 反应时间 由图3可知,在反应时间小于2 h时,大豆蛋白的凝胶强度随着反应时间的增加不断增大,反应超过2 h后大豆蛋白的凝胶强度逐渐降低。因此确定大豆蛋白与转谷氨酰胺酶的最佳反应时间为2 h。
2.3.2 反应温度 由图4可知,在反应温度为50 ℃时,大豆蛋白的凝胶强度达到最高值。主要原因可能是在温度较低的条件下转谷氨酰胺酶的活性较低,因此大豆蛋白的凝聚程度较低;而温度过高时,大豆蛋白的催化活性有所降低[19]。所以在其他反应条件确定时,大豆蛋白与转谷氨酰胺酶的最佳反应温度为50 ℃。

图3 反应时间对大豆分离蛋白凝胶强度的影响Fig.3 Effect of reaction time on strength of soy protein isolate gel
2.3.3 酶添加量 由图5可以看出,在酶添加量为36 U/g时,大豆蛋白的凝胶强度达到最佳值。所以在其他反应条件确定时,大豆蛋白与转谷氨酰胺酶反应时酶的最佳添加量为36 U/g。
2.3.4 pH 由图6可以看出,在反应pH为7.0时,大豆蛋白的凝胶强度达到最大。原因可能是转谷氨酰胺酶的最佳催化pH为7.0,pH过高或过低都会抑制转谷氨酰胺酶的酶活[20]。
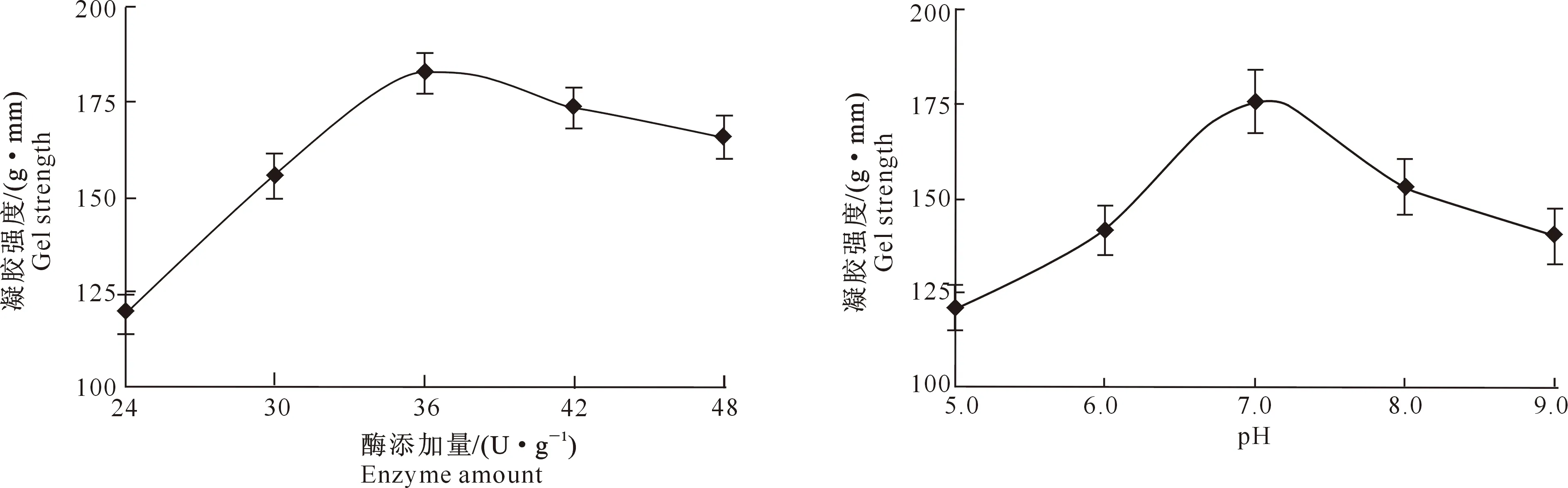
图5 酶添加量对大豆分离蛋白凝胶强度的影响Fig.5 Effect of enzyme concentration on strength of soy protein isolate gel
2.4 高强度大豆分离蛋白凝胶制作工艺的优化
2.4.1 大豆分离蛋白凝胶制作工艺的响应面优化 酶添加量(X1)、反应时间(X2)、反应温度(X3)和pH(X4)对大豆分离蛋白凝胶强度(Y)影响的响应面试验结果见表3。
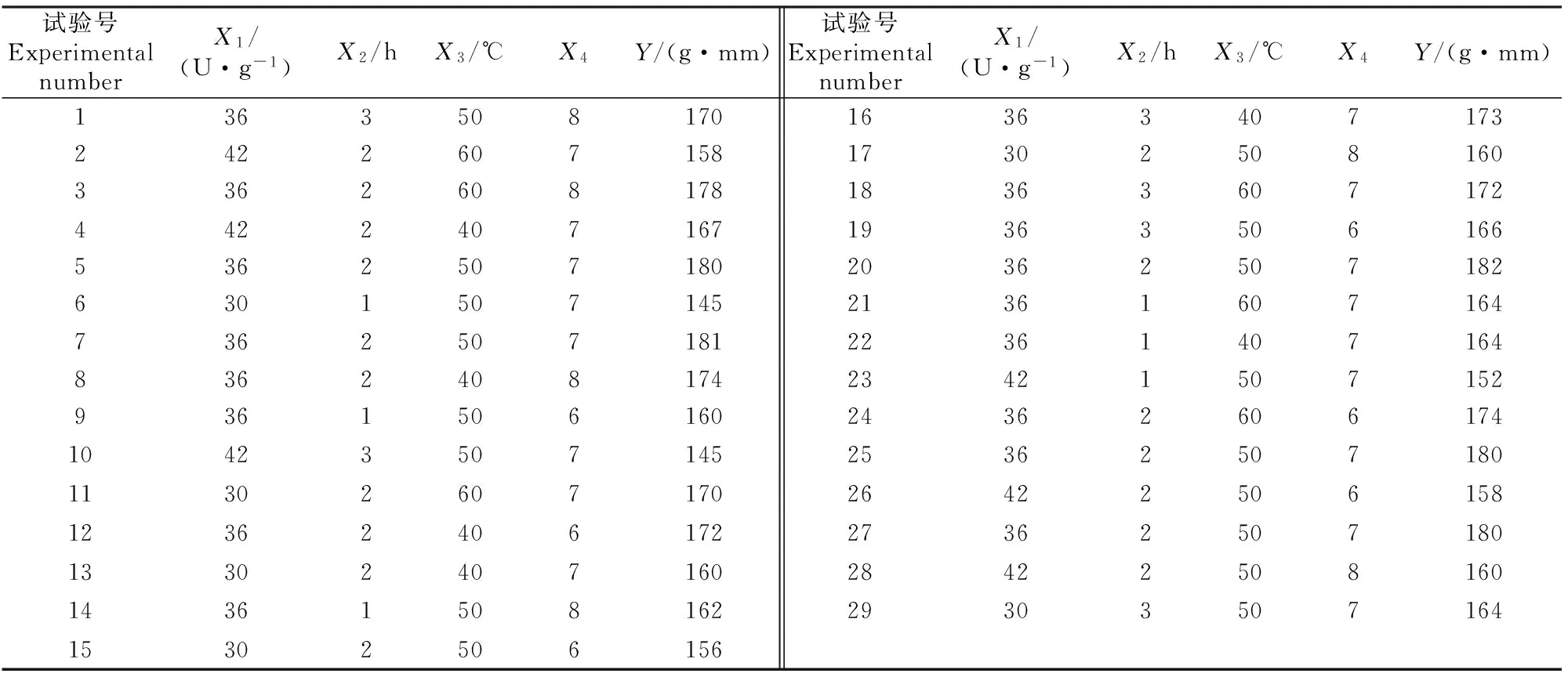
表3 大豆分离蛋白凝胶制作工艺响应面试验结果Table 3 Result of response surface on preparation of soy protein isolate gel
注:X1.酶添加量;X2.反应时间;X3.反应温度;X4.pH;Y.凝胶强度。表4同。
Note:X1.Enzyme amount;X2.Reaction time;X3.Reaction temperature;X4.pH;Y.Gel strength.Table 4 is same.
根据表3试验数据,对自变量X1(酶添加量)、X2(反应时间)、X3(反应温度)和X4(pH)进行回归分析,由Design-Expert 8.0.5.0拟合出二次多项回归方程为:



表4 二次多项回归模型的ANOVA分析Table 4 ANOVA analysis of quadratic multinomial regression model
注:*表示无显著影响,P>0.05;**表示影响显著,P<0.05;***表示影响极显著,P<0.01。
Note:*Means insignificant,P>0.05;**Means significant,P<0.05;***Means extremely significant,P<0.01。
根据ANOVA分析可以看出,反应时间对大豆蛋白凝胶强度的影响最为显著。由表4可知,失拟项的P值>0.05,差异不显著,模型的F检验值为68.62,P检验值<0.000 1,差异性极显著,说明该模型与实际试验结果拟合较好,可用于对大豆蛋白凝胶强度的理论预测。
通过响应面法优化可知,在酶添加量为34.67 U/g、反应时间为2.21 h、反应温度为60 ℃及pH为7.22时,大豆蛋白的凝胶强度达到最大,为181.779 g·mm。
2.4.2 影响因素交互作用分析 1)转谷氨酰胺酶添加量与反应时间的交互作用。由图7可知,当转谷氨酰胺酶的添加量和反应时间增大或减小时,大豆蛋白凝胶的凝胶强度随之增大或减小,而当转谷氨酰胺酶的酶添加量达到36 U/g左右,反应时间约为2 h时,大豆蛋白凝胶强度达到最高。超过此范围,凝胶强度则下降。说明转谷氨酰胺酶的添加量过高或反应时间过长都不适合大豆蛋白凝胶强度的增大[21],故本试验中转谷氨酰胺酶添加量与反应时间的交互作用对大豆蛋白凝胶强度有极显著的影响。
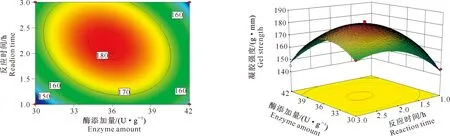
图7 转谷氨酰胺酶添加量与反应时间的交互作用对大豆蛋白凝胶强度影响的等高线图及响应面图Fig.7 Contour map and response surface map of soybean protein gel strength under the interaction between transglutaminase concentration and reaction time
2)转谷氨酰胺酶添加量与反应温度的交互作用。由图8可知,在反应温度一定的条件下,大豆蛋白的凝胶强度随酶添加量增加先增大后减小,在酶添加量为36 U/g时达到最高值。而在酶添加量一定的条件下,大豆蛋白凝胶的凝胶强度随反应温度的变化略有不同。本试验中转谷氨酰胺酶的添加量与反应温度的交互作用对大豆蛋白凝胶强度有极显著影响。
图8 转谷氨酰胺酶添加量与反应温度的交互作用对大豆蛋白凝胶强度影响的等高线图及响应面图Fig.8 Contour map and response surface map of soybean protein gel strength under the interaction between transglutaminase concentration and reaction temperature
2.5 转谷氨酰胺酶对大豆蛋白凝胶结构的影响
由图9和10可知,未添加转谷氨酰胺酶的大豆蛋白凝胶内部结构非常松散(图9),而添加转谷氨酰胺酶的大豆蛋白凝胶内部结构致密(图10),说明转谷氨酰胺酶对大豆蛋白凝胶的内部结构或集团之间的相互作用有非常重要的调节作用[22]。
图9 未加入转谷氨酰胺酶的大豆蛋白凝胶的电镜观察 Fig.9 Electron microscope observation of soybean protein without addition of transglutaminase
2.6 大豆分离蛋白的圆二光谱
2.6.1 Near-UV CD分析 大豆分离蛋白经过转谷氨酰胺酶处理前后的近紫外CD分析结果见图11,近紫外CD图谱可明确显示出大豆分离蛋白酶处理前后三级结构的变化。由图11可以看出,大豆分离蛋白在265 nm处有紫外吸收峰。不同种类氨基酸的吸收峰值不同,Trp、Tyr及Phe 3种芳香族氨基酸的吸收峰值均在250~290 nm[23],故本研究证实近紫外光谱的主要来源为芳香族氨基酸,经过转谷氨酰胺酶的处理,芳香族氨基酸所对应区域的光谱图形状椭圆率大幅降低。由此说明经过转谷氨酰胺酶处理后,芳香族氨基酸残基更多地暴露出来,这与Lagrain等[24]的研究结果一致。
2.6.2 Far-UV CD分析 转谷氨酰胺酶处理前后大豆蛋白二级结构的远紫外CD分析结果见图12。从图12可以看出,大豆蛋白和转谷氨酰胺酶处理大豆蛋白2种样品的远紫外CD图在195及215 nm附近分别有1个正峰和1个负峰,这是高度有序的β类型结构的一种特征。
通过Reed拟合计算,得到2种样品的二级结构组成,见表5。从表5可以看出,转谷氨酰胺酶处理前后大豆蛋白的二级结构存在一定的差别,与未经过酶处理的大豆蛋白相比,转谷氨酰胺酶处理后的大豆蛋白有序度更高,无规则卷曲结构含量相对较低,而β折叠含量相对增加。可能原因是经过转谷氨酰胺酶处理的大豆蛋白疏水基团重新排列[25],大豆蛋白聚集体结构发生了变化,形成了稳定的β-折叠构造,从而使产品的凝胶强度得到了明显改善。

图11 转谷氨酰胺酶处理前后大豆蛋白三级结构的近紫外光谱分析Fig.11 Near-ultraviolet spectrum of soybean protein/soybean protein with enzyme
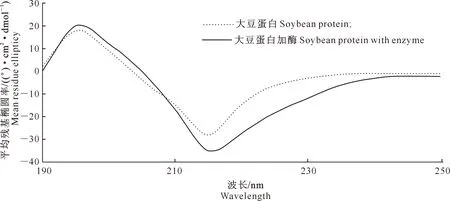
图12 转谷氨酰胺酶处理前后大豆蛋白二级结构的远紫外光谱分析Fig.12 Far-ultraviolet spectrum of soybean protein/soybean protein with enzyme
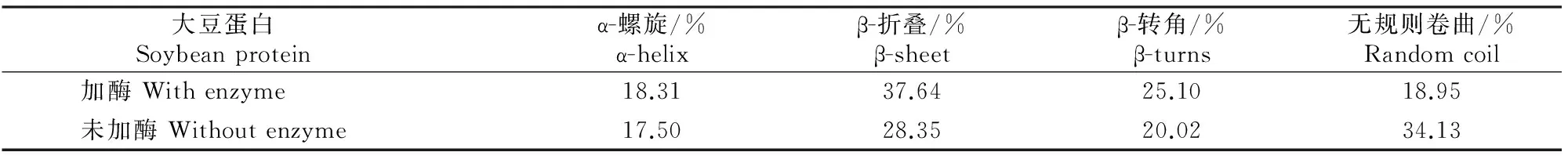
大豆蛋白 Soybeanprotein α-螺旋/%α-helixβ-折叠/%β-sheetβ-转角/%β-turns无规则卷曲/%Randomcoil加酶Withenzyme18.3137.6425.1018.95未加酶Withoutenzyme17.5028.3520.0234.13
3 结 论
1)确定了大豆品种吉农芽豆高蛋白更有利于提高大豆分离蛋白的凝胶强度,转谷氨酰胺酶为最佳的大豆蛋白凝固酶。
2) 响应面法优化结果表明,在酶添加量为34.67 U/g、反应时间为2.21 h、反应温度为60 ℃及pH为7.22时,大豆蛋白的凝胶强度达到最大值181.779 g·mm。
3)通过电子显微镜扫描发现,转谷氨酰胺酶对大豆蛋白凝胶的内部结构或集团之间的相互作用有非常重要的调节作用。
4)CD图谱分析表明,经过转谷氨酰胺酶作用,大豆蛋白聚基体结构发生了变化,形成了稳定的β-折叠构造,从而使产品的凝胶强度得到明显改善。
[1] Visentín A N,Drago S R,Osella C A.Effect of the addition of soy flour and whey protein concentrate on bread quality and mineral dialyzability [J].Archivos Latinoamericanos de Nutricion,2009,59(3):325-331.
[2] 金郁葱.大豆蛋白凝胶结构和质构的控制研究 [D].广州:华南理工大学,2013.
Jin Y C.Control study of soy protein gel texture and structure [D].Guangzhou:South China University of Technology,2013.
[3] Gekko K,Li X,Makino S.Competing effect of polyols on the thermal stability and gelation of soy protein [J].Bioscience,Biotechnology,and Biochemistry,1999,63(12):617-622.
[4] 李冬莹.转谷氨酰胺酶对大豆蛋白胨凝胶特性影响的研究 [D].长春:吉林农业大学,2014.
Li D Y.Study on the gel properties of the coagulation by transglutaminase producing soy peptone [D].Changchun:Jilin Argricultural University,2014.
[5] 龙国徽.大豆蛋白的结构特征与营养价值的关系 [D].长春:吉林农业大学,2015.
Long G H.Structural properties of soy protein and its relationship to the nutritional value [D].Changchun:Jilin Agricultural Univercity,2015.
[6] 曲 玲,张春红,刘长江.大豆分离蛋白的复合改性及其对某些功能性的影响 [J].食品工业科技,2007,14(2):71-73.
Qu L,Zhang C H,Liu C J.Comprehensive modifications of soybean protein isolate and their effects on its functional properties [J].Science and Technology of Food Industry,2007,14(2):71-73.
[7] 石小琼,饶华明.天然食品保鲜防腐剂Nisin在豆腐保鲜上的应用研究 [J].食品工业科技,2004,38(11):130-131.
Shi X Q,Rao H M.Study on the application of natural food preservativenisin in preservation of tofu [J].The Food Industry Science and Technology,2004,38(11):130-131.
[8] Dias K,Myers D J.Functional properties of the acidic and basic subunits of the glycinin (11S) soy protein fraction [J].Journal of the American Oil Chemists’ Society,2003,80(6):551-555.
[9] 袁德保.大豆蛋白热聚集行为及其机理研究 [D].广州:华南理工大学,2010.
Yuan D B.Heat-induced aggregation of soy proteins and its mechaism [D].Guangzhou:South China University of Technology,2010.
[10] Lakemond C,Grupen H,Hessing M.Heat denaturation of soy glycinin:influence of pH and ionic strength on molecular structure [J].Journal of Agricultural and Food Chemistry,2000,48(6):1991-1995.
[11] Yuan D B,Min W,Yang X Q.An improved isolation method of soy β-conglycinin subunits and their characterization [J].Journal of the American Oil Chemists’ Society,2010,87(9):997-1004.
[12] 安 静,于国萍,初云斌.转谷氨酰胺酶催化对不同大豆蛋白凝胶性的影响 [J].食品科学,2011,32(6):32-37.
An J,Yu G P,Chu Y B.Effect of transglutaminase on characteristics of soybean protein gels [J].Food Science,2011,32(6):32-37.
[13] 吴 伟.蛋白质氧化对大豆蛋白结构和凝胶性质的影响 [D].江苏无锡:江南大学,2010.
Wu W.Effects of protein oxidation on structure and gel properities of soy protein [D].Wuxi,Jiangsu:Jiangnan Univercity,2010.
[14] 王金梅.大豆蛋白热聚集行为及界面、乳化性质研究 [D].广州:华南理工大学,2012.
Wang J M.Thermally aggregation behaviors,interfacial and emulsifying proterties of soy protein [D].Guangzhou:South China University of Technology,2012.
[15] 田 琨.大豆蛋白的结构表征及应用研究 [D].上海:复旦大学,2010.
Tian K.Structure characterization and application of soy protein [D].Shanghai:Fudan Univercity,2010.
[16] 汪建斌,邓 勇.Alcalase 碱性蛋白酶对大豆分离蛋白水解作用的研究 [J].食品工业科技,2002,23(1):35-37.
Wang J B,Deng Y.Studies on the isolated soy proteins hydrolytic action by alknline proteinase-Alacalase [J].Science and Technolog of Food Industry,2002,23(1):35-37.
[17] Kang H J,Wang Z,Zhang W.Physico-chemical properties improvement of soy protein isolate films through caffeic acid incorporation and tri-functional aziridine hybridization [J].Food Hydrocolloids,2016,61:923-932.
[18] Gao X Q,Hao X Z,Xiong G Y.Interaction between carrageenan/soy protein isolates and salt-soluble meat protein [J].Food and Bioproducts Processing,2016,100:47-53.
[19] Boatright W L,Crum A D.Nonpolar-volatile lipids from soy protein isolates and hexane-defatted flakes [J].Journal of the American Oil Chemists’ Society,1997,74(4):461-467.
[20] Puppo M C,Sorgentini D A,Aón M C.Rheological properties of emulsions containing modified soy protein isolates [J].Journal of the American Oil Chemists’ Society,2003,80(6):605-611.
[21] 张晋博.多糖对大豆蛋白的修饰及其界面、乳化和凝胶性质的研究 [D].广州:华南理工大学,2013.
Zhang J B.Interfacial emulsifying and gelation properties of soy protein modified by polysaccharide [D].Guangzhou:South China University of Technology,2013.
[22] Deak N A,Murphy P A,Johnson L A.Characterization of fractionated soy proteins produced by a new simplified procedure [J].Journal of the American Oil Chemists’ Society,2007,84(2):137-149.
[23] Wang C,Pagadala S,Sherrard M S.Changes of isoflavones during processing of soy protein isolates [J].Journal of the American Oil Chemists’ Society,1998,75(3):337-341.
[24] Lagrain B,Thewissen B G,Brijs K.Mechanism of gliadin-glutenin cross-linking during hydrothermal treatment [J].Food Chemistry,2008,107(2):753-760.
[25] Li C,Wang C L,Sun Y.Microencapsulation of lactobacillus rhamnosus GG by transglutaminase cross-linked soy protein isolate to improve survival in simulated gastrointestinal conditions and yoghurt [J].Journal of Food Science,2016,81(7):1726-1734.

