QuEChERS-超高效液相色谱-串联质谱技术同时测定大蒜中10种农药残留
林 静,张 顺,蔡 挺,*,曹 慧,刘 鹏,荀 凯,乐元洁
(1.宁波市第二医院,浙江 宁波 315000; 2.浙江省产品质量安全检测研究院,浙江 杭州 310000)
大蒜(AlliumsativumL.)风味独特,具有一定的杀菌作用,其含有的含硫化合物和含硒化合物对防癌也有一定的积极效果,深受大众喜爱。然而种植过程中存在的农药残留可能会导致人类免疫抑制、智力降低、激素破坏、生殖异常,并具有遗传毒性[1-4]。大蒜中农药多残留检测的主要难点在于其复杂的基质效应。基质效应的主要来源是大蒜中的大蒜氨酸在空气中被氧化形成大蒜素[5],大蒜素与常见有机氯和有机磷类农药理化性质极为相似,在农药残留检测过程中不易去除,影响农药定量检测的准确性[6]。目前大蒜中农药残留检测主要为GC-MS法[7-10]和酶抑制法[11]等。这些方法操作较为烦琐,检测效率和准确度均不如超高效液相色谱-串联质谱技术[12-14]。本实验通过优化大蒜中农药多残留检测的提取及净化方法,建立一种大蒜中10种农药多残留的超高效液相色谱-串联质谱检测技术。该方法检测限和定量限低、精密度高,可为其他农药的分析提供借鉴依据。
1 材料与方法
1.1 仪器与试剂
Acquity超高效液相色谱仪和Xevo TQ-S质谱仪(Water公司,美国),配有电喷雾电离接口(ESI)(赛多利斯科学仪器(北京)有限公司)及Masslynx数据处理系统(IKA公司,德国)。
甲醇、乙腈、甲酸、正己烷均为色谱纯;甲苯、丙酮、二氯甲烷、无水硫酸镁为分析纯;PSA、C18购自上海安谱科学仪器有限公司;LC-Florisil SPE(1 g,6 mL)、ENVI-CARB/LC-NH2(500 mg/500 mg,6 mL)购自美国Supelco公司;Cleanert TPT-SPE(1000 mg,6 mL)购自Agela Technologies;OASIS PRiME HLB Cartridge(200 mg,6 mL)、Sep-Pak Vac C18(500 mg,6 mL)购自Waters公司;0.2 μm有机滤膜购自Waters公司;所有实验用水均为超纯水;大蒜购自农贸市场和超市。
异菌脲、咪鲜胺、吡虫啉、噻虫嗪、嘧霉胺、啶虫脒、克百威(甲醇,1 000 μg·mL-1)、多菌灵(甲醇,500 μg·mL-1)购自农业部环境质量监督检验测试中心;三唑酮(正己烷,100 μg·mL-1)、多效唑(甲醇,100 μg·mL-1)购自农业部环境保护科研监测所。
由于正己烷、甲醇不互溶,先取三唑酮标准溶液100 μL于10 mL容量瓶中,氮气流下吹干。再分别加入5 μL咪鲜胺、嘧霉胺、啶虫脒、克百威标准溶液,10 μL多菌灵、异菌脲、吡虫啉、噻虫嗪标准溶液,50 μL多效唑标准溶液,用甲醇定容至10 mL,配制成咪鲜胺、嘧霉胺、多效唑、多菌灵、啶虫脒、克百威浓度为0.5 μg·mL-1,异菌脲、三唑酮、吡虫啉、噻虫嗪浓度为1 μg·mL-1的混合标准溶液。4 ℃冰箱保存,待用。
1.2 仪器工作条件
色谱条件:色谱柱:Waters CORTECS UPLC C181.6 μm(2.1×100 mm Column);流动相:0.1%(体积分数)甲酸水溶液(A),乙腈(B);梯度:0~1.5 min,10% B;1.5~3.0 min,10%~95% B;3.0~4.0 min,95% B;4.0~5.0 min,95%~10% B;5.0~8.0 min,10% B;柱温:35 ℃;样品温度:25 ℃;流速:0.2 mL·min-1;进样量:5 μL。
质谱条件:离子源,电喷雾离子源(ESI);扫描方式,正离子模式;采集方式,多反应监测(MRM);毛细管电压,3.00 kV;离子源温度,150 ℃;脱溶剂气温度,450 ℃;脱溶剂气流速,800 L·Hr-1;锥孔气,150 L·Hr-1。
1.3 样品前处理
1.3.1 提取
大蒜样品去除根部及表面污泥,剪成小段后均质。称取5.00 g已均质的大蒜样品于50 mL聚丙烯离心管中,加入10 mL 1%甲酸乙腈,匀浆,滤纸过滤,收集滤液。
1.3.2 净化
QuEChERS法:取5.00 mL滤液于15 mL塑料管中,加入500 mg无水硫酸镁、500 mg PSA和500 mg C18,涡旋1 min,静置10 min。上清液12 000 r·min-1离心5 min,取离心后的上清液2 mL于40 ℃氮吹浓缩至干,用1 mL乙腈/0.1%甲酸水(体积比为1∶9)溶解残渣,溶液过0.2 μm有机滤膜后,供超高效液相色谱-串联质谱测试。
LC-Florisil柱[15]:取2 mL滤液于15 mL塑料管中氮吹至近干,加入2 mL正己烷溶解。LC-Florisil柱依次用5 mL丙酮+正己烷(10+90)、5 mL正己烷预淋洗,加入上述待净化液,用5 mL丙酮+正己烷(10+90)冲洗塑料管后淋洗柱,并重复一次,收集全部流出液40 ℃氮吹浓缩至干,用1 mL乙腈/0.1%甲酸水(体积比为1∶9)溶解残渣,溶液过0.2 μm有机滤膜后,供超高效液相色谱-串联质谱测试。
ENVI-Carb/NH2柱[16]:取2 mL滤液于15 mL塑料管中氮吹至近干,加入1 mL丙酮+二氯甲烷(1+8)溶解。用4 mL乙腈+甲苯(3+1)预洗柱,加入上述待净化液,用5 mL乙腈+甲苯(3+1)冲洗塑料管后淋洗柱,并重复一次,收集全部流出液40 ℃氮吹浓缩至干,用1 mL乙腈/0.1%甲酸水(体积比为1∶9)溶解残渣,溶液过0.2 μm有机滤膜后,供超高效液相色谱-串联质谱测试。
Cleanert TPT柱[17]:用10 mL乙腈+甲苯(3+1)预洗柱,取2 mL滤液上样,用5 mL乙腈+甲苯(3+1)冲洗塑料管后淋洗柱,并重复一次,收集全部流出液40 ℃氮吹浓缩至干,用1 mL乙腈/0.1%甲酸水(体积比为1∶9)溶解残渣,溶液过0.2 μm有机滤膜后,供超高效液相色谱-串联质谱测试。
Waters PRiME HLB柱:取2 mL滤液直接上样,再用2 mL乙腈淋洗,收集全部流出液40 ℃氮吹浓缩至干,用1 mL乙腈/0.1%甲酸水(体积比为1∶9)溶解残渣,溶液过0.2 μm有机滤膜后,供超高效液相色谱-串联质谱测试。
C18柱:依次用5 mL乙腈、5 mL水活化,取2 mL滤液上样,再用5 mL乙腈洗脱,收集全部流出液40 ℃氮吹浓缩至干,用1 mL乙腈/0.1%甲酸水(体积比为1∶9)溶解残渣,溶液过0.2 μm有机滤膜后,供超高效液相色谱-串联质谱测试。
2 结果与分析
2.1 色谱条件的优化
2.1.1 色谱柱的选择
实验比较了ACQUITY UPLC HSS T3 1.8 μm(2.1×100 mm Column)和Waters CORTECS UPLC C181.6 μm(2.1×100 mm Column)两款色谱柱。前者为超高效通用性C18色谱柱,后者为经过性能优化的色谱柱。结果表明,使用CORTECS柱,农药峰形明显变好,响应明显变高。以多效唑为例,图1为使用T3柱时多效唑的多反应监测色谱图,图2为使用CORTECS柱时相同浓度的多效唑的多反应监测色谱图。因此,本实验选用Waters CORTECS UPLC C181.6 μm(2.1×100 mm Column)为液相色谱柱。
2.1.2 流动相的选择
在其他液相条件相同的情况下,比较了乙腈/水和甲醇/水梯度洗脱对农药混标的出峰效果影响。结果表明,采用乙腈/水作为流动相时,农药的峰形、分离度较差,但响应高了一个数量级。由于影响峰响应的主要因素为质谱条件,而峰形、分离度可通过调节梯度洗脱程序进行优化,因此本实验选用乙腈作为流动相的有机相。后续比较过程发现,有机相选取酸化乙腈或乙腈的差别不大,而水相选取0.1%甲酸水,能使回收率提高,所以选用乙腈和0.1%甲酸水作为液相流动相。考虑到和定溶液的匹配性,流动相的初始比例设为乙腈/0.1%甲酸水体积比为1∶9。后续再调整梯度,选择兼容性较好、洗脱时间充足的洗脱程序,使得各种农药在短时间内实现基本分离,增强方法拓展性。最终梯度洗脱程序见1.2节。图3为大蒜基质中10种农药的多反应监测色谱图。
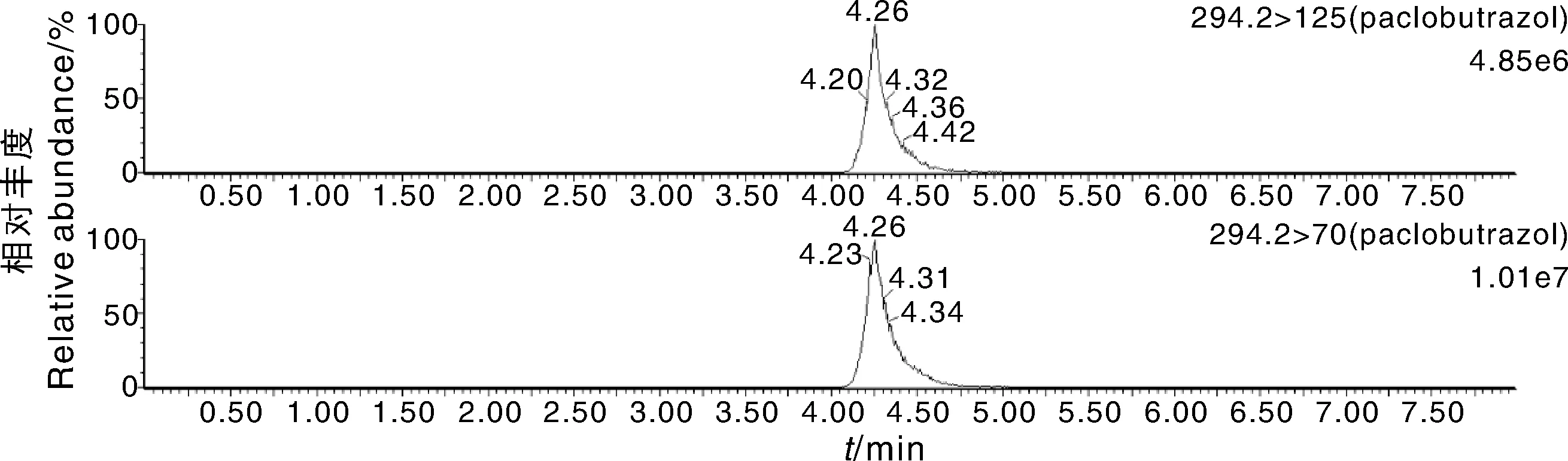
图1 使用T3柱时多效唑的色谱图Fig.1 Chromatogram of paclobutrazol with the column of T3
2.2 质谱条件的优化
采用流动注射的方式,将高浓度的标准工作溶液分别注入到离子源中,在多级反应监测(MRM)模式下对农药进行一级质谱分析(Q1扫描),得到农药的分子离子峰。选取相应的母离子峰,分别对其子离子进行二级质谱分析(Q2扫描),得到碎片离子信息。然后分别筛选两个离子强度较高的子离子与母离子组建成MRM离子对。再对去簇电压(DP)、聚焦电压(FP)、碰撞气(CAD)、碰撞能量(CE)、电喷雾电压(IS)等质谱参数进行优化。最后以FIA方式优化雾化气(NEB)、气帘气(CUR)、电喷雾电压(IS)、辅助气温度(TEM)等参数,获取最优的质谱条件。优化后的质谱参数见表1。
2.3 前处理的优化

图2 使用CORTECS柱时多效唑的色谱图Fig.2 Chromatogram of paclobutrazol with the column of CORTECS
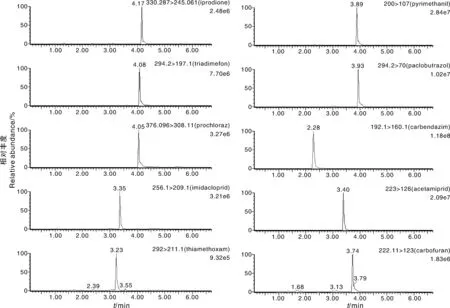
图3 大蒜基质中10种农药的多反应监测色谱图Fig.3 MRM chromatograms of 10 pesticides in garlic
表1十种农药的质谱参数
Table1Mass conditions of 10 pesticides

编号No.化合物Compound保留时间Retentiontime/min监测离子对Ionpair/(m·z-1)去簇电压Declusteringpotential/V碰撞能量Collisionenergy/V1异菌脲Iprodione4.17330.29/245.06*,330.29/88.142616,202三唑酮Triadimefon4.08294.20/197.10*,294.20/225.202920,173咪鲜胺Prochloraz4.05376.10/308.11*,376.10/70.132010,244吡虫啉Imidacloprid3.35256.10/209.10*,256.10/175.103415,205噻虫嗪Thiamethoxam3.23292.00/211.10*,292.00/181.101912,166嘧霉胺Pyrimethanil3.89200.00/107.00*,200.00/82.005124,247多效唑Paclobutrazol3.93294.20/70.00*,294.20/125.003449,508多菌灵Carbendazim2.28192.10/160.10*,192.10/132.103318,289啶虫脒Acetamiprid3.40223.00/126.00*,223.00/56.103420,1510克百威Carbofuran3.74222.11/123.00*,222.11/165.102516,16
“*”,定量离子。
“*”,Quantitative ion pair.
2.3.1 提取溶剂的选择
提取溶剂的提取效率直接关系到实验回收率的高低。根据《GB/T 20769—2008水果和蔬菜中450种农药及相关化学品残留量的测定 液相色谱-串联质谱法》[18]里用乙腈作为提取剂,比较了纯乙腈和1%甲酸乙腈的提取效果。结果如图4所示,1%甲酸乙腈的提取效果稍好于纯乙腈。因此,本试验采用1%甲酸乙腈作为提取溶剂。
2.3.2 净化方式的选择
试验在阴性大蒜样品中添加咪鲜胺、嘧霉胺、多效唑、多菌灵、啶虫脒、克百威浓度为10 μg·kg-1,异菌脲、三唑酮、吡虫啉、噻虫嗪浓度为5 μg·kg-1水平的农药标准溶液,按1.3节进行处理,用基质匹配标准溶液定量计算回收率。

图4 乙腈和1%甲酸乙腈的提取效果比较Fig.4 Comparison of extraction effect for acetonitrile and 1% formic acid acetonitrile
QuEChERS方法中,N-丙基乙二胺(PSA)用于农药残留分析,作为吸附剂吸附杂质,能有效去除样品基质中的有机酸、色素和糖类;C18能有效去除样品基质中的有机酸、脂肪酸、碳水化合物和色素;无水硫酸镁具有吸水作用,而且也能去除部分色素。实验比较了净化剂添加量分别为500 mg无水硫酸镁+100 mg PSA、1 000 mg无水硫酸镁+100 mg PSA的净化效果,发现无显著性差异,从节约试剂的角度考虑,选择无水硫酸镁的添加量为500 mg。在此基础上比较了分别添加100 mg、200 mg、500 mg PSA的净化效果,发现添加100 mg PSA时,回收率均小于60%,而添加500 mg PSA时,回收率最高,在62.5%~89.0%。然后在500 mg无水硫酸镁+500 mg PSA的基础上,比较了分别添加0 mg、100 mg、200 mg、500 mg C18的净化效果,发现添加500 mg C18时,回收率达到71.2%~95.7%。因此,选取500 mg无水硫酸镁、500 mg PSA、500 mg C18作为QuEChERS方法的净化剂。该净化剂中,PSA和C18的用量高于一般的QuEChERS方法,这可能与大蒜基质的复杂性有关。
五种固相萃取柱和优化后QuEChERS方法处理加标样品的回收率见表2。可以发现,使用LC-Florisil柱,近半数农药回收率很低,可能是柱子对农药有吸附作用;使用ENVI-Carb/NH2柱和Cleanert TPT固相萃取柱,多菌灵、咪鲜胺的回收率较低;使用Waters PRiME HLB柱,异菌脲、咪鲜胺的回收率较低;使用C18柱,出现回收率普遍偏高的问题。综合考虑回收率、成本、操作简便性,本试验最终选取QuECHERS方法。
表2六种净化方式的回收率
Table2Recoveries of 6 kinds of purification methods

编号No.化合物Compound加标水平Spikedlevel/(μg·kg-1)回收率Recovery/%LC-FlorisilENVI-Carb/NH2CleanertTPTPRiMEHLBC18QuECh-ERS1异菌脲Iprodione1070.581.781.056.7118.371.22三唑酮Triadimefon1075.284.689.383.388.382.53咪鲜胺Prochloraz548.651.753.063.683.795.74吡虫啉Imidacloprid1076.196.091.396.5116.791.25噻虫嗪Thiamethox-am1055.595.385.099.8120.590.16嘧霉胺Pyrimethanil562.191.774.680.687.785.57多效唑Paclobutrazol571.078.671.379.0113.386.38多菌灵Carbendazim582.555.069.080.0112.082.19啶虫脒Acetamiprid556.395.086.389.1122.079.810克百威Carbofuran574.196.390.674.0106.682.1
2.4 基质效应
基质指的是样品中除分析物以外的组分,常常对分析物的分析过程有显著的干扰,并影响分析结果的准确性,这些影响和干扰被称为基质效应(matrix effect)。本文采用基质匹配标准曲线与流动相标准曲线的斜率比值来评估基质效应,具体结果见表3。可以看出,基质匹配标准曲线斜率与流动相标准曲线斜率的比值在0.56~1.23,说明仍存在一定的基质效应。因此,采用基质匹配标准曲线进行实际样品的定量测定。
2.5 方法学验证
2.5.1 线性关系、检出限和定量限
用大蒜空白基质提取净化后的溶液稀释1.1节的混合标准溶液,配制不同浓度的混合标准曲线点。以浓度为横坐标,以峰面积为纵坐标,绘制标准曲线。10种农药在相应的线性范围内呈良好的线性关系,相关系数均大于0.99。以3倍信噪比(S/N=3)求得农药的检出限,10倍信噪比(S/N=10)求得农药的定量限,具体结果见表3。10种农药的检出限在0.020~0.800 μg·kg-1,定量限在0.067~2.670 μg·kg-1。
与《GB/T 20769—2008 水果和蔬菜中450种农药及相关化学品残留量的测定 液相色谱-串联质谱法》[18]相比,本方法省去了固相萃取净化的步骤,节约了试剂,操作也更加简便。10种农药中,异菌脲为本方法新增。其余9种,检出限均低于国标方法。
2.5.2 回收率和精密度
分别在阴性大蒜样品中添加咪鲜胺、嘧霉胺、多效唑、多菌灵、啶虫脒、克百威浓度为5、10、20 μg·kg-1,异菌脲、三唑酮、吡虫啉、噻虫嗪浓度为2.5、5.0、10.0 μg·kg-1三水平的农药标准溶液,按1.3节进行前处理,每个水平平行测定6次。回收率及相对标准偏差(RSD)见表4。结果表明,大蒜中10种农药的加标回收率在73.4%~109.0%,相对标准偏差在1.2%~9.8%。
表3大蒜中10种农药的基质效应、线性范围、线性方程、相关系数、检出限和定量限
Table3Matrix effects, linear ranges, linear equations, correlation coefficients, limits of detection(LOD), limits of quantitation(LOQ) of 10 pesticides in garlic

编号No.化合物Compound基质效应Matrixeffect线性范围Linearrange/(ng·mL-1)线性方程Linearequation相关系数r2检出限LOD/(μg·kg-1)定量限LOQ/(μg·kg-1)1异菌脲Iprodione1.231~200Y=2125.13X+1589.710.9905730.6002.0002三唑酮Triadimefon0.610.5~200Y=7102.8X+1966.220.9981840.2000.6703咪鲜胺Prochloraz0.590.5~200Y=7054.06X+266.7020.9950920.0600.2004吡虫啉Imidacloprid1.051~200Y=2825.31X+2887.480.9971170.5001.6705噻虫嗪Thiamethoxam0.905~200Y=895.219X+249.5050.9974070.8002.6706嘧霉胺Pyrimethanil0.650.25~100Y=49952.5X-1117220.9932290.1250.4007多效唑Paclobutrazol0.600.5~200Y=19898.6X-981.1360.9989920.0500.1678多菌灵Carbendazim0.680.1~50Y=257025X+74738.90.9900970.0200.0679啶虫脒Acetamiprid0.750.5~200Y=39577.6X-12602.20.9943490.0500.16710克百威Carbofuran0.561~200Y=3837.73X+3558.290.9960610.2000.670
2.6 实际样品的测定
本研究随机抽取了4批次农贸市场和3批次超市的大蒜样本,其中1批次农贸市场的大蒜样本检出吡虫啉0.676 μg·kg-1、多菌灵3.146 μg·kg-1。建议消费者到正规的市场和超市购买大蒜。在选购蔬菜时,可参考各批发零售市场、商场、超市农药残留公示牌上公布的当天蔬菜的检测结果。
表4大蒜中10种农药的回收率和相对标准偏差
Table4Recoveries and RSD of 10 pesticides in garlic

编号化合物加标水平平均回收率相对标准偏差No.CompoundSpikedlevel/(μg·kg-1)Averagerecovery/%RSD/%1异菌脲Iprodione5102.31.21075.63.92084.75.82三唑酮Triadimefon591.03.81080.52.42083.38.83咪鲜胺Prochloraz2.599.49.05.0101.01.510.0104.81.24吡虫啉Imidacloprid577.86.01092.35.82094.63.35噻虫嗪Thiamethoxam5101.19.81094.24.520105.53.96嘧霉胺Pyrimethanil2.591.23.15.078.02.810.085.59.57多效唑Paclobutrazol2.573.42.15.089.01.510.0102.06.98多菌灵Carbendazim2.5109.01.35.084.31.210.098.93.79啶虫脒Acetamiprid2.576.01.35.075.53.910.091.23.810克百威Carbofuran2.582.33.05.083.83.910.081.03.8
3 小结
本研究优化了大蒜中农药多残留测定的前处理方法,利用超高效液相色谱-串联质谱建立了同时分析大蒜中10种农药多残留的方法。该方法操作简便、灵敏度高、重现性好,可满足日常检测的需求,亦可为农药残留的监管部门提供技术支撑。
[1] ABHILASH P C, SINGH N. Pesticide use and application: an Indian scenario[J].JournalofHazardousMaterials, 2009, 165(1):1-12.
[2] GARRY V F. Pesticides and children[J].ToxicologyandAppliedPharmacology, 2004, 198(2): 152-163.
[3] BARR D B, ANANTH C V, YAN X, et al. Pesticide concentrations in maternal and umbilical cord sera and their relation to birth outcomes in a population of pregnant women and newborns in New Jersey[J].ScienceoftheTotalEnvironment, 2010, 408(4):790-795.
[4] FENG L, KONG Z M, WANG X M, et al. Acute toxicity and genotoxlcity of two novel pesticides on anrphibian. Rana N. Hallowell[J].Chemosphere, 2004, 56: 457-463.
[5] 郭永泽, 张玉婷, 刘磊,等. 大蒜中多种农药残留测定的气相色谱-质谱联用技术研究[J]. 安徽农业科学, 2010, 38(8):3870-3873.
GUO Y Z, ZHANG Y T, LIU L, et al. Determination of multipie pesticides residue in garlic by gas chromatography/mass spectrometry[J].JournalofAnhuiAgriculturalSciences, 2010,38(8):3870-3873. (in Chinese with English abstract)
[6] 李萍萍, 吴小芳, 万瑶,等. 固相萃取-气相色谱-串联质谱法测定大蒜中19种有机磷农药残留量[J]. 农药学学报, 2014, 16(6):720-727.
LI P P, WU X F, WAN Y, et al. Determination of 19 organophosphorus pesticide residues in garlic using solid-phase extraction and gas chromatography-tandem mass spectrometry[J].ChineseJournalofPesticideScience, 2014, 16(6):720-727. (in Chinese with English abstract).
[7] 马晓东, 李重九. 大蒜中农药多残留分析方法研究[J]. 质谱学报, 2000, 21(增刊1):49-50.
MA X D,LI C J. Study on multi-residue analysis of insecticides in garlic[J].JournalofChineseMassSpectrometrySociety,2000, 21(S1):49-50. (in Chinese with English abstract)
[8] 孙艳艳, 王菡, 陈晓辉,等. 基质固相分散法测定大蒜中11种有机氯农药残留[J]. 现代科学仪器, 2009(3):55-57.
SUN Y Y, WANG H, CHEN X H, et al. Determination for pesticide residues of 11 organochlorines in garlic by matrix solidphase dispersion method[J].ModernScientificInstruments. 2009(3):55-57. (in Chinese with English abstract)
[9] LIU Y, JIANG S, XU Y, et al. Simultaneous determination of 120 pesticide residues in green onion, ginger and garlic by gas chromatography-tandem mass spectrometry[J].Chemistry, 2012, 75(12):1132-1139.
[10] SHU J J, LIU C J, MOTOAKI S, et al. The method of sample-pre treatment in the determination of residual pesticides in onion, garlic and chives by hyphenation of gas chromatography and mass spectrometry[J].PhysicalTesting&ChemicalAnalysis, 2006, 42(11):914-917.
[11] 王文, 刘瑾, 盛伟楠,等. 采用酶抑制法检测大蒜中农药残留的改进方法[J]. 食品科学, 2013, 34(12):135-139.
WANG W, LIU J, SHENG W N, et al. An improved enzyme inhibition method for detection of peptide residues in garlic[J].FoodScience, 2013, 34(12):135-139. (in Chinese with English abstract)
[12] 晏利芝, 赵永彪, 刘宁,等. UPLC-MS/MS法同时测定蔬菜中34种农药残留[J]. 食品研究与开发, 2015(3):100-103.
YAN L Y, ZHAO Y B, LIU N, et al. Simultaneous determination of 34 kinds of pesticide residues in vegetable by UPLC-MS/MS[J].FoodResearchandDevelopment, 2015(3):100-103. (in Chinese with English abstract)
[13] KONG Z, DONG F, XU J, et al. Determination of difenoconazole residue in tomato during home canning by UPLC-MS/MS[J].FoodControl, 2012, 23(2):542-546.
[14] RAN J I, ZHU G Y, LIU B. Determination of ethofenprox residue in cabbage and soil by UPLC-MS[J].ChineseJournalofPesticideScience, 2010, 12(3):283-288.
[15] NY/T 761—2008. 蔬菜和水果中有机磷、有机氯、拟除虫菊酯和氨基甲酸酯类农药多残留的测定[S]. 北京: 中华人民共和国农业部,2008.
[16] GB/T 19426—2006. 蜂蜜、果汁和果酒中 497种农药及相关化学品残留量的测定气相色谱-质谱法[S]. 北京: 中华人民共和国国家质量监督检验检疫总局,2006.
[17] GB/T 23204—2008. 茶叶中519种农药及相关化学品残留量的测定 气相色谱-质谱法[S]. 北京: 中华人民共和国国家质量监督检验检疫总局,2008.
[18] GB/T 20769—2008. 水果和蔬菜中450种农药及相关化学品残留量的测定 液相色谱-串联质谱法[S]. 北京: 中华人民共和国国家质量监督检验检疫总局,2008.

