二氧化锰的可控合成及其重金属吸附性能研究*
宋燕青,谭 期,林滨钰,廖 靓,曾 婵,何振忠,邱伟明
(广东省韶关市质量计量监督检测所,广东韶关512026)
重金属污染,尤其是土壤和水体中的重金属污染是全球性关注的重要环境问题,对环境和人体带来极大危害。Pb2+、Cr6+、Zn2+、Cu2+、As 等是常见的水体污染重金属。从水体中去除重金属的方法有很多,如氧化法、絮凝沉淀法、膜分离法、吸附法、离子交换法、生物处理法等[1-2]。其中吸附法具有较好的效果,该法的核心是高效吸附剂,常见的吸附剂有碳材料(活性炭、生物质炭、碳纳米管等)、矿物材料(黏土、硅藻土、沸石、膨润土等)、过渡金属氧化物或者氢氧化物、高分子吸附剂(纤维素、木质素等)等[3]。
二氧化锰具有丰富多变的晶型(如 α-、β-、γ-、δ-等)和形貌(如棒状、线状、花状、球状、片状、海胆状等)[4-5]。根据其晶体结构的不同,其基本构筑单元[MnO6]可以组装成不同孔径大小的隧道状或者层状结构,这使得其具有优异的吸附性能。因此,二氧化锰常常被用于水体中有机染料、酚类化合物等的吸附降解[6-8],金属的富集或者重金属的消除[9-13]。二氧化锰的性能受其晶型和形貌影响较大,经常表现出晶型依赖或者形貌依赖的性能。笔者可控合成了2种晶型和形貌的MnO2,考察了它们对水中常见重金属Pb、Cr和Zn的吸附性能,探讨了二氧化锰的晶型对重金属吸附的影响。
1 实验
1.1 样品制备
所有试剂原料皆为分析纯,购自广州化学试剂厂。
α-MnO2:高锰酸钾与硫酸锰按照物质的量比为0.76配置成酸性液(硝酸调节),再在100℃下回流搅拌反应24 h,所得黑色产物经过滤、洗涤后在60℃下干燥12 h。
Bir-MnO2:将氯化锰、氢氧化钠和过硫酸铵按照物质的量比为1∶4∶4混合配置成溶液,在常温下搅拌24 h,经过滤、洗涤后于60℃下干燥12 h即得到Birnessite型 MnO2,以下缩写为 Bir-MnO2。
1.2 表征
采用ultima型X射线衍射仪测试样品的晶型(Cu靶Kα辐射,管电压为40 kV,管电流为40 mA,扫描范围为10~70°)。采用S3400N型扫描电子显微镜和JEM-2010型透射电镜观察样品的形貌。采用ASAP2020型表面积和孔径分析仪测试样品的表面积(样品在150℃下原位脱气10 h,再在液氮温度下测试)。采用AA6880型原子吸收光谱仪测定样品的重金属离子含量。
1.3 重金属吸附性能测试
取100 mL一定浓度的重金属盐溶液(Pd2+、Cr6+、Zn2+)加入圆底烧瓶中,调节体系pH=5,再加入一定量的二氧化锰吸附剂,室温下于恒温摇床振荡混合,间隔一定时间取样,样品用微孔滤膜去除二氧化锰,得到的滤液用原子吸收光谱检测金属浓度。金属的去除率采用下式计算:
E=(ρ0-ρe)/ρ0×100%
式中,E为去除率,ρ0和ρe分别为金属离子的初始质量浓度和平衡质量浓度,mg/mL。
2 结果与讨论
2.1 结构和形貌表征
图1为实验制备得到的2种晶型氧化锰的XRD谱图。由图 1a可见,样品在 12.78、18.10、28.70、37.50、41.90、49.90、60.10°处出现了特征衍射峰,与 α-MnO2标准卡片(JCPDS 44-0141)的峰相对应。 从图 1b 可见,在 12.38、24.90、37.00°等处出现的衍射峰归属为Bir-MnO2的特征峰(JCPDS 43-1456)。此外,在XRD谱图中未检测到其他杂相,说明本实验成功制备了2种晶型的MnO2。

图1 2种晶型MnO2的XRD谱图
采用SEM和TEM对2种晶型MnO2的形貌做了观察,结果见图 2~3。 由图 2a、3a可见,α-MnO2呈现出清晰的长短不一的纳米棒状结构,其直径为20 nm左右,长度约几十到几百纳米。与之相反,Bir-MnO2表现出纳米片状结构(图3b),而后这些纳米片进一步组装成三维花(图2b),这些花球具有丰富的孔道结构,有利于重金属吸附。

图2 2种晶型MnO2的SEM照片

图3 2种晶型MnO2的TEM照片
图4为2种晶型的MnO2的N2吸附-脱附等温曲线。 α-MnO2表现出Ⅳ型吸附等温线[14],低的相对压力p/p0对应于微孔填充,较高的p/p0对应毛细管凝聚。吸附脱附等温线在高压部分不重合,出现H3型滞后回环状,表明有微孔和平行板模型的狭缝状毛细作用,其BET比表面积为48.6 m2/g。Bir-MnO2的等温线属于带H2型滞后环的Ⅳ型等温线,这表明其具有介孔结构,与SEM观察到的具有丰富花球的形貌相对应,其BET比表面积为113.2 m2/g。

图4 2种晶型MnO2的等温吸附脱附曲线
2.2 重金属吸附性能
图5为2种晶型的MnO2对3种常见重金属的吸附性能。从图5可见,2种晶型的MnO2对3种重金属Pb2+、Cr6+、Zn2+都具有一定的吸附能力。这是因为MnO2的等电点在2左右,当环境的pH高于等电点时(本实验pH=5),MnO2的表面被羟基覆盖而呈现电负性[15],因此可以吸附带正电的重金属离子。但是它们的吸附能力不尽相同,其递变次序为Pb>Cr>Zn。Bir-MnO2对重金属的吸附性能优于α-MnO2,Pb2+、Cr6+、Zn2+的 最 大 吸 附 容 量 分 别 为 210、162、102 mg/g。 究 其 原 因 :1)Bir-MnO2的 表 面 积(113.2 m2/g)远大于 α-MnO2(48.6 m2/g),较大的表面积意味着其具有更优的吸附能力;2)从SEM照片可见,Bir-MnO2是由纳米片组装成的三维花状形貌,具有丰富的孔道结构,与α-MnO2纳米棒相比,孔道结构有利于重金属吸附;3)从微观角度看,Bir-MnO2是层状结构,α-MnO2是2×2隧道结构,层状结构更加有利于吸附。

图5 2种晶型MnO2的对重金属的吸附性能
图6a为不同吸附时间下Bir-MnO2对重金属离子的吸附性能。从图6a可见,Bir-MnO2对液相中重金属离子的吸附量随着时间的延长而增加,在初始时吸附速度最快,20 min后吸附速率变缓,100 min左右达到吸附平衡。这是因为在初始阶段,吸附主要发生在二氧化锰的表面和部分孔道,随着金属离子吸附量的增加,一方面可供吸附的位点减小,另一方面吸附的金属离子之间的排斥力增大,所以吸附的速度降低。
吸附饱和后,离心回收Bir-MnO2,用醋酸和纯净水充分洗脱去除吸附的Pb2+,干燥后再次进行重金属吸附。图6b为Bir-MnO2对Pb吸附的循环使用性能。从图6b可见,Bir-MnO2至少可以维持3次吸附脱附循环,其性能未见明显降低。这表明Bir-MnO2具有良好的稳定性。
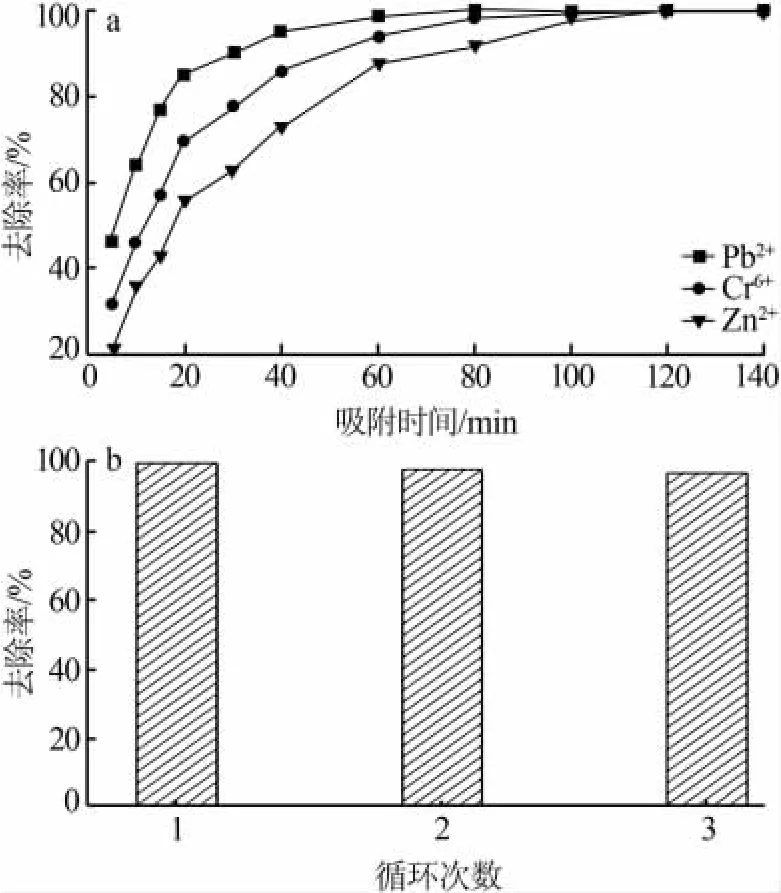
图6 不同吸附时间下Bir-MnO2的重金属吸附性能(a)与循环使用性能(b)
3 结论
分别在100℃和室温条件下以不同原料制备了α-MnO2纳米棒和Bir-MnO2纳米三维花。与α-MnO2纳米棒相比,Bir-MnO2具有更大的比表面积和更丰富的孔道结构,因而表现出更佳的重金属离子的吸附性能,对水中的Pb2+、Cr6+和Zn2+的最大吸附容量分别为 210、162、102 mg/g。 Bir-MnO2还表现出良好的循环性能,能够维持至少3次吸附/脱附循环,而其性能未见明显降低。
[1]杨瑞香.水体重金属污染来源及治理技术研究进展[J].资源节约与环保,2016(4):66.
[2]陈玉洁,韩凤兰,罗钊.镁渣固化/稳定污酸渣中重金属铜和镉[J].无机盐工业,2017,47(7):48-51.
[3]税永红,李前华,唐欢.吸附法处理重金属废水的研究现状及进展[J].成都纺织高等专科学校学报,2016,33(2):207-213.
[4]王歌,赵晓昱,张瑾,等.不同晶型二氧化锰的可控制备条件研究[J].无机盐工业,2017,49(8):16-20.
[5]徐斌,余林,叶文锦,等.不同形貌二氧化锰的制备及其电化学性能研究[J].无机盐工业,2017,49(10):42-45,56.
[6]史丹丹,许乃才.纳米二氧化锰的低温水热制备及其吸附性能[J].无机盐工业,2015,47(10):65-68.
[7]范拴喜.活性二氧化锰的制备及对亚甲基蓝脱色研究[J].无机盐工业,2009,41(11):15-17.
[8]王春雨,侯永江,刘璇,等.不同晶型二氧化锰催化臭氧化降解亚甲基蓝废水[J].环境工程学报,2017(2):908-914.
[9]王昶,王希,翟炎龙,等.离子筛MnO2·0.4H2O的固相法制备及特性研究[J].无机盐工业,2014,46(10):18-22.
[10]黄一帆,于志红,廉菲,等.纳米二氧化锰对水中Cu2+和Cd2+的吸附特性[J].环境工程技术学报,2016,6(4):350-356.
[11]杨威,刘灿波,余敏,等.微污染水源水中重金属镉的去除[J].化工学报,2014,65(3):1076-1083.
[12]Peng L,Zeng Q R,Tie B Q,et al.Manganese dioxide nanosheet suspension:A novel absorbent for cadmium(Ⅱ)contamination in waterbody[J].Journal of Colloid&Interface Science,2015,456:108-115.
[13]Du Y C,Zheng G W,Wang J S,et al.MnO2,nanowires in situ grown on diatomite:Highly efficient absorbents for the removal of Cr(Ⅵ)and As(Ⅴ)[J].Microporous&Mesoporous Materials,2014,200:27-34.
[14]Sing K S W.Reporting physisorption data for gas/solid systems with special reference to the determination of surface area and porosity[M]∥Handbook of heterogeneous catalysis.NY:John Wiley and Sons,Inc.,2009:603-619.
[15]Zhao D L,Yang X,Zhang H,et al.Effect of environmental conditions on Pb(Ⅱ) adsorption on β-MnO2[J].Chemical Engineering Journal,2010,164(1):49-55.

