盐穗木miR167d和预测靶基因ARF8在盐胁迫下的表达与相关性分析
张慧珍,黄世平,杨瑞瑞,曾幼玲
(新疆大学生命科学与技术学院/新疆生物资源基因工程重点实验室,乌鲁木齐 830046)
0 引 言
【研究意义】盐胁迫影响植物生长和作物的产量。在应对盐胁迫过程中,植物通常会采用不同的机制来避免盐离子过度累积造成的损伤[1]。在这错综复杂的分子调控网络中,miRNA对靶基因的调控就是其中的一种。【前人研究进展】miRNA是一类长度约为21 nt的非编码小RNA。它们能够直接对mRNA进行切割或者阻止其翻译,在转录后水平调控编码基因的表达[2, 3]。鉴定miRNA与靶基因间的靶向关系,一方面,通过生物信息学获得miRNA预测的靶基因,另一方面设计试验进一步鉴定miRNA与这些潜在靶基因的关系。研究方法主要包括:(1) 利用qRT-PCR验证miRNA与靶基因的负相关性,即在靶基因与miRNA的转录水平看两者的表达是否存在调控关系[4];(2) 5′ RLM-RACE分析miRNA与靶基因的靶向切割位点,能直接证明miRNA对靶基因的靶向切割关系[5, 6];(3) 将靶基因与GFP或GUS等报告基因融合,通过烟草瞬时表达体系,直观地验证miRNA与靶基因的互作关系[7, 8]。miRNA在植物中具有高度保守性、时序性和组织特异性,在各种生物学进程中都扮演着重要角色,miR167是作用于生长素信号通路上的一类miRNA,它通过靶向ARFs来调控下游生长素响应基因的转录。有文献报道,miR167主要靶向的是ARF6和ARF8两个成员[9, 10]。最近的研究表明,在植物的生长发育中,ARF6和ARF8参与雌蕊群和雄蕊群的发育,其过表达会促进雌、雄蕊的发育或导致植物早熟[9-12]。牵牛(Ipomoea.nil)开花时期miR167表达量最低,ARF8的表达量却是最高的,二者的表达模式呈现负相关性。大豆miR167c在根部表达上调,通过靶向GmARF8a和GmARF8b直接调控根瘤的数目[13]。Jodder等[14]探究不同胁迫条件下番茄miR167a的表达调控机制,发现真菌或病毒感染及冷胁迫提高了miR167a的表达水平,而盐、旱和热处理导致其下调表达,表明不同的胁迫可能激活了番茄miR167a不同的调控途径。盐胁迫下,miR167在拟南芥[15]和中间锦鸡儿(Caraganaintermedia)[16]中都呈现上调表达,这可能是通过调节ARF的表达,影响植物生长素响应相关基因的转录,减缓了植物的生长和发育,并且通过这种方式提高植物的胁迫耐受性[17]。【本研究切入点】盐穗木(Halostachyscaspica)隶属藜科(Chenopodiaceae)盐穗木属(Halostachys),对盐分适应性极强,能够高度富集Na+和Cl-[18-21]。研究是基于课题组前期构建的高盐胁迫下盐穗木根的小RNA文库数据[22],依据测序拷贝数筛选受盐诱导表达显著下调的miR167d及利用盐穗木转录组数据预测到的靶基因ARF8为研究对象。【拟解决的关键问题】探讨盐胁迫下盐穗木miR167d及预测靶基因ARF8在高盐(600 mmol/L NaCl)胁迫下的表达模式和相关性;同源克隆方法结合RACE技术,克隆获得盐穗木ARF8全长序列并进行生物信息学分析。该文为进一步研究盐穗木miR167d和预测靶基因ARF8的耐盐生物学功能和调控机制奠定基础。
1 材料与方法
1.1 材 料
盐穗木种子采自新疆古尔班通古特沙漠边缘,培养基质按1∶1∶1 (花土∶珍珠岩∶蛭石)的比例配置。置于温室中生长(25℃,光照时间16 h/d,相对湿度40%),植株生长大约90 d实施盐胁迫处理。600 mmol/L NaCl处理盐穗木0、3、12、24、48、72 h (自来水浇灌的盐穗木作为对照),取其同化枝为试验材料,液氮速冻并保存于-80℃冰箱用于后续的基因表达荧光定量试验。
烟草种子播种于花盆中,培养基质按2∶1∶1(花土∶珍珠岩∶蛭石)配制,置于温室中生长(25℃,光照时间16 h/d,相对湿度40%),每周浇一次自来水。
1.2 方 法
1.2.1 RNA提取
RNA的提取步骤参照北京天根Plant Total RNA提取试剂盒的操作说明。
1.2.2 盐穗木miR167d与ARF8的反转录及荧光定量PCR
利用polyA加尾法对total RNA进行反转录合成cDNA。按照TaKaRa公司SYBR®PrimeScriptTMmiRNA RT-PCR Kit进行miRNA的荧光定量实验。
按照M-MLV Reverse Transcriptase试剂盒(TaKaRa)和Oligo(dT)18 primer等反转录试剂合成cDNA用于定量分析。按照SYBR®Select Master Mix(Applied Biosystems)操作说明进行靶基因的荧光定量试验。ABI 7500荧光定量PCR仪进行荧光定量实验,用2-△△Ct方法计算miRNA和靶基因的相对表达量,Prism5.0分析并作图。
按照SMARTerTM RACE cDNA (Clontech)扩增试剂盒,以RNA为模板反转录合成5'-RACE-Ready-cDNA和3'-RACE-Ready-cDNA,用于靶基因RACE实验。
1.2.3 盐穗木预测靶基因ARF8的克隆、理化性质及同源分析
分别以5'-RACE-Ready-cDNA和3'-RACE-Ready-cDNA为模板进行PCR扩增。PCR产物回收后,经连接、转化,测序鉴定正确后,通过拼接,获得全长序列,进而设计引物(HcARF8-P1;HcARF8-P2 ),扩增HcARF8的全长序列(引物序列信息见表1)。NCBI Conserved Domain Search(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)在线预测其保守性,分析盐穗木ARF8蛋白质的保守结构域。表1
1.2.4 农杆菌注射法转化烟草叶片
利用盐穗木转录组数据未找到其miR167d前体。通过盐穗木和拟南芥的miR167d成熟体比对分析发现仅存一个碱基的差异,推测拟南芥miR167d的成熟体可能对盐穗木miR167d预测的靶基因同样存在靶向切割,故分别构建可能包含有拟南芥miR167d剪切位点的pCAMBIA1301-HcARF8-GFP和pCAMBIA2300-AtmiR167d相关的植物表达载体,转化农杆菌EHA105,鉴定正确后,拟通过烟草瞬时表达实验鉴定拟南芥miR167d对盐穗木ARF8是否具有靶向作用。
将鉴定正确的农杆菌EHA105单菌液培养至OD600为0.8~1.0,12 000 r/min离心1 min,收集菌细胞,用重悬液[10 mmol/L MES-KOH,10 mmol/L MgCl2,0.1 mmol/L乙酰丁香酮(acetosyringone )]重悬,单菌液OD600调为0.5,混合菌液OD600调为1.0,室温静置4 h;用去掉针头的1 mL注射器吸取菌液,用注射器针头在叶片上轻轻划出小孔,用装有菌液的注射器压住小孔,慢慢用力,将菌液分别或共转入生长状态良好、健壮的烟草叶片(避开叶脉)中;3~5 d后撕取叶片下表皮,于Nikon ECLIPSE Ti荧光显微镜下观察。
表1 试验所用引物序列
Table 1 Primer sequences used in the experiments

名称Name引物Primer 引物序列 (5’-3’)Primer sequences (5’-3’)qRT-PCRRmiR167dTGAAGCTGCCAGCATGATCTGRHcARF8-P1/P2TGGTCCTTGGGAGGCATTCTTG/CTTGAAGAGGGTATGCGGGGATHc5S rRNA-P1/P2ACCCGATCCCATTCCGAC/TGTCTCCCGAACAATCTCAGTACHcβ-actin-P1/P2AAGATCTGGCACCACACCTTC/CACACCATCACCAGAATCGAHcARF8HcARF8-P1/P2ATGAAGCTTTCAACATCAGGATTG/GTACGTCTCAGTCCCTTGCTTCCHcARF8 5'RACE-OuterGACCATCTCCAAGGAGAAGTACATCATTCHcARF8 5'RACE-InnerCTCCCTGTCGACAAATACAAGCTGCCAGHcARF8 3'RACE-OuterGTTGGGGAAGCAAGGGACTGAGACGTACHcARF8 3'RACE-InnerAGACCATATCCCCGCATACCCTCTTCUPM (Long)CTAATACGACTCACTATAGGGCAAGCAGTGGTATCAACGCAGAGTUPM (Short)CTAATACGACTCACTATAGGGCNUPAAGCAGTGGTATCAACGCAGAGT烟草瞬时实验pCAMBIA2300-AtmiR167d-P1 (SacI)GAGCTCTGTTGGTTTTTAGAAGCTGAAGCpCAMBIA2300-AtmiR167d-P2 (BamHI)CTGCAGTGTTGGTGATTTAGTGACTGAAGpCAMBIA1301-HcARF8-GFP-P1 (SacI)GAGCTCATGTCCCGGTTCAGCAGCTATCATGpCAMBIA1301-HcARF8-GFP-P2 (PstI)GGATCCGTACGTCTCAGTCCCTTGCTTCC
2 结果与分析
2.1 盐穗木miR167d与靶基因的靶向预测
根据靶向关系的基本原则[23, 24],利用高盐胁迫下盐穗木根的小RNA文库和转录组数据信息分析,盐穗木miR167d预测的靶基因为盐穗木ARF8,其作用的靶位点靠近编码区3'端位置。盐穗木miR167d成熟体与拟南芥miR167各成员的成熟体比对有1~4个碱基的差异。图1

图1 盐穗木miR167d的靶基因预测(A)以及与拟南芥miR167各成员成熟体的比对(B)
Fig.1 Predicting target gene ofHalostachyscaspicamiR167d (A) and alignmenting with AtmiR167 family members (B)
2.2 盐胁迫下盐穗木miR167d与其预测靶基因HcARF8的表达模式
qRT-PCR检测到盐穗木miR167d和ARF8都受到600 mmol/L NaCl高盐胁迫的诱导。高盐胁迫处理48 h,盐穗木同化枝miR167d显著上调表达并与HcARF8呈现显著的负相关性。HcARF8的表达随着盐胁迫时间的延长呈现先上升后下降的趋势。同时,结合生物统计学软件(IBM SPSS Statistics V19)对盐穗木miR167d及其靶基因ARF8进行了相关系数分析。图2,表2

注:差异极显著***/**(P<0.01);差异显著*(P<0.05)
Note:P<0.01 was extremely significant (***/**) andP<0.05 was significant (*)
图2 600 mmol/L NaCl处理盐穗木同化枝miR167d (A)及其预测靶基因HcARF8 (B)的相对表达模式 (C)
Fig.2 The relative expression of miR167d (A) and its predictive target geneARF8 (B) at the treatment of 600 mmol/L NaCl in theHalostachyscaspicabranches (C)
表2 高盐胁迫处理盐穗木同化枝miR167d与预测靶基因ARF8的相关性分析
Table 2 Correlation analysis on miR167d and its target geneARF8 at the treatment of 600 mmol/L NaCl in theHalostachyscaspicabranches

处理TreatmentR2P值P value 显著水平Significant3 h (600 mmol/L NaCl )0.7230.1045ns48 h (600 mmol/L NaCl)-0.94570.0043**600 mmol/L NaCl-0.80440.0292*
注:差异极显著**(P<0.01);差异显著*(P<0.05)
Note:P<0.01 was extremely significant (**) andP<0.05 was significant (*)
2.3 烟草瞬时表达体系鉴定拟南芥miR167d对盐穗木ARF8的靶向作用
选取包含miR167d靶位点的盐穗木ARF8片段(252 bp)和AtmiR167d(377 bp)分别构建到植物表达载体pCAMBIA1301-GFP和pCAMBIA2300上,转化农杆菌EHA105,单独及同时注射烟草叶片,用荧光显微镜观察瞬时转化后烟草表皮中GFP融合蛋白的表达情况。转化了pCAMBIA1301-HcARF8-GFP后,在激发光的作用下,烟草细胞中有绿色荧光,位于保卫细胞气孔周围(图3A, B);而将pCAMBIA1301-HcARF8-GFP与pCAMBIA2300-AtmiR167d同时转入烟草叶片后,表皮细胞中无绿色荧光(图3C, D),这些都以野生型为对照(在明场、荧光场中均无荧光)(图3E, F)。图3
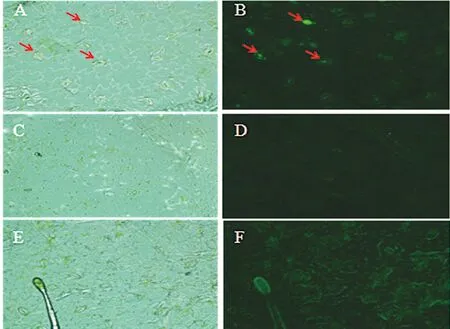
注:A, B分别为转化pCAMBIA1301-HcARF8-GFP的明场及荧光场下的烟草表皮细胞;C, D分别为转化pCAMBIA1301-HcARF8-GFP与pCAMBIA2300-AtmiR167d的明场及荧光场下烟草表皮细胞;E, F分别为野生型烟草明场及荧光场下的表皮细胞
Note: The tobacco epidermal cells were detected under the bright field and the fluorescent field by the observation of fluorescence microscope, which were transformedHcARF8-GFP fused gene with the plant expression vector pCAMBIA1301byagrobacteriummediated method (A, B),HcARF8-GFP andAtmiR167d with the vector pCAMBIA1301and pCAMBIA2300 by the same method (C, D) and those of wild type ( E, F), respectively
图3 烟草瞬时转化体系鉴定拟南芥miR167d与盐穗木生长素响应因子ARF8的靶向作用
Fig.3 Targeting verification ofArabidopsismiR167d andHalostachyscaspicaauxin response factorARF8 using tobacco transient expression system
2.4 盐穗木生长素信号通路中靶基因ARF8的克隆
利用RACE方法克隆获得了盐穗木miR167d预测的靶基因ARF8序列,全长为2 861 bp,ORF 2 442 bp,编码813个氨基酸。盐穗木ARF8推测的氨基酸序列与同科植物甜菜(Betavulgaris)ARF8的同源性最高,达到87%。
NCBI Conserved Domain Search (http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)对其保守性进行预测,含有能与B3 DNA绑定元件、生长素响应元件,生长素诱导转录IAA超家族的元件结合的结构域,表明该蛋白是生长素响应因子。图4

图4 盐穗木ARF8全长基因的克隆(A)及编码蛋白结构域的预测(B)
Fig.4 Cloning ofHalostachyscaspicaARF8 full length gene (A) and predictive structure domain of this speciesARF8 (B)
3 讨论
盐穗木是一种荒漠极端耐盐植物,其茎叶已高度肉质化[25]。很多研究报道miR167调控生长素信号通路中的ARF基因,它作为一个调节子参与信号通路的调控,不仅调节植物的生长发育,还调控植物应对各种环境胁迫[9, 10, 13, 17]。实验主要开展了高盐胁迫下盐穗木同化枝miR167d及其靶基因ARF8的表达模式以及相关性研究。
该文从前期获得的高盐胁迫下盐穗木根的小RNA文库和转录组数据中生物信息学分析miR167d与预测的靶基因具有一定的靶向性。NaCl高盐胁迫real-time PCR的检测结果显示了盐穗木同化枝miR167d表达显著上调,Liu等[15]和Zhu等[16]在拟南芥和中间锦鸡儿中也发现类似的miR167上调表达的情况。对高盐浓度不同时间点胁迫处理的盐穗木,其同化枝中miR167d与其靶基因的表达呈现极显著的负相关性 (表2和图2)[4]。拟南芥miR167d与盐穗木miR167d成熟体仅存在一个碱基的差异,烟草瞬时表达实验的结果显示拟南芥miR167d对盐穗木ARF8起到了剪切作用,这个结果间接地能推断盐穗木miR167d对其预测的靶基因HcARF8存在靶向切割,这与之前相关文献中的报道[7, 8, 26]相一致。
根据前期课题组获得的miR167d的靶基因ARF8转录组的序列信息,通过RACE的方法,获得了HcARF8基因的全长序列(2 861 bp),NCBI在线BLAST发现HcARF8编码的氨基酸序列与同科植物甜菜的同源性达到87%,盐穗木ARF8存在能与生长素相关的元件(B3 DNA绑定元件、生长素响应元件,生长素诱导转录IAA超家族的元件)结合的结构域,这也进一步证实了该序列就是HcARF8。这些结果为进一步研究盐穗木miR167d和靶基因HcARF8之间的调控和生物学功能奠定基础。
4 结 论
以高盐(600 mmol/L NaCl)处理48 h盐穗木根的小RNA文库中筛选到差异表达的miR167d和从转录组数据中预测到其靶基因HcARF8作为研究对象。荧光定量PCR试验证明高盐胁迫下盐穗木同化枝中miR167d和预测靶基因均响应高盐胁迫,且胁迫48 h时,二者的表达量呈现显著的负相关性,结合烟草瞬时表达试验的结果可以推断盐穗木miR167d与盐穗木ARF8存在靶向关系;进而利用同源克隆方法结合RACE技术获得了盐穗木miR167d的靶基因HcARF8的全长序列(2 861 bp),生物信息学分析与同科植物种甜菜ARF8同源性达到87%,都具有与生长素相关元件结合的功能域。
参考文献(References)
[1] Munns, R. (2005). Genes and salt tolerance: bringing them together.NewPhytologist, 167(3): 645-663.
[2]Zhang, B. , Pan, X. , Cobb, G. P. , & Anderson, T. A. (2006). Plant microrna: a small regulatory molecule with big impact.DevelopmentalBiology, 289(1): 3-16.
[3] Jones-Rhoades, M. W. , Bartel, D. P. , & Bartel, B. (2006). Micrornas and their regulatory roles in plants.AnnualReviewOfPlantBiology, 57(1): 19-53.
[4] Chai, J. , Feng, R. , Shi, H. , Ren, M. , Zhang, Y. , & Wang, J. (2015). Bioinformatic identification and expression analysis of banana micrornas and their targets.PLOSONE, 10(4): e0123083.
[5] Suzuki, Y. , & Sugano, S. . (2003). Construction of a full-length enriched and a 5'-end enriched cdna library using the oligo-capping method.MethodsMolBiol, (221): 73-91.
[6]Ding, Q. , Zeng, J. , & He, X. Q. (2014). Deep sequencing on a genome-wide scale reveals diverse stage-specific micrornas in cambium during dormancy-release induced by chilling in poplar.BMCPlantBiology, 14(1): 267-279.
[7]Gao, P. , Bai, X. , Yang, L. , Lv, D. , Li, Y. , & Cai, H. , et al. (2010). Over-expression of osa-mir396c decreases salt and alkali stress tolerance.Planta, 231(5): 991-1,001.
[8]Feng, H. , Wang, X. , Zhang, Q. , Fu, Y. , & Kang, Z. (2013). Monodehydroascorbate reductase gene, regulated by the wheat pn-2013 mirna, contributes to adult wheat plant resistance to stripe rust through ros metabolism.BiochimicaetBiophysicaActa(BBA) -GeneRegulatoryMechanisms. 1839(1):1-12.
[9]Wu, Y. F. , Reed, G. W. , & Tian, C. Q. (2006). Arabidopsis microrna167 controls patterns of arf6 and arf8 expression, and regulates both female and male reproduction.Development,133(21): 4,211-4,218.
[10]Glazińska, Paulina, Wojciechowski, W. , Wilmowicz, E. , Zienkiewicz, A. , Frankowski, K. , & Kopcewicz, J. (2014). The involvement of inmir167 in the regulation of expression of its target gene inarf8, and their participation in the vegetative and generative development of ipomoea nil plants.JournalofPlantPhysiology, 171(3-4): 225-234.
[11]Ru, P. , Xu, L. , Ma, H. , & Huang, H. . (2006). Plant fertility defects induced by the enhanced expression of microrna167.CellResearch, 16(5):457-465.
[12]Liu, N. , Wu, S. , Van Houten, J. , Wang, Y. , Ding, B. , & Fei, Z. , et al. (2014). Down-regulation of auxin response factors 6 and 8 by microrna 167 leads to floral development defects and female sterility in tomato.JournalofExperimentalBotany,65(9): 2,507-2,520.
[13]Wang, Y. , Li, K. , Chen, L. , Zou, Y. , & Li, X. (2015). Microrna167-directed regulation of the auxin response factors gmarf8a and gmarf8b is required for soybean nodulation and lateral root development.Plantphysiology, 168(3): 984-999.
[14] Jodder, J. , Das, R. , Sarkar, D. , Bhattacharjee, P. , & Kundu, P. (2017). Distinct transcriptional and processing regulations control mir167a level in tomato during stress.RNABiology, 15(1):130-143.
[15]Liu, H. H. , Tian, X. , Li, Y. J. , Wu, C. A. , & Zheng, C. C. (2008). Microarray-based analysis of stress-regulated micrornas in arabidopsis thaliana.RNA, 14(5): 836-843.
[16]Zhu, J. , Li, W. , Yang, W. , Qi, L. , & Han, S. (2013). Identification of micrornas incaragana intermediaby high-throughput sequencing and expression analysis of 12 micrornas and their targets under salt stress.PlantCellReports,32(9):1,339-1,349.
[17]Kumar, R. (2014). Role of micrornas in biotic and abiotic stress responses in crop plants.AppliedBiochemistry&Biotechnology, 174(1):93-115.
[18]Khan, M. A. , & Duke, N. C. (2001). Halophytes - a resource for the future.WetlandsEcologyandManagement, 9(6): 455-456.
[19]Zhao, K. F. , Fan, H. , Song, J. , Sun, M. X. , Wang, B. Z. , & Zhang, S. Q. , et al. (2005). Two na+ and cl? hyperaccumulators of the chenopodiaceae.JournalOfIntegrativePlantBiology, 47(3): 311-318.
[20]Song, J. , Feng, G. , & Zhang, F. (2006). Salinity and temperature effects on germination for three salt-resistant euhalophytes,halostachys caspica,kalidium foliatumandhalocnemum strobilaceum.PlantandSoil, 279(1-2): 201-207.
[21]Zeng, Y. , Li, L. , Yang, R. , Yi, X. , & Zhang, B. (2015). Contribution and distribution of inorganic ions and organic compounds to the osmotic adjustment in halostachys caspica response to salt stress.ScientificReports, 5(1): 13,639.
[22]Yang, R. , Zeng, Y. , Yi, X. , Zhao, L. , & Zhang, Y. (2015). Small rna deep sequencing reveals the important role of micrornas in the halophyter,halostachyscaspica.PlantBiotechnologyJournal, 13(3): 395-408.
[23]Allen, E. , Xie, Z. , Gustafson, A. M. , & Carrington, J. C. (2005). Microrna-directed phasing during trans-acting sirna biogenesis in plants.Cell, 121(2): 207-221.
[24]Schwab, R. , Palatnik, J. F. , Riester, M. , Schommer, C. , Schmid, M. , & Weigel, D. (2005). Specific effects of micrornas on the plant transcriptome.DevelopmentalCell, 8(4):517-524.
[25]杨瑞瑞, 曾幼玲. 盐生植物盐爪爪的耐盐生理特性探讨[J]. 广西植物, 2015,35(3):366-372.
YANG Rui-rui, ZENG You-ling. (2015). Physiological characteristics of the halophytic plantKalidiumfoliatumto salt stress [J].Guihaia, 35(3):366-372. (in Chinese)
[26] Nagpal, P. , Ellis, C. M. , Weber, H. , Ploense, S. E. , & Barkawi, L. S. (2005). Auxin response factors arf6 and arf8 promote jasmonic acid production and flower maturation.Development, 132(18): 4,107-4,118.

