姜黄素对人巨细胞病毒感染人胚肺成纤维细胞后细胞凋亡的影响
贾阳杰 吕亚丽 刘丽宏
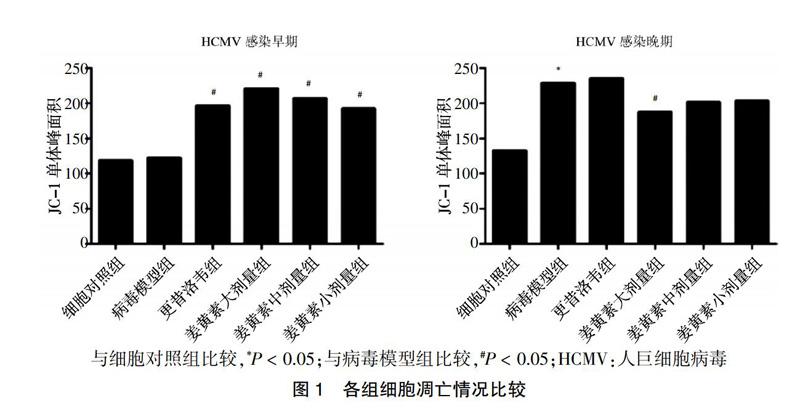

[摘要] 目的 探讨人巨细胞病毒(HCMV)感染人胚肺成纤维细胞后细胞凋亡情况,以及姜黄素对HCMV感染细胞后细胞凋亡的影响。 方法 将细胞分为细胞对照组(细胞维持液),病毒模型組(细胞维持液+HCMV),姜黄素大(细胞维持液+HCMV+姜黄素0.8 μg/mL)、中(细胞维持液+HCMV+姜黄素0.4 μg/mL)、小(细胞维持液+HCMV+姜黄素0.2 μg/mL)剂量组,更昔洛韦组(细胞维持液+HCMV+更昔洛韦50 μg/mL),运用线粒体膜电位检测试剂盒(JC-1)和荧光染料碘化丙啶(PI)法检测姜黄素对HCMV感染的细胞凋亡的影响。 结果 JC-1法实验结果显示:HCMV感染早期,病毒模型组细胞凋亡情况与细胞对照组比较,差异无统计学意义(P > 0.05);与病毒模型组比较,更昔洛韦组和姜黄素大、中、小剂量组细胞凋亡显著增加(P < 0.05)。HCMV感染晚期,与细胞对照组比较,病毒模型组细胞凋亡显著增加(P < 0.05);与病毒模型组比较,姜黄素大、中、小剂量组细胞凋亡均有不同程度降低,其中姜黄素大剂量组与病毒模型组比较差异有统计学意义(P < 0.05)。荧光染料PI法实验结果显示:在HCMV感染早期及晚期,与细胞对照组比较,病毒模型组S期细胞显著增多(P < 0.01);与病毒模型组比较,姜黄素大、中、小剂量组S期细胞均明显减少(P < 0.05)。 结论 姜黄素能够对抗HCMV感染引起的细胞凋亡作用,可使HCMV感染早期诱导的抗凋亡作用和HCMV感染晚期诱导的促凋亡作用减弱。
[关键词] 姜黄素;人巨细胞病毒;细胞周期;细胞凋亡
[中图分类号] R285.5 [文献标识码] A [文章编号] 1673-7210(2018)12(a)-0004-07
细胞凋亡(apoptosis),又称程序性细胞死亡(programmed cell death,PCD)是指细胞主动死亡的现象。机体出现细胞凋亡主要是为了能够保持组织、器官的正常形态、功能和内环境的稳态[1]。大量实验研究发现,机体感染人巨细胞病毒(HCMV)后产生的临床表现,跟PCD的发生密切相关[2]。
HCMV是β疱疹病毒亚科的双链线状DNA病毒。在大多数发达国家,大约50%的成年人既往感染HCMV,在世界发展中地区,HCMV感染在大龄儿童和成年人群中甚至高达90%~100%[3]。HCMV一旦侵入人体将长期或终身存在于体内,正常人一般为潜伏感染或无症状的亚临床感染,而在放化疗后、器官移植术后的肿瘤患者等免疫功能不全或低下的易感人群中,感染HCMV后常常引起多系统的病变,甚至造成致死性的危险[4]。
研究发现,HCMV感染后,机体的免疫系统并不能将其全部消灭清除,并且HCMV还可以潜伏于细胞中[5]。HCMV与PCD密切相关且两者之间的联系较为复杂,研究者发现,HCMV感染后,在不同的条件下,既可表现为抑制细胞的凋亡,也可表现为加快细胞的凋亡[6]。姜黄素是从姜黄属中提取出的一种酚性色素,具有抗炎、抗氧化、抗肿瘤、抗病毒等药理作用。故本研究拟通过运用线粒体膜电位检测试剂盒(JC-1)和荧光染料碘化丙啶(PI)的方法来探讨HCMV感染人胚肺成纤维细胞后细胞凋亡情况,以及姜黄素对HCMV感染细胞后细胞凋亡的影响。
1 材料与方法
1.1 病毒及细胞
HCMV AD169株由华中科技大学同济医学院附属同济医院妇科和儿科临床病毒研究室提供。人胚肺成纤维细胞(HELF株)购自国家实验细胞资源中心,实验所用细胞为20~25代细胞。
1.2 药物
注射用更昔洛韦(GCV)(美国Sigma公司,货号:Y0001129);姜黄素单体(批号:062-20170321,含量99.116%)由首都医科大学附属北京朝阳医院(以下简称“我院”)药事部自制;姜黄饮片来自江西江中中药饮片有限公司,由我院中草药房药师鉴定为真品,批号:160801,GMP证号:赣JX20120017。
1.3 主要试剂及仪器
MEM培养基购自美国HyClone公司;二甲基亚砜(DMSO)、胎牛血清(FBS)、胰蛋白酶、青霉素G(Penicillin G)、Hank′s液、链霉素(Streptomycin)、羟乙基哌嗪乙硫磺酸(HEPES)均购自美国Sigma-Aldrich公司;JC-1购自北京泛博生物化学有限公司;PI染色液购自美国Sigma公司;流式细胞仪购自美国BD公司。细胞培养液为MEM培养基+Penicillin G(100 U/mL)+Streptomycin(100 μg/mL)+10%FBS。细胞维持液为MEM培养基+Penicillin G(100 U/mL)+Streptomycin(100 μg/mL)+2%FBS。
1.4 JC-1法检测细胞凋亡
将HELF细胞在96孔板中培养成单层细胞,将细胞分为六组,分别为细胞对照组(细胞维持液),病毒模型组(细胞维持液+HCMV),姜黄素大剂量组(细胞维持液+HCMV+姜黄素0.8 μg/mL)、中剂量组(细胞维持液+HCMV+姜黄素0.4 μg/mL)和小剂量组(细胞维持液+HCMV+姜黄素0.2 μg/mL)、更昔洛韦组(细胞维持液+HCMV+GCV 50 μg/mL),更昔洛韦为阳性对照药。病毒感染滴度为100 TCID50/孔,细胞孵育箱中培养1 h后去弃去病毒液。将以上六组细胞置于37℃、5% CO2培养箱中培养,分别于感染早期(≤12 h)和感染晚期(≥48 h)收集细胞,依据试剂盒说明书操作,进行细胞凋亡检测。实验过程至少进行3次。
1.5 流式细胞术检测细胞周期
将HELF细胞在96孔板中培养成单层细胞后,同步化培养12 h;约100 TCID50/孔病毒滴度感染细胞,于37℃、5% CO2培养箱中吸附1~2 h,弃上清;细胞对照组和病毒模型组更换维持液继续培养;姜黄素各组终浓度分别为大剂量组(细胞维持液+HCMV+姜黄素0.8 μg/mL)、中剂量组(细胞维持液+HCMV+姜黄素0.4 μg/mL)和小剂量组(细胞维持液+HCMV+姜黄素0.2 μg/mL);更昔洛韦组(细胞维持液+HCMV+GCV 50 μg/mL)。置于37℃、5% CO2培养箱中培养,分别于感染早期(≤12 h)和感染晚期(≥48 h)收集细胞。将收集的细胞制成单层细胞悬液,用预冷的PBS漂洗2次,1000 r/min离心5 min,加入预冷的70%乙醇,于4℃固定过夜后,PBS洗涤,离心后去除固定液,加PI染色液(含50 μg/mL PI、100 μg/mL RNase A、0.2% Triton X-100)置于4℃避光孵育30 min后即可进行细胞周期分析。实验过程至少进行3次。
1.6 统计学方法
应用SPSS 21.0统计软件处理数据,计量资料以均数±标准差(x±s)表示,采用单因素方差分析(One-way ANOVA),两两比较采用LSD-t法和Dunnett-t法。以P < 0.05为差异有统计学意义。
2 结果
2.1 各组细胞凋亡情况比较
HCMV感染早期,病毒模型组与细胞对照组的细胞凋亡情况比较,差异无统计学意义(P > 0.05);与病毒模型组比较,更昔洛韦组和姜黄素大、中、小剂量组细胞凋亡明显增加(P < 0.05)。HCMV感染晚期,与细胞对照组比较,病毒模型组细胞凋亡明显增加(P < 0.05);与病毒模型组比较,姜黄素大、中、小剂量组细胞凋亡均有不同程度降低,其中姜黄素大剂量组与病毒模型组比较差异有统计学意义(P < 0.05)。见图1。
2.2 不同感染时期各组细胞周期情况比较
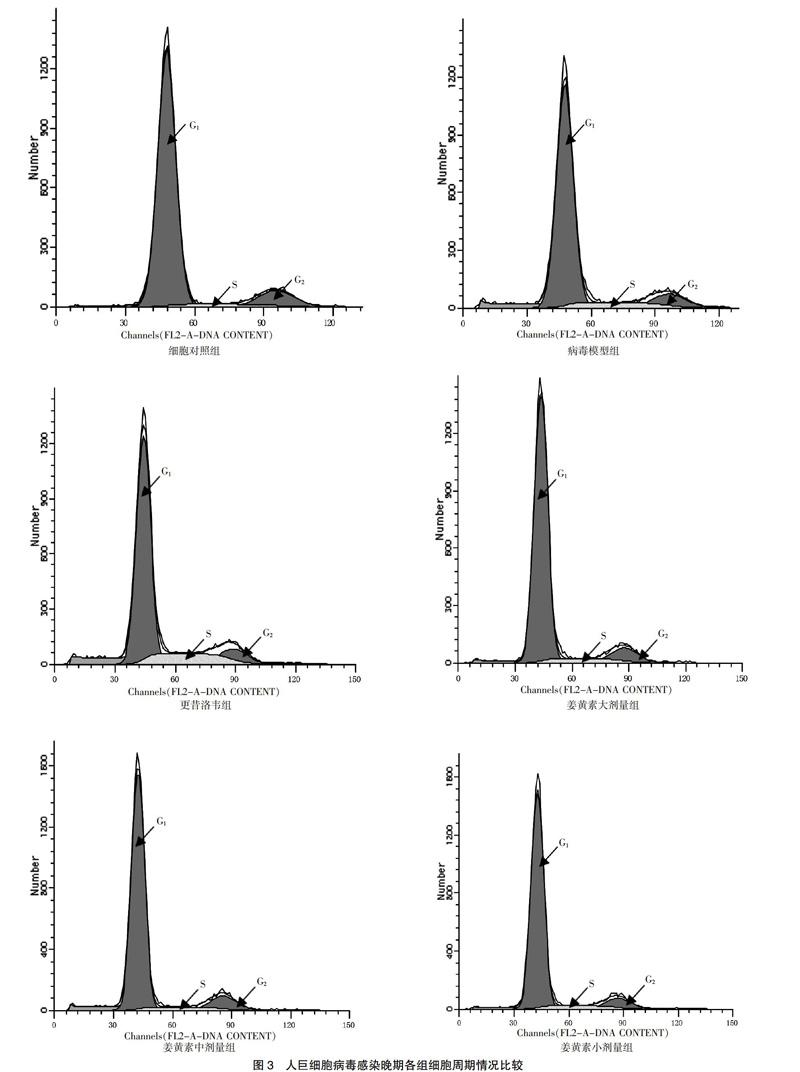
在HCMV感染早期及晚期,与细胞对照组比较,病毒模型组S期细胞显著增多(P < 0.01);与病毒模型组比较,姜黄素大、中、小剂量组S期细胞均明显减少,而更昔洛韦组S期细胞明显增多,G0/G1期细胞明显减少(P < 0.05)。见图2~3、表1。
3 讨论
HCMV感染机体后,感染的细胞一般都处于不同的细胞周期。如果HCMV感染了处于G0/G1期的细胞,则细胞只能进入到G1/S期;如果HCMV感染了处于S期的细胞,则细胞会一直处于S期,表现为停滞状态,最终导致细胞的有丝分裂停止[7]。本研究结果显示在HCMV感染早期,病毒模型组S期细胞较细胞对照组明显增多,而处于G0/G1期的细胞较细胞对照组有所减少。随着感染时间延长,宿主细胞均表现为G2/M期细胞有所减少。经过姜黄素干预治疗后,姜黄素各剂量组处于S期细胞均明显少于病毒对照组,G0/G1期细胞均有所增多,细胞凋亡没有增加。
HCMV感染机体后,机体细胞发生凋亡,细胞死亡后机体会清除这些细胞,这是机体抵抗病毒感染对机体造成损伤的一种机制。有研究发现在HCMV感染初期,HCMV为了阻止机体细胞凋亡,会转录表达某些蛋白以阻止细胞凋亡[8],从而保证病毒复制增殖能够顺利进行,病毒的这种适应性为其持续感染创建了有利的环境。机体感染HCMV后,病毒可能是通过作用于一些调节细胞周期的细胞因子从而造成细胞正常周期的改变,比如感染后使细胞内细胞周期蛋白E(cyclin E)的表达上调,使细胞周期蛋白依赖性激酶(CDK)和周期蛋白依赖性激酶抑制因子(CKIs)活性均发生改变等[9]。有研究发现处于S期的二倍体纤维母细胞感染HCMV后细胞表现出周期停滞,并且还出现病理性有丝分裂[10]。Murphy等[11]的实验结果与上述研究结果一致。Lunaldi等[12]研究证实抗HCMV抗体与内皮细胞激活和凋亡有关的分子基因程序的表达有关,可以促进热休克蛋白60(HSP60)的释放,这可能是抗HCMV抗体促凋亡的另一分子机制。黄晨等[13]研究发现,HCMV可以导致人脐静脉血管内皮细胞增殖并且使宿主细胞处于G1期的细胞减少,进而推测HCMV感染可能促进了G0/Gl期细胞进入S期和G2/M期,细胞最终表现为增殖。有研究者发现HCMV感染后,抗凋亡蛋白Bcl-2表达明显增多,运用更昔洛韦进行治疗后,Bcl-2含量明显减少,并且HCMV引起的抗凋作用明显下降[14]。在HCMV病毒感染晚期,病毒对细胞凋亡的抑制作用解除,反而促进细胞发生凋亡,以便病毒释放。细胞感染后HCMV可以潜伏于细胞中,造成免疫系统的长期激活,改变免疫状态,从而引发机体产生多种慢性炎症性疾病[15-16]。HCMV感染机体后患者会表现出视网膜炎,用更昔洛韦治疗此类患者后,视网膜上皮细胞凋亡明显受到抑制。Zhou等[17]发现,与感染前比较,感染HCMV的平滑肌细胞(SMCs)的增殖明显提高。2005年,Reinhardt课题组[18]也得到了相同的实验结果。有研究发现,HCMV感染SMCs后,细胞内p53的含量减少,SMCs的凋亡受到抑制[19]。同时Epstein等[20]也证实了这一点,即HCMV可以调控SMCs p53的基因表达,从而减少SMCs细胞的凋亡。Liao等[21]研究结果进一步表明HCMV感染可以影响内皮细胞和平滑肌细胞的自然凋亡过程。相关研究发现,姜黄素具有显著抗HCMV的作用[22-23],但具体机制不清。本研究发现姜黄素能够对抗HCMV感染引起的细胞凋亡作用,可使HCMV感染早期诱导的抗凋亡作用和HCMV感染晚期诱导的促凋亡作用减弱。
[参考文献]
[1] Wyllie AH,Kerr JF,Currie AR. Cell death:the significance of apoptosis [J]. Int Rev Cytol,1980,68:251-306.
[2] Cinatl J Jr,Scholz M,Doerr HW. Role of tumor cell immune escape mechanisms in cytomegalovirus-mediated oncomodulation [J]. Med Res Rev,2005,25(2):167-185.
[3] 郭麗丽,许红梅.人巨细胞病毒感染的流行病学研究进展[J].国际检验医学杂志,2010,31(10):1131-1133.
[4] Ritter JT,Tang-Feldman YJ,Lochhead GR,et al. In vivo characterization of cytokine profiles and viral load during murine cytomegalovirus-induced acute myocarditis [J]. Cardiovasc Pathol,2010,19(2):83-93.
[5] Frantzeskaki FG,Karampi ES,Kottaridi C,et al. Cytomeg-alovirus reactivation in a general,nonimmunosuppressed intensive care unit population:Incidence,risk factors,associations with organ dysfunction,and inflammatory biomarkers [J]. J Crit Care,2015,30(2):276-281.
[6] Reuter JD. Cytomegalovirus induces T-cell independent apoptosis in brain during immunodeficiency [J]. J Clin Virol,2005,32(3):218-223.
[7] 刘志峰.巨细胞病毒对细胞周期的影响及其机制[J].国外医学病毒学分册,2002,9(4):104-107.
[8] Sedger LM,Shows DM,Blanton RA,et al. IFN-gamma mediates a novel antiviral activity through dynamic modulation of TRAIL and TRAIL receptor expression [J]. J Immunol,1999,163(2):920-926.
[9] Salvant BS,Fortunato EA,Spector DH. Cell cycle dysregulation by human cytomegalovirus influence of the cell cycle phase at the time of infection and effects on cyclin transcription [J]. J Virol,1998,72(5):3729-3741.
[10] Barsukova AS,Fedorova NE,Medzhidova AA,et al. Effect of cytomegalovirus on cell cycle progression and formation of pathological mitoses in cultured human diploid fibroblasts [J]. Ontogenez,2001,32(1):29-34.
[11] Murphy EA,Streblow DN,Nelson JA,et al. The Human Cytomegalovirus IE86 Protein Can Block Cell Cycle Progression after Inducing Transition into the S Phase of Permissive Cells [J]. J Virol,2000,74(15):7108-7118.
[12] Lunardi C,Dolcino M,Peterlana D,et al. Endothelial Cells Activation and Apoptosis Induced by a Subset of Antibodies against Human Cytomegalovirus:Relevance to the Pathogenesis of Atherosclerosis [J]. PLoS One,2007,2(5):e473.
[13] 黄晨,张荣怀,王晓明,等.人巨细胞病毒感染对人脐静脉内皮细胞凋亡和周期的影响[J].中国临床康复,2005,9(27):56-58.
[14] Brice?觡o J,de la Torre-Cisneros J,Alvarez-Kindelan A,et al. Antiviral drigs can inhibit lymphocyte apoptosis induced by cytomegalovirus antigens [J]. Transplant Proc,2001,33(1-2):1799-1800.
[15] Popovic M,Smiljanic K,Dobutovic B,et al. Humancytomegalovirus infection and atherothrombosis [J]. J Thromb Thrombolysis,2012,33(2):160-172.
[16] Soderberg-Naucler C. HCMV microinfections in inflammatory diseases and cancer [J]. J Clin Virol,2008,41(3):218-223.
[17] Zhou YF,Yu ZX,Wanishsawad C,et al. The immediate early gene products of human cytomegalovirus increase vascular smooth muscle cell migration,proliferation,and expression of PDGF beta-receptor [J]. Biochem Biophys Res Commun,1999,256(3):608-613.
[18] Reinhardt B,Mertens T,Mayr-Beyrle U,et al. HCMV infection of human vascular smooth muscle cells leads to enhanced expression of functionally intact PDGF beta -receptor [J]. Cardiovasc Res,2005,67(1):151-160.
[19] Speir E,Shibutani T,Yu ZX,et al. Role of reactive oxygen intermediates in cytomegalovirus gene expression and in the response of human smooth muscle cells to viral infection [J]. Circ Res,1996,79(6):1143-1152.
[20] Epstein SE,Speir E,Zhou YF,et al. The role of infection in restenosis and atherosclerosis:focus on cytomegalovirus [J]. Lancet,1996,348(s1):s13-s17.
[21] Liao XH,Dong X,Wu C,et al. Human cytomegalovirus immediate early protein 2 enhances myocardin-mediated survival of rat aortic smooth muscle cells [J]. Virus Res,2014,192:85-91.
[22] Lv Y,An Z,Chen H,et al. Mechanism of Gxe062 resistance to human cytomegalovirus in HELF cells [J]. BMC complement Altern Med,2014,14:284.
[23] Lv Y,Lei N,Wang D,et al. Protective effect of Gxe062 againstcytomegalovirus infection in Balb/c mice [J]. Environ Toxicol Pharmacol,2014,37(3):1140-1147.
(收稿日期:2018-04-24 本文編辑:罗乔荔)

