结直肠癌术后患者腹腔热灌注化疗近期临床疗效分析
张红亮,李松岩,刘帛岩,许晓蕾,刘逸尘,王玉峰,杜晓辉,解放军医学院,北京 0085;解放军6565部队,辽宁锦州 5;解放军总医院 普通外科,北京 0085
世界范围内结直肠癌的发病率居各种恶性肿瘤第3位,死亡率居第4位,是最常见的消化道恶性肿瘤之一[1]。在我国结直肠癌的发病率也呈逐年上升趋势,目前手术切除联合全身化疗仍为结直肠癌的主要治疗方式。但因存在“腹膜-血浆屏障”,静脉化疗时进入腹腔内的药物很少,无法有效清除腹内游离的癌细胞[2]。腹腔热灌注化疗是近年发展起来的一种治疗进展期消化道肿瘤的新技术,可显著控制肿瘤患者腹腔内转移和复发[3-5]。研究证实,正常组织对温度的耐受极限在45.7 ~47℃,可存活1 h,癌组织的耐受极限在40 ~43℃[6]。因此,热灌注联合静脉化疗,一方面因热疗作用消灭肿瘤细胞,另一方面利用化疗药物直接杀灭肿瘤细胞。与传统血液吸收药物相比,腹腔灌注化疗能够使药物直达腹腔内的病灶,腹腔内的药物浓度能够达到血液中药物浓度的上百倍,最大程度杀灭腹腔内的肿瘤细胞和微小肿瘤灶[7]。另外,腹腔内的化疗药物经门静脉吸收后,大量进入肝,形成高血药浓度,抑制肝转移的癌细胞[8]。然而,腹腔热灌注在治疗结直肠癌时能否使患者生存获益尚不可知,本研究旨在探讨腹腔热灌注对患者炎性因子释放、免疫功能状态、肿瘤标记物、围术期相关并发症、治疗期间不良反应及生存情况的影响。
资料和方法
1 资料 收集2016年1月1日- 2017年12月31日解放军总医院普通外科二病区收治的256例结直肠癌患者临床资料,其中男性132例,女性124例,年龄(56.8±10.6)岁。纳入标准:1)年龄≤75岁;2)行腹腔镜结直肠癌根治术;3)结直肠癌诊断均经术后病理证实;4)根据美国癌症联合委员会(AJCC)第7版标准肿瘤分期为Ⅱb期及以上;5)术后行XELOX方案化疗。排除标准:1)患有急慢性感染;2)患有免疫系统疾病;3)急诊手术(梗阻、穿孔等原因);4)长期应用激素;5)术前曾行新辅助化疗。术后行腹腔热灌注化疗联合静脉化疗治疗(联合组)112例,单纯行静脉化疗治疗(化疗组)144例。两组一般情况比较方面,联合组与治疗组性别、年龄、体质量指数(body mass index,BMI)、肿瘤位置、T分期差异均无统计学意义。见表1。
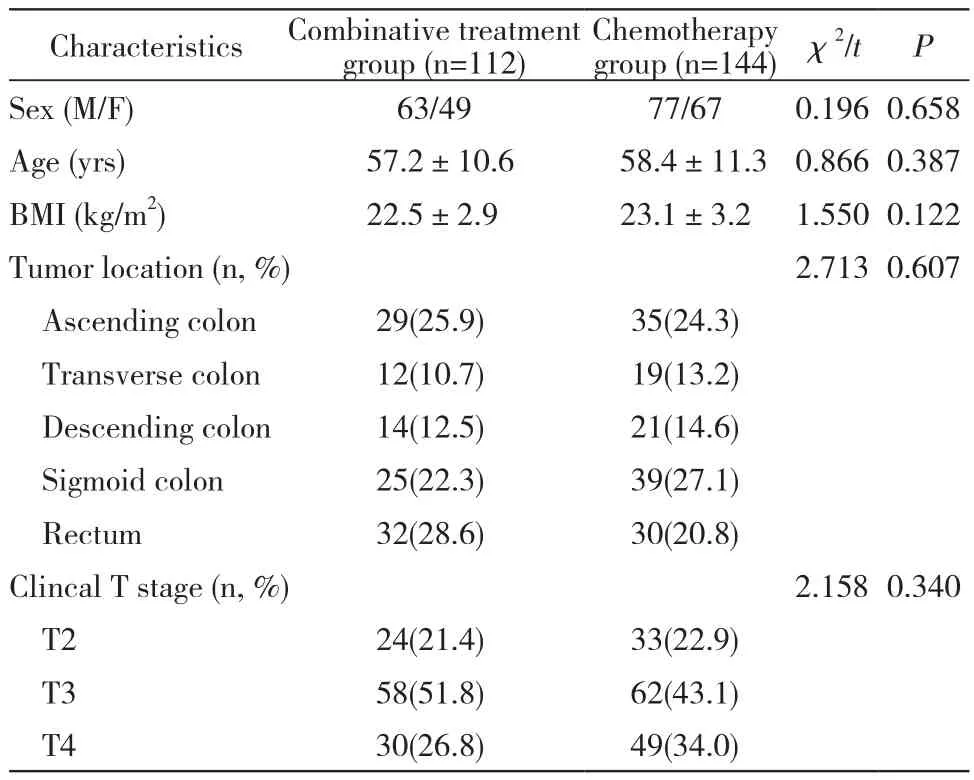
表1 两组结直肠癌患者一般资料比较Tab.1 Comparison of general and clinical characteristics between two groups
2 治疗方法 两组均按照腹腔镜结直肠癌根治手术操作指南(2008版)[9]标准行腹腔镜结直肠癌根治性手术。1)联合组:术中于肝上、脾窝、双侧盆腔留置4根腹腔热灌注管由腹壁引出,分别于手术当天、术后第2、4天行3次腹腔热灌注治疗。具体方案:手术当天将洛铂60 mg加入3 000 ml 0.9%氯化钠注射液,灌注温度控制在(43.0±0.2)℃,灌注时间为1 h。术后第2、4天为氟尿嘧啶1 000 mg加入3 000 ml 0.9%氯化钠注射液,灌注温度控制在(43.0±0.2)℃,灌注时间为1 h。术后3周开始行XELOX方案化疗6 ~ 8周期。2)化疗组:术后3周开始行XELOX方案化疗6 ~ 8周期。
3 检测指标 两组分别于术前、术后第1、3、5天抽取患者的外周静脉血各2 ml,测定TNF-α、CRP、IL-6水平,手术前、术后7 d、行XELOX方案化疗4周期后,抽取患者的外周静脉血各2 ml,流式细胞仪测定CD3+、CD4+、CD8+和CD4+/CD8+水平,采用酶联免疫吸附法检测肿瘤标记物(CA-199,CA-125)水平,电化学发光微粒子免疫分析法检测癌胚抗原(CEA)水平。
4 评价指标 术后首次排气时间、术后首次进流食时间以及术后住院天数、围术期相关并发症、化疗相关不良反应等情况;检测两组术前、术后7 d、完成4个周期XELOX化疗后肿瘤标记物含量和免疫功能变化情况;术后半年局部复发、远处转移及生存情况。
5 统计学方法 采用SPSS23.0软件进行统计分析。计量资料以-x±s表示,均符合正态分布且方差齐。两组比较采用t检验,多时点观测资料则行重复测量方差分析(组间两两比较采用LSD-t检验,时间点两两比较采用差值t检验)。计数资料采用χ2检验。P<0.05为差异有统计学意义。
结 果
1 两组围术期指标比较 联合组术后首次排气时间、术后首次进流食时间以及术后住院天数与化疗组比较无统计学差异(P>0.05),且两组围术期吻合口漏、切口感染、腹腔内出血、肠梗阻无统计学差异(P>0.05)。见表2。
2 两组炎性因子指标比较 两组炎性因子各指标组间、各时间点及交互作用差异均有统计学意义(P均<0.05)。两组患者术前TNF-a、CRP、IL-6均在正在范围内且无统计学差异(P>0.05);术后1 d患者TNF-a、CRP、IL-6明显升高达到峰值,术后3 d、5 d数值开始持续下降,同期相比联合组低于化疗组(P均<0.05)。见表3。
3 两组治疗前及化疗4周期后免疫指标比较 免疫指标与时间无交互作用(P>0.05)。两组术前CD3+、CD4+、CD8+、CD4+/CD8+无统计学差异(P>0.05),在术后7 d及XELOX化疗4周期后,联合组CD3+、CD4+、CD4+/CD8+高于化疗组,而化疗组CD8+高于联合组(P均<0.05)。见表4。
4 两组治疗后肿瘤标记物含量比较 肿瘤标记物各指标组间、各时间点及交互作用多有统计学差异(P<0.05)。术前两组CA-199、CA-125、CEA含量无统计学差异(P>0.05);术后7 d及XELOX化疗4周期后联合组CA-199、CA-125、CEA含量低于化疗组(P均<0.05)。见表5。
5 两组化疗4周期不良反应比较 在治疗过程中出现骨髓抑制、呕吐、腹泻、口腔黏膜炎相关不良反应的频率两组无统计学差异(P均>0.05)。见表6。
6 两组术后半年局部复发、远处转移及生存情况比较 局部复发定义为经影像学或再次手术病理、肠镜检查确定肿瘤位于吻合口及其附近肠管、手术切口和盆腔,远处转移定义为肿瘤位于腹膜、肠系膜、腹主动脉旁和肝、肺、脑等其他组织器官[10]。联合组半年局部复发率低于化疗组(P<0.05),而两组远处转移及生存率无统计学差异(P>0.05)。见表7。
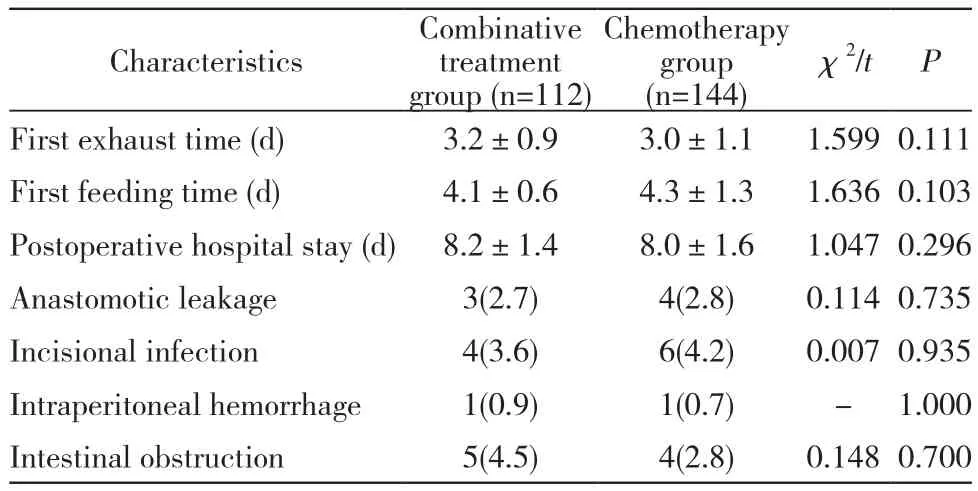
表2 两组围术期情况比较Tab. 2 Comparison of perioperative indicators between two groups
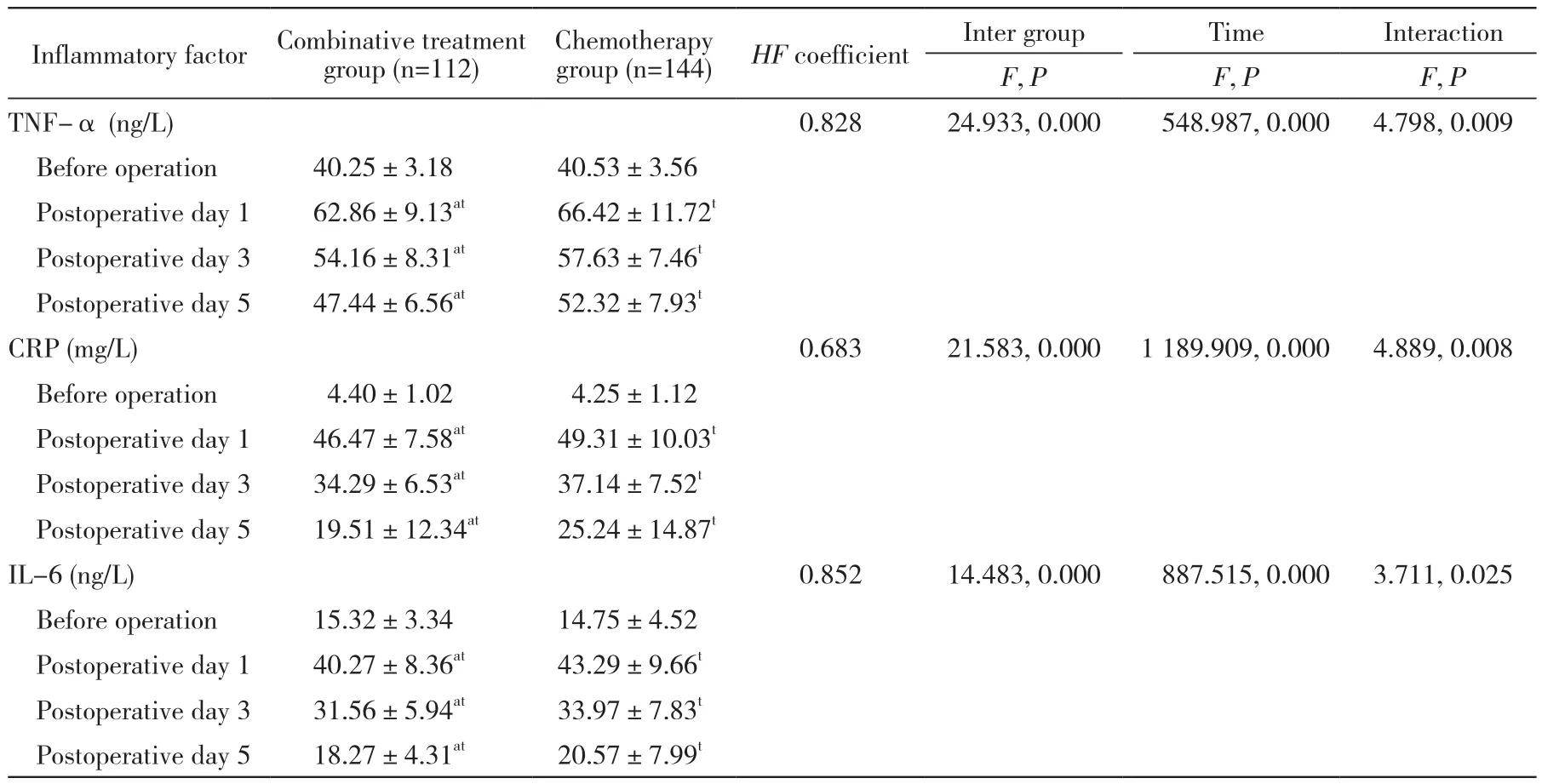
表3 两组炎性因子水平比较Tab. 3 Comparison of inf l ammatory factors between two groups
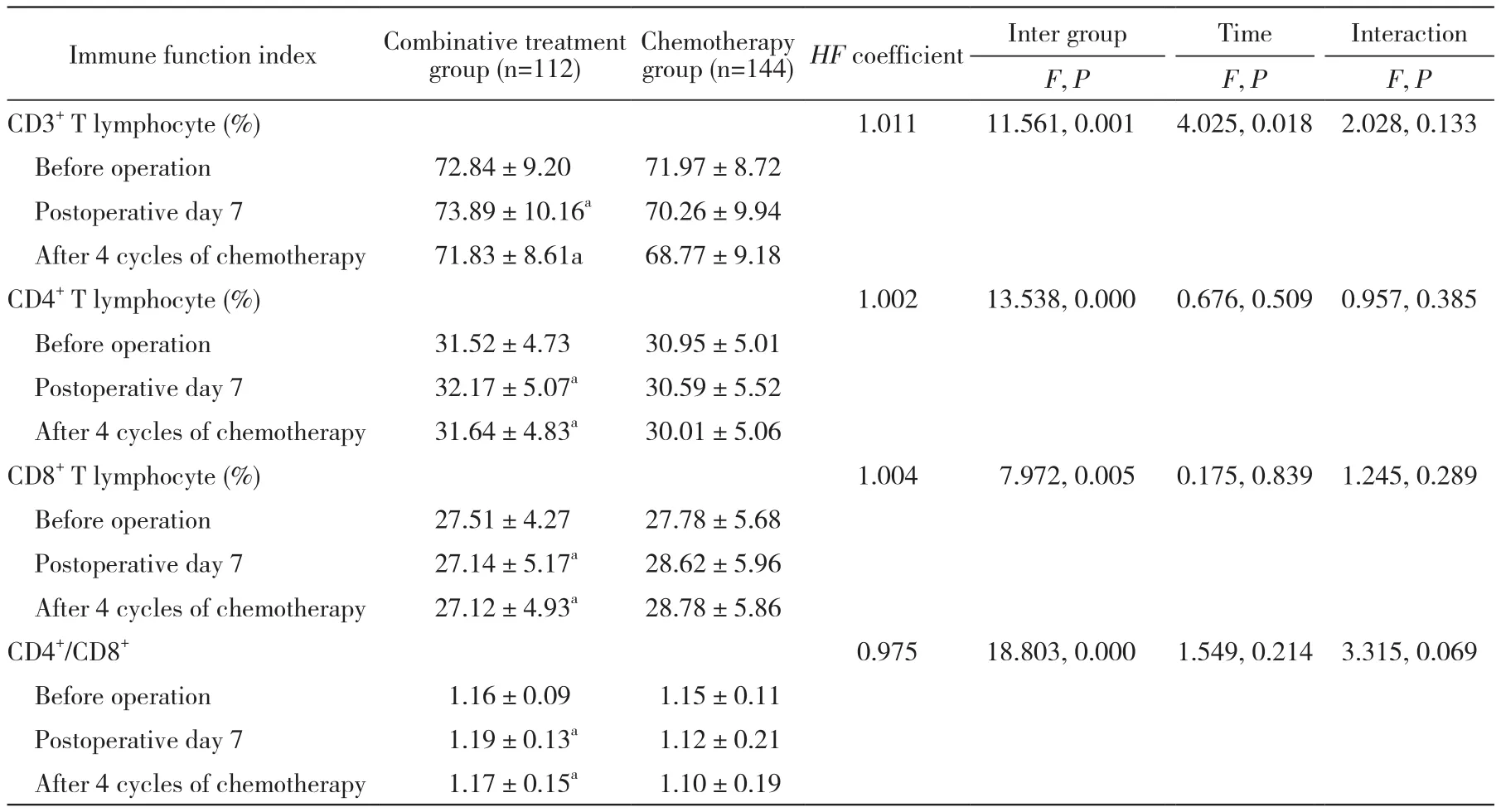
表4 两组免疫功能指标比较Tab. 4 Comparison of immune function indexes between two groups
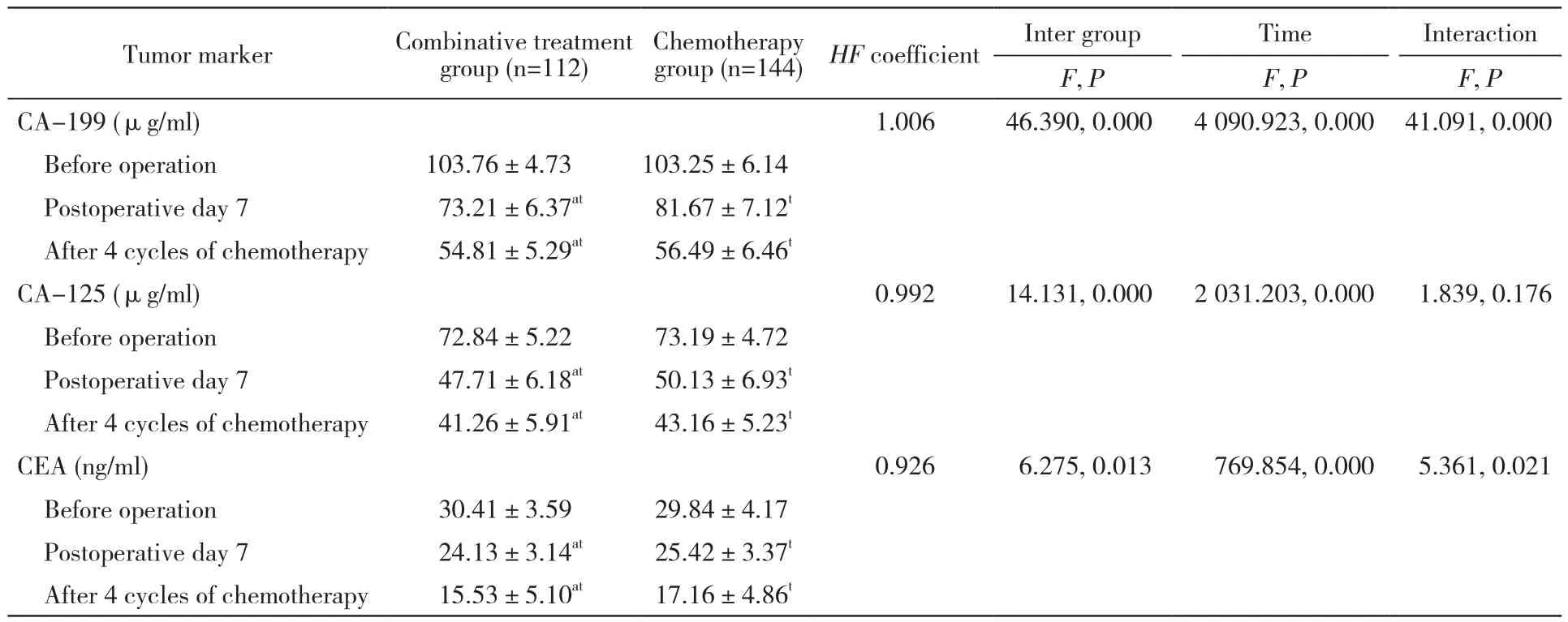
表5 两组肿瘤标记物含量比较Tab. 5 Comparison of tumor markers between two groups
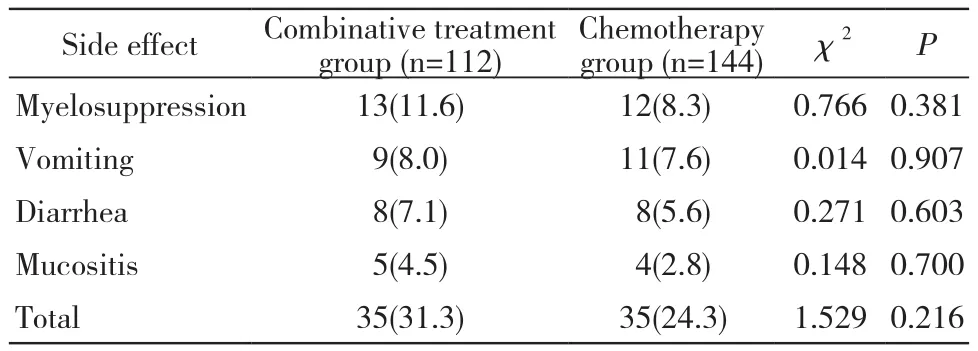
表6 两组患者治疗过程中不良反应的比较Tab. 6 Comparison of side effects between two groups during treatment
讨 论
当机体受到外来刺激(如手术、病原菌感染等)后,机体会出现应激反应,具体包括急性炎症相关蛋白增加、炎性因子增多、激素水平升高以及发热反应等。在机体创伤应激状态下,炎性因子的变化能够有效反映出体内激素、免疫及代谢的变化情况。目前用于监测衡量炎性反应的主要指标包括TNF-α、CRP、IL-6等[11-13]。本研究结果显示,两组患者术前TNF-α、CRP、IL-6均在正在范围内,无统计学差异(P均>0.05);术后1 d患者TNF-α、CRP、IL-6明显升高达到峰值;在术后3 d、5 d数值开始持续下降,同期相比,联合组低于化疗组(P<0.05)。结果表明,手术后两组患者的炎性因子水平均有不同程度升高,且联合组患者TNF-α、CRP、IL-6下降速度明显快于化疗组患者。说明对于结直肠癌术后患者,腹腔热灌注化疗可以减小对机体创伤,引起的炎症和急性期反应程度更低,更有利于患者术后恢复。这可能是由于腹腔热灌注的腹腔灌洗作用,减少腹腔内血性积液的残留,降低了局部感染的发生率。

表7 两组患者局部复发、远处转移及生存情况比较Tab. 7 Comparison of local recurrence, distant metastasis and survival between two groups
细胞免疫是机体免疫系统十分重要的组成部分,在肿瘤免疫中扮演十分重要的角色,手术创伤导致的免疫系统异常和免疫抑制是患者术后并发症发生及肿瘤预后的重要影响因素[14]。Heeren等[15]研究表明患者的免疫功能状态与术后肿瘤复发有一定关联。T细胞是机体细胞免疫的主要细胞和重要组成部分,T淋巴细胞数量和比例的变化能直接反映出机体细胞免疫的功能和状态,CD3+T细胞是外周血中成熟的T细胞,能够体现机体细胞免疫功能状态,CD4+T细胞是辅助性T细胞,CD8+T细胞是细胞毒杀伤性T细胞,能够对肿瘤细胞等进行靶向杀伤。而CD4+/CD8+比值能够反映出机体的免疫功能状态,比值的下降一般说明机体免疫功能下降[16]。本研究结果显示两组术前 CD3+、CD4+、CD8+、CD4+/CD8+无统计学差异(P>0.05),在术后7 d及XELOX化疗4周期后,联合组CD3+、CD4+、CD4+/CD8+高于化疗组,而化疗组CD8+高于联合组(P<0.05)。提示腹腔热灌注联合静脉化疗有助于改善结直肠癌术后患者的免疫功能。这是由于温度增加能够提高肿瘤细胞的抗原性,激活免疫功能,促进细胞免疫应答,同时热疗能够增加癌组织血管内自然杀伤细胞等免疫细胞的浸润,提示热疗或能够提高免疫功能;另外,细胞受热时会启动热休克蛋白基因,合成热休克蛋白,表明热休克蛋白能够特异性地参与肿瘤免疫过程,提升肿瘤抗原活性[17-18]。肿瘤标记物方面,两组患者治疗后CA199、CA125及CEA均较治疗前降低,联合组低于化疗组。CA199是一种消化道肿瘤相关抗原,CA125、CEA在多种恶性肿瘤中均存在表达,伴随着肿瘤细胞的增殖分化,上述3种因子均呈现高表达[19]。本次结果联合组CA199、CA125以及CEA水平均明显降低,说明腹腔热灌注化疗联合静脉化疗疗效较好,肿瘤细胞增殖得到明显抑制。
在围术期方面,联合组术后首次排气时间、术后首次进流食时间以及术后住院天数与化疗组无统计学差异(P>0.05),患者出现的吻合口漏、腹腔内出血、切口感染、肠梗阻,联合组与化疗组无统计学差异(P>0.05),且在治疗过程中出现骨髓抑制、呕吐、腹泻,两组无统计学差异(P>0.05),这表明行腹腔热灌注化疗不会影响患者围术期的康复,且不增加吻合口漏、腹腔内出血、切口感染、肠梗阻等并发症的发生。同时,结果也表明在以后的静脉化疗过程,腹腔热灌注治疗并未增加化疗相关不良反应。
在术后半年局部复发、远处转移及生存情况方面,联合组低于化疗组(0 vs 5.6%,P<0.05),这表明腹腔热灌注治疗能够使药物直达腹腔内的病灶,联合热疗及灌洗作用,最大程度杀灭腹腔内的肿瘤细胞和微小肿瘤灶,从而减少肿瘤的局部复发。由于随访时间较短,两组远处转移及生存情况无统计学差异(P>0.05),对远处转移和生存率的影响尚待进一步随访观察。
综上所述,腹腔热灌注化疗联合静脉化疗相较于单纯静脉化疗,能够减少术后炎性因子的释放,有助于改善结直肠癌术后患者的免疫功能,减少肿瘤局部复发,同时并不增加围术期相关并发症及化疗期间不良反应。

