胶孢炭疽菌对核桃叶生理生化特性的影响
徐慧娟 王蕊蕊 杨振德 吴广 蒙海勤 汪筱雪

摘要:以离体的泡核桃(Juglans sigillata Dode)叶为材料,研究了胶孢炭疽菌(Colletotrichum gloeosporioides)对核桃(Juglans regia L.)叶生理生化指标的影响。结果表明,接种胶孢炭疽菌感病后核桃叶片内超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性均随着感病时间的延长呈先升高后降低的趋势,过氧化物酶(POD)活性则随着感病时间的延长呈先下降后升高的趋势,核桃叶发病第三天和第五天的SOD、POD和CAT活性均显著高于对照;丙二醛(MDA)、可溶性蛋白质和可溶性糖含量均随着核桃叶感病时间的延长呈现出升高的趋势,其中,MDA含量在感病的第三天和第五天均显著高于对照,而可溶性蛋白质和可溶性糖含量与对照差异不显著;叶绿素含量随着核桃叶感病时间的延长而下降,在感病第五天叶绿素含量显著低于对照;感病核桃叶的净光合速率显著低于对照,气孔导度、胞间CO2浓度和蒸腾速率则与对照差异不显著。可见,胶孢炭疽菌感染对泡核桃叶片的生理生化特性有显著影响。
关键词:胶孢炭疽菌(Colletotrichum gloeosporioides);核桃(Juglans regia L.);生理生化指标
中图分类号:S763.15;S436.64 文献标识码:A
文章编号:0439-8114(2018)22-0070-04
DOI:10.14088/j.cnki.issn0439-8114.2018.22.020 开放科学(资源服务)标识码(OSID):
Abstract: Taking leaves of bubble walnut(Juglans sigillata Dode) in vitro as materials,the effects of physiological and biochemical of Colletotrichum gloeosporioides on walnut (Juglans regia L.) leaves were studied. The results showed that the activity of superoxide dismutase(SOD) and catalase(CAT) in walnut leaves after inoculated with Colletotrichum gloeosporioides decreased with the increase of the time of onset,peroxidase(POD) activity increased at first and then descend with the time increasing,protective enzyme activity of the third day and the fifth day after inoculated was significantly higher than that of the control group. Change of malonaldehyde(MDA),soluble protein and soluble sugar content in walnut leaves after inoculation with Colletotrichum gloeosporioides showed a rising trend with the extension of the time of onset, among, the content of MDA was significantly higher than the control group in the third and the fifth days,soluble protein and soluble sugar content was not significant with control. The net photosynthetic rate of walnut leaf which infected with walnut anthracnose was significantly lower than healthy walnut leaf. Stomatal conductance, intercellular carbon dioxide concentration and transpiration rate of walnut leaf which infected with walnut anthracnose was were not significant with control. Thus, it can be seen that the effects of physiological and biochemical of Colletotrichum gloeosporioides on walnut leaves were significant.
Key words: Colletotrichum gloeosporioides; walnut(Juglans regia L.); physiological and biochemical indicators
核桃(Juglans regia L.)原产中亚,为胡桃科(Juglandaceae)核桃属(Juglans)落叶乔木,核桃、腰果、扁桃和榛子一起被称为世界四大坚果。由于核桃具有很高的营养和经济价值,越来越受到人们的喜爱,使得核桃的需求量很高;再加上核桃比其他水果管理容易,投入成本更小,所以深受果农的欢迎。近些年来,广西河池市核桃种植面积不断扩大,但是核桃大面积的种植面临较严重的病虫害问题,其中核桃炭疽病是核桃的主要病害之一。叶片感染核桃炭疽病后病斑呈圆形或不规则状,天气潮湿时病斑上出现粉红色的分生孢子,发病严重时全叶枯黄脱落[1]。核桃炭疽病的病原菌经过鉴定为胶孢炭疽菌(Colletotrichum gloeosporioides)[2,3],其最适合生长的温度为28 ℃,在中性环境下菌株生长最好[2]。核桃炭疽病易发生于高湿高温的环境中,7、8月是发病的高峰期[1]。对于核桃炭疽病的防治主要采用的是物理防治、化学防治和生物防治等方法[4,5]。前人主要是对核桃炭疽病的症状、病菌的鉴定与生物學特性、发病规律和核桃炭疽病的防治进行研究[1-5],但关于炭疽病菌对寄主植物核桃的生理代谢影响尚未见报道。本试验研究了核桃叶接种胶孢炭疽菌发病后,其体内的生理生化指标的变化,旨在阐明炭疽病菌的致病机制及其与寄主植物的互作关系,为抗炭疽病核桃的选育提供理论基础。
1 材料与方法
1.1 材料
核桃叶片采集于广西大学林学院实验教学基地的两年生泡核桃(Juglans sigillata Dode)。供试的炭疽菌菌株为作者所在实验室从广西河池市患病的泡核桃树果实和叶片上分离纯化的胶孢炭疽菌。
1.2 方法
1.2.1 炭疽病菌的接种 选取形态和生长状况一致的核桃叶,用自来水轻轻冲洗3次后,浸泡在75%乙醇中进行表面杀菌,再用去离子水将表面的乙醇冲洗干净并晾干。采用菌饼接种的方法,每片叶子上接种8块菌饼,在接种菌饼之前,先用手术针在接菌饼的原位置扎2个孔,再接种于核桃叶的正面一侧(另一侧保持完整),以叶脉为中心,每半边各对称接种4块菌饼。以空白的PDA培养基接种作为对照。将试验核桃叶插在有水烧杯中培养,外套密封保鲜袋,每天定时喷洒水进行保湿。分别于接种后发现病斑(判断为感病)的第一天、第三天和第五天取病斑组织和对照未感病的组织来测定保护酶活性,每个处理每个时间点各取3片叶子,并设置3次重复。
1.2.2 核桃叶保护酶的测定 超氧化物歧化酶(Superoxide dismutase,SOD)活性的测定采用氮蓝四唑(Nitroblue tetrazolium,NBT)光化还原法,以抑制NBT光化还原50%为1个酶活性单位[6,7];过氧化物酶(Peroxidase,POD)活性的测定用愈创木酚染色法,以1 min内吸光度A470 nm变化0.01为1个酶活性单位[7];过氧化氢酶(Catalase,CAT)活性的测定用紫外吸收法[8]。
1.2.3 核桃叶生理生化指标的测定 丙二醛(Malonaldehyde,MDA)含量测定采用硫代巴比妥酸(TBA)比色法[7];可溶性蛋白质含量测定采用考马斯亮蓝方法[9];可溶性糖含量测定采用蒽酮法[10];叶绿素含量的测定采用分光光度法。
1.2.4 光合作用参数的测定 选择有足够光照的11:00左右,采用LI-6400便携式光合仪(LI-COR公司) 测定发病第七天的泡核桃的光合指标。选取树冠中部高度一致和向阳方位光照充足的枝条上的健康与患有核桃炭疽病病害的完整叶片各3片,每片叶重复3次,同时注意所选择的叶片叶位均一致,分别测定净光合速率(Net photosynthetic rate,Pn)、气孔导度(Stomatal conductance,Gs)、胞间CO2浓度(Intercellular CO2 concentration,Ci)和蒸腾速率(Transpiration rate,Tr)等值。
1.2.5 数据处理与分析 采用SPSS 17.0统计软件分析数据,采用t检验进行差异显著性(P<0.05)分析,试验数据最终用“平均值±标准差”来表示。
2 结果与分析
2.1 核桃叶感染胶孢炭疽菌后保护酶活性的变化
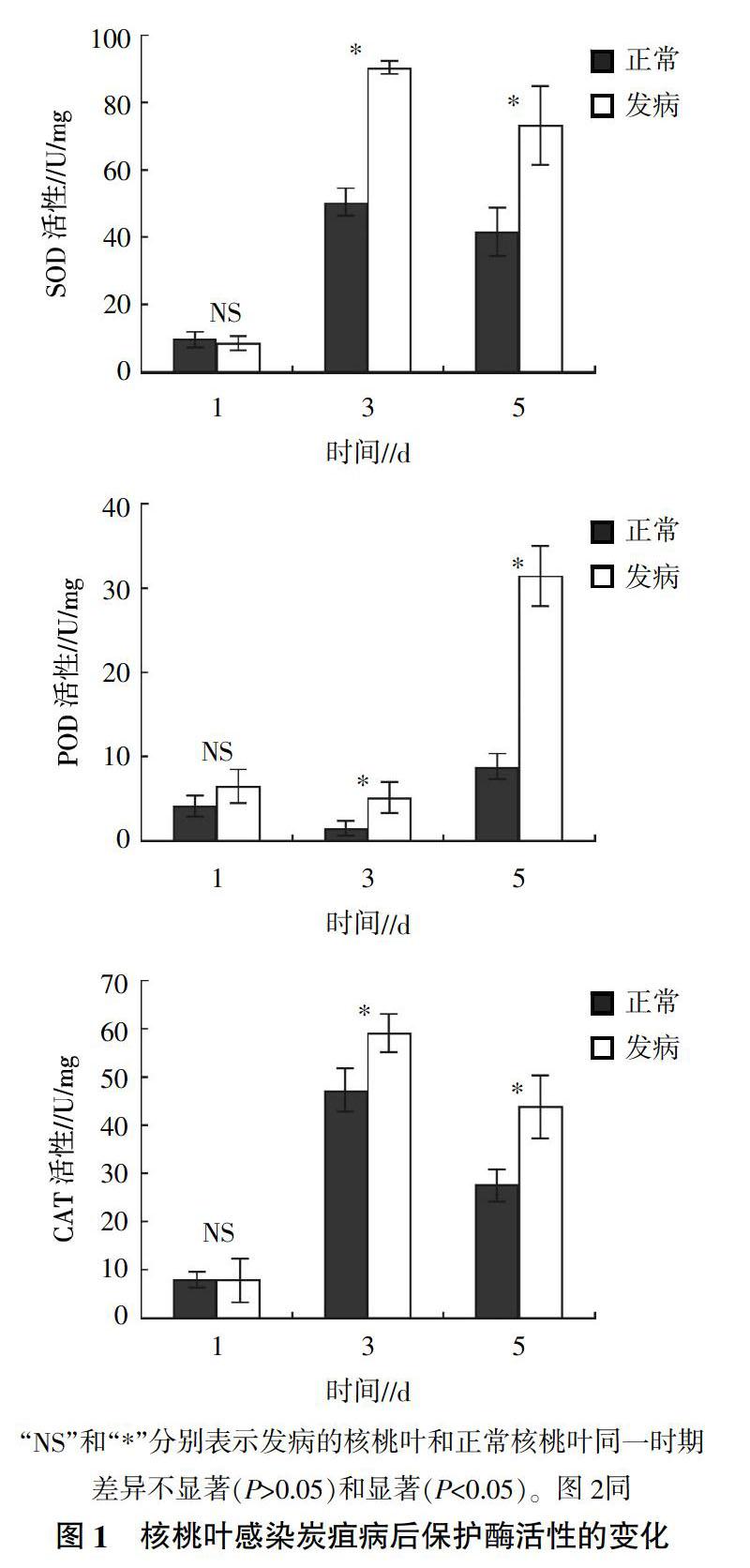
植物受逆境胁迫时,体内的氧化还原平衡被打破,导致活性氧的产生,活性氧的累积又会对植物造成氧化伤害。为使活性氧代谢保持平衡,体内会形成一系列清除活性氧的保护酶类,以使自身免受活性氧的损害[11]。由图1可以看出,核桃叶SOD和CAT的活性随着感病时间的延长呈先升高后降低的趋势,POD活性则随着感病时间的延长呈先下降后升高的趋势。感病状态下核桃叶的酶活性均比正常状态下核桃叶的酶活性高。经 t检验显示,感病第一天SOD、POD、CAT的酶活性与对照无显著差异(P>0.05),但感病第三天和第五天均显著高于对照。
2.2 核桃叶感染胶孢炭疽菌后生理生化指标的变化
MDA、可溶性蛋白质和可溶性糖都是细胞进行新陈代谢的物质。MDA含量的多少可以反映细胞受伤害的程度,可溶性蛋白质含量增加可以提高植物自身的抗逆性,可溶性糖含量增加能使植物细胞的渗透调节能力得到提高[12]。由图2可知,MDA、可溶性蛋白质和可溶性糖含量均随着感病时间的延长而升高,其中MDA含量在发病的第三天和第五天显著高于对照,第五天含量最高,为73.63 μmol/g,为对照组的1.37倍;而可溶性蛋白质和可溶性糖含量与对照差异不显著。
叶绿素是植物光合色素中最重要的一类色素,其含量可受多种逆境的胁迫而下降。由图2可知,叶绿素含量随着感病时间的延长而减少,在第五天显著低于对照,仅为对照的50.6%,表明胶孢炭疽菌侵染核桃叶会使得感病植株的叶绿素含量明显减少,从而使得植物的光合能力减弱。其原因一方面可能是由于病原菌的入侵增强了感病植株叶片中叶绿素酶的活性,促进叶绿素降解;另一方面,病原菌导致了感病植株叶片的光能利用率降低[13],过量的光能使叶绿素成为三线态,通过电子传递、产生单线态氧(1O2)、羟自由基(·OH)和超氧自由基(O2-)等活性氧,从而破坏 DNA、蛋白质、碳水化合物及膜脂等生物分子的结构,降解了叶绿素分子[14]。
2.3 核桃叶感染胶孢炭疽菌后光合作用指标的变化
由表1可知,发病核桃叶的净光合速率显著低于健康核桃叶,仅为对照的56%,而气孔导度、胞间CO2浓度和蒸腾速率则均高于对照,但差异不显著。
3 小结与讨论
植株感染病菌后,其体内会发生一系列的生理反应来抵御病菌的侵害。植物在正常情况下体内活性氧的产生和清除处于一种动态平衡,但病害发生时会打破这个平衡,细胞内活性氧过量积累对植物细胞产生明显的毒害作用,同时引起和加剧膜脂的过氧化作用,破坏膜的结构和功能,引起植物细胞的死亡[15]。SOD、POD和CAT是主要的活性氧清除酶系,其作用是抑制脂质过氧化反应,使细胞免受活性氧伤害。本研究结果表明,随着接种胶孢炭疽菌时间的延长,SOD、POD和CAT酶活性始终高于对照,这有利于减轻接种病菌造成的活性氧对核桃叶片器官膜的伤害,从而抑制病菌的扩展,提高核桃叶抵御核桃炭疽病的能力。不少研究结果表明,寄主植物感染病原菌后体内保护酶活性产生显著变化[16-18]。如黄栌在感染大丽轮枝菌后,其体内SOD先上升后下降[16];梨果实在感染炭疽病后,POD活性呈現先上升后下降再上升的变化趋势[17];水稻在接种稻曲病菌后,CAT活性先升高后下降[18]。本研究结果与此相似,核桃叶感染胶孢炭疽菌后,SOD和CAT活性前期均较高,对病原菌有一定抑制作用,但在感染后期偏低,说明两者不能有效防御病原菌的侵染。
MDA是细胞膜脂过氧化的产物,能够严重损伤生物膜并抑制细胞保护酶的活性,其含量高低反映植物受害的程度,也是导致感病叶片出现病斑的原因之一。核桃叶在接种胶孢炭疽菌后,MDA含量增加快,积累多,显著高于对照,这与王伟[19]将白粉菌接种到葡萄上和张玉芳[14]把根腐病菌接种到当归上后叶片内MDA含量的变化趋势一致。保护酶活性在后期降低,使得活性氧含量增加,细胞膜受到的破坏加重,从而使MDA含量升高。可溶性蛋白质含量的变化是植物生命活动中蛋白质损伤的重要标志,它可以反映细胞内蛋白质合成、变性及降解等重要信息。感病核桃叶蛋白质含量有所增高,这可能是在病原微生物侵染条件下,产生了诱导蛋白质(如渗透蛋白质、 核糖体失活蛋白质等)的原因[20]。可溶性糖在生物体内主要参与呼吸代谢,为生物体生命活动提供所需的能量,也是生物体新陈代谢的重要中间产物。感病核桃叶可溶性糖含量的增加可能是胶孢炭疽菌的侵入刺激了核桃叶,使其呼吸作用增强,同时由于合成一些保护性物质时需要消耗较多的物质来源,从而促进了多糖的分解[21]。叶绿素在一定范围内间接地反映了叶片的衰老程度,感病后叶绿素含量降低,说明核桃炭疽病加速了叶片的衰老,感病核桃叶叶绿素含量随着时间的延长而逐渐降低,在第五天显著低于对照,可能是接种胶孢炭疽菌后,叶内产生的活性氧较多,SOD、POD和CAT等酶的产生量不足以消除过多的活性氧,使它们在叶绿体中积聚,破坏叶绿体,因而导致叶绿素含量下降,这与前人的研究一致[14,22]。
综上所述,胶孢炭疽菌对核桃叶的生理生化特性有显著影响。感病核桃叶的保护酶活性要比对照高,说明感病核桃叶还会产生更多的保护酶来清除由于炭疽病菌侵染后所累积的活性氧,而随着感病时间的延长,SOD和CAT活性开始下降,说明此时活性氧的清除能力遭到极大削弱[23],伤害加剧,出现叶片细胞死亡的外观现象,从而导致MDA含量升高;可溶性糖、可溶性蛋白质、叶绿素的代谢混乱,合成减弱,分解加强;导致光合作用失调,净光合速率下降,最终感病核桃叶出现枯死的现象。
参考文献:
[1] 时丕坤,宗殿龙.核桃炭疽病发生规律及防治措施[J].河北果树,2017(5):35.
[2] 王清海,刘幸红,范 昆,等.核桃炭疽病病原菌鉴定及生物学特性[J].山东农业大学学报,2016,47(1):9-14.
[3] 曲文文.山东省核桃主要病害病原鉴定[D].山东泰安:山东农业大学,2011.
[4] 刘京伟,柴高正.核桃树腐烂病的发生与防治[J].果树实用技术与信息,2015(2):31-32.
[5] 曾绍贵.核桃炭疽病及防治方法研究进展[J].四川林业科技,2017,38(1):108-110.
[6] 阎秀峰,李 晶,祖元刚.干旱胁迫对红松幼苗保护酶活性及脂质过氧化作用的影响[J].生态学报,1999,19(6):850-854.
[7] 张志良,瞿伟菁.植物生理学实验指导[M].北京:高等教育出版社,2003.
[8] 高俊凤.植物生理学试验指导[M].北京:高等教育出版社,2006.
[9] 华东师范大学.植物生理学实验指导[M].北京:人民教育出版社,1981.
[10] 肖浪涛,王三根.植物生理学实验技术[M].北京:中国农业出版社,2005.
[11] ZHU J K. Cell signaling under salt,water and cold stress[J].Current Opinion in Plant Biology,2001,4(5):401-406.
[12] 袁淑珍,栗淑媛,乔 辰.低温胁迫对螺旋藻体内可溶性糖含量的影响[J].中国农学通报,2008,24(5):113-116.
[13] 代红军,柯玉琴,潘廷国,等.甘薯蔓割病病原菌的侵染对甘薯光合作用的影响[J].福建农林大学学报,2004,33(3):304-307.
[14] 张玉芳.根腐菌对当归种子萌发、幼苗生长及生理特征的影响[D].兰州:西北师范大学,2014.
[15] 马旭俊,朱大海.植物超氧化物歧化酶(SOD)的研究进展[J]. 遗传,2003,25(2):225-231.
[16] 王 妍,田呈明,王永林.黄栌与轮枝菌互作过程中活性氧及保护酶系的变化[A].中国植物病理学会2011年学术年会论文集[C].北京:中國农业科学技术出版社,2011.428.
[17] 赵 梅.梨果实对炭疽病和轮纹病抗性生理的研究[D].南京:南京农业大学,2013.
[18] 陆 君.稻曲病菌与水稻互作的初步研究[D].武汉:华中农业大学,2013.
[19] 王 伟.葡萄白粉菌侵染过程及其对叶片相关生理生化指标的影响[D].西安:西北农林科技大学,2010.
[20] 梁喜龙,郑殿峰,左豫虎.病害逆境下寄主植物生理生化指标的研究现状与展望[J].安徽农业科学,2006,34(15):3576-3578.
[21] 刘慧芹.叶霉病菌毒素与番茄品种抗病性关系的研究[D].山西太谷:山西农业大学,2003.
[22] 赵庆芳,李海亮,王 莱.病害胁迫对观赏百合生理生化的影响[J].北方园艺,2007(4):163-165.
[23] 李 西,毛 凯,熊 曦,等.暖季型草坪草抗寒性研究进展[J].中国草地,2002,22(4):53-58.

