南美白对虾高位精养池亚硝酸盐去除菌分离鉴定及去除率影响因素分析
吴 越,许凯伦,黄振华,陆荣茂,姚青怡
(1.浙江省海洋水产养殖研究所,浙江 温州 325000; 2.宁波大学,浙江 宁波 315000)
南美白对虾(Litopenaeusvannamei)是我国主养对虾品种,其养殖面积及养殖产量在国内均占居主导地位。随着对虾养殖规模的不断扩大,工厂化养殖模式快速兴起,其中高位池精养模式由于其高密度、高产量、高效益的特点备受推崇。但在高位精养中由于过量投喂配合饲料、高密度对虾自身代谢终产物积累以及藻相的异常变化等因素往往容易引起水质败坏,而亚硝酸盐含量居高不下是养殖过程中经常碰到的棘手问题之一。亚硝酸盐是氨转化成硝酸盐过程中的中间产物,是养殖水体中主要的污染物之一。甲壳类动物对亚硝酸盐毒性更为敏感,亚硝酸盐胁迫会引起虾体组织病变,抗病有关酶活力显著下降,抗病能力减弱,严重影响对虾的健康生长并制约着养殖产量的提高[1-3]。控制水体中亚硝酸盐污染已成为集约化水产养殖成功的关键措施之一。在水产养殖实践中积累了一些物理和化学方法去除亚硝酸盐,如物理吸附法、还原法、氧化法和间接控制法等,但这些方法往往只能暂时缓解和控制亚硝酸盐含量高的情况,其作用时间短且亚硝酸盐浓度易反弹,不适于规模化、高密度养殖模式[4]。近年来,使用微生态制剂调控水质作为一种绿色环保的养殖环境生物治理方法受到广泛关注[5]。微生态制剂防治亚硝酸盐污染中最为重要的是选择合适高效的降解菌株。不同来源的菌种适应性不同,有益微生物制剂在不同地区的效果也不同[6]。目前已经开展了一些关于亚硝酸盐去除菌的筛选工作,但对适用于南美白对虾高位精养池的亚硝酸盐去除菌的研究仍然较少。本研究以南美白对虾高位精养池养殖后期的自然水体为材料,通过菌株富集、分离、纯化、鉴定和环境因子单因素试验,旨在寻找适用于高位精养池模式的亚硝酸盐高效降解菌株。
1 材料与方法
1.1 材料
用于分离细菌的水样于2016 年 7 月16日取自位于浙江省温州市龙湾区的浙江省海洋水产养殖研究所永兴基地南美白对虾高位精养池。用采水器在水深约50 cm 处采集水样,样品立即运回实验室用于后继试验。试验中使用的自然海水也来自永兴基地,配置培养基的试剂购买自温州市鹿城金山化学试剂仪器公司。
1.2 方法
1.2.1 菌株的富集、分离和纯化
首先对采集的水样进行富集处理。本研究的富集培养基参考并改进侯颖等[7]报道富集培养基制备,具体成分为葡萄糖5.0 g,NaNO21.0 g,(NH4)2SO42.0 g, KNO31.0 g,抽滤自然海水1 000 mL,调节pH值至7.5。121 ℃下高压蒸汽灭菌 15 min 后用于去除亚硝酸盐菌株的富集。
为富集亚硝酸盐去除菌株,取采集水样10 mL加入到100 mL富集培养基中,30 ℃、180 r·min-1条件下震荡培养24 h后,向培养基中再加入10 mL新鲜富集培养基强化富集效果。如此强化富集3次以淘汰对亚硝酸盐耐受性差的菌株。随后取10-1、10-2、10-3、10-4和10-5等5个稀释度的富集培养液各100 μL 分别涂布到分离培养基上(分离培养基为富集培养基中加1.5%的琼脂制成),30 ℃培养直至长出明显菌落。选取形态、颜色不同的单个菌落在分离培养基上多次画线分离,直至无杂菌出现。最后将筛选出的纯化菌株在斜面2216E琼脂培养基上画线保种。
1.2.2 菌种的筛选
将上述分离得到的菌株接种到 2216E液体培养基中,30 ℃、180 r·min-1震荡培养 24 h,以1∶50的比例接种至灭菌的筛选培养基,于30 ℃恒温箱中培养 48 h。筛选培养基参考郭静等[8]报道,具体成分葡萄糖1.0 g,NaNO327.5 mg,(NH4)2SO46.25 mg,KNO33.0 mg,抽滤养殖海水1 000 mL,调节pH值至7.5,筛选培养基中亚硝酸盐含量约2 mg·L-1。48 h后培养基用0.22 μm针式滤器过滤,用Seal AA3流动分析仪测定接种培养基中亚硝酸盐含量,以未接种菌液培养基中亚硝酸盐浓度为对照,每个菌株筛选培养重复3次,计算平均值用于比较各菌株的亚硝酸盐去除率。
亚硝酸盐去除率=(未接种筛选培养基亚硝酸盐浓度-接种菌筛选培养基亚硝酸盐浓度)/未接种菌筛选培养基亚硝酸盐浓度×100。
1.2.3 筛选菌株的鉴定
筛选菌株的种类鉴定综合采用形态学特征、16S rRNA测序及生理生化相关特征3个方面进行。
菌株的形态学特征观察。将筛选菌株涂布到2216E琼脂培养基中,30 ℃培养,待长出菌落后进行革兰氏染色并观察菌落形状、颜色、透明度等特征。
16S rRNA测序。培养后菌液基因组DNA采用天根生化科技(北京)有限公司生产的细菌基因组DNA提取试剂盒抽提。DNA送生工生物工程(上海)股份有限公司进行16S rRNA测序。测序结果在GenBank上进行BLAST比对。
菌株生化特征鉴定。菌株的生理生化特征检测方法通过检索《伯杰氏细菌鉴定手册》[9]和《常见细菌系统鉴定手册》[10]进行。本研究用于生理生化特征检测的指标见表1。
1.2.4 菌株生长测定
采用光电比浊法测定菌株生长曲线[11]。将菌株按1∶50接种至50 mL 2216E液体培养基,30 ℃、180 r·min-1震荡培养,分别在 0、6、12、24、48和72 h 取样3 mL,测定600 nm波长下菌液的吸光度值(D600 nm),绘制菌株生长曲线。
1.2.5 环境因子对菌株亚硝酸盐去除能力影响
本研究设置的pH值梯度为7.0、7.5、8.0、8.5(温度为30 ℃,盐度为2.5%);盐度梯度为2.0%、2.5%、3.0%、3.5%(温度为30 ℃,pH值为7.5);温度梯度为20、25、30、35 ℃(pH值为7.5,盐度为2.5%)。将培养至对数生长期的菌液以1∶50接种到筛选培养基中,除用于比较的单一因子不同外,其他培养条件均保持一致。所有试验处理均培养48 h 后取样过滤,测定培养基中亚硝酸盐浓度,分别计算菌株在不同温度、盐度和pH值培养条件下亚硝酸盐去除率。每个处理组设3个平行。数据用Excel 2010和SPSS进行计算、分析及绘图。
2 结果与分析
2.1 菌株分离及筛选
对虾养殖塘水体经过富集和分离共得到56株细菌。经过筛选培养测定亚硝酸盐去除率获得3株可去除亚硝酸盐的菌株,分别编号为N3、N29和N38,其中N29去除率最高,达到90%以上,因此选择N29做后续的研究。
2.2 菌株鉴定
2.2.1 细菌16S rRNA序列
将N29的16S rRNA测序结果在NCBI数据库中进行Blast比对,结果显示,N29的16S rRNA的序列和地衣芽孢杆菌(Bacilluslicheniformis)、索诺拉沙漠芽孢杆菌(Bacillussonorensis)、空气芽孢杆菌(Bacillusaerius)和枯草芽孢杆菌(Bacillussubtilis)等有99% 的相似性(图1)。16S rRNA 基因序列分析可以确定该菌属于芽孢杆菌属(Bacillus),但无法确定具体是何种芽孢杆菌。
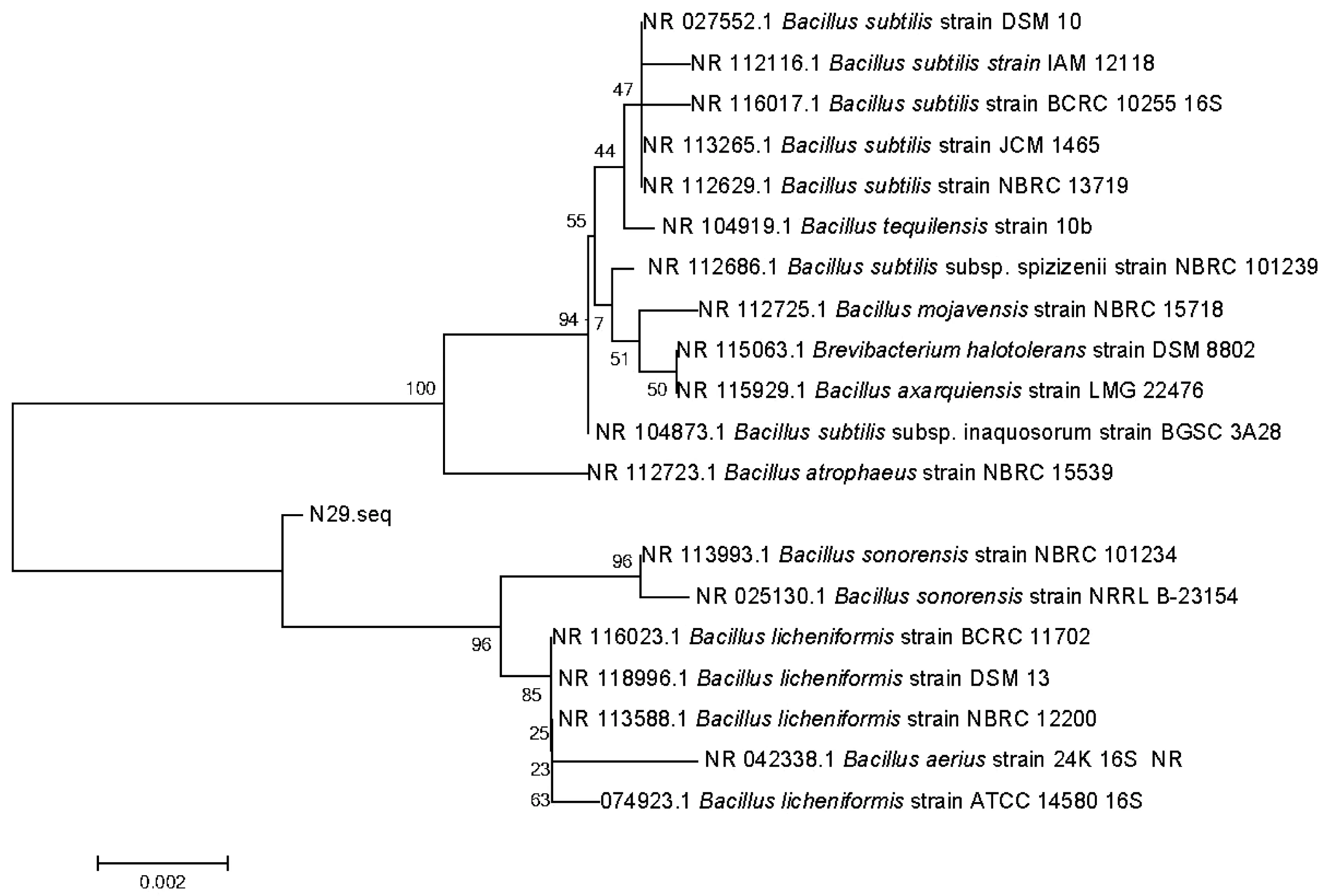
图1 N29菌株16S rRNA序列系统发育树
2.2.2 细菌生化特征
N29在2216E培养基上为白色不透明、扁平、边缘不光滑菌落,革兰氏染色结果显示为阳性菌。共进行14项生理生化指标检测,其中12项为阳性,2项为阴性,鉴定结果表明其生理生化特征与芽孢杆菌属的地衣芽孢杆菌相符(表1)。
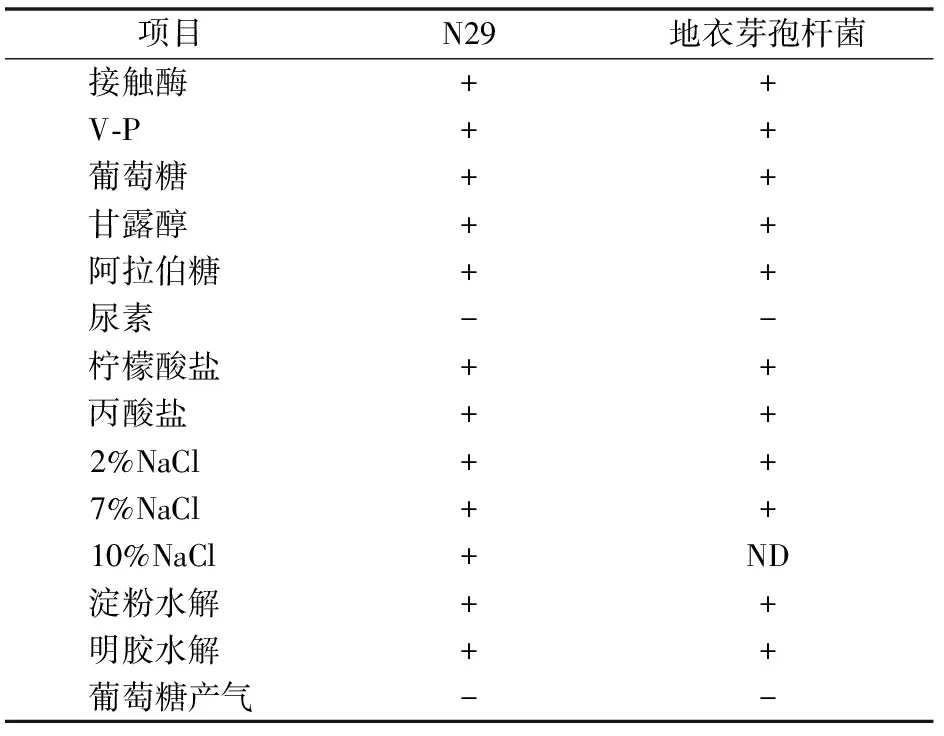
表1 N29菌株的生理生化特征
2.3 菌株生长
采用光电比浊法绘制了菌株N29的部分生长曲线,包括延滞期、指数期和平稳期(图2)。结果显示,N29菌株在培养初期6 h内生长较缓慢为延滞期,之后菌液浓度开始急速上升,可视为进入指数生长期。至36 h为止N29菌株一直处于快速生长阶段,之后生长速度减慢,开始进入平稳期。N29菌株的生长曲线基本呈现“S”型,与细菌的典型生长曲线相似。
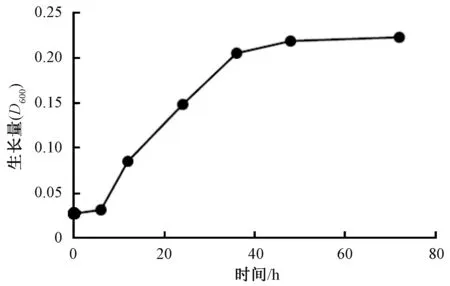
图2 N29菌株的生长曲线
2.4 菌株去除亚硝酸盐能力
pH值梯度试验结果显示,菌株N29培养24 h后,在pH值为7.0~7.5时亚硝酸盐去除率受pH值的影响较小,当pH值继续上升时,其去除亚硝酸盐能力呈现显著下降的趋势(P<0.05),在pH值为7.5时,亚硝酸盐去除率最高为59.9%(图3)。菌株N29在培养48 h后,亚硝酸盐去除能力随着pH值呈现先上升后下降趋势,在pH值为7.5时最高达96.4%,显著高于pH值为7.0和8.5时去除率,但与pH值为8.0时差异不显著。pH值梯度试验结果表明,N29去除亚硝酸盐适宜pH值为7.5,但在pH值7.0~8.5其去除率均能达到90%以上。

图3 pH值对亚硝酸盐去除能力的影响
盐度梯度试验结果显示,菌株N29培养24 h,其亚硝酸盐去除率先随着盐度的上升而提高,至盐度为2.5%时其去除率达到最高为66.0%,但与盐度为2.0%时差异不明显。随着盐度的进一步升高,N29亚硝酸盐去除率下降,在盐度为3.0%和3.5%时其去除能力均显著低于盐度2.5%时。培养48 h后N29在盐度为2.5%时去除率最高为94.4%,各盐度梯度下差异不明显,去除率总体均维持在93%左右(图4)。
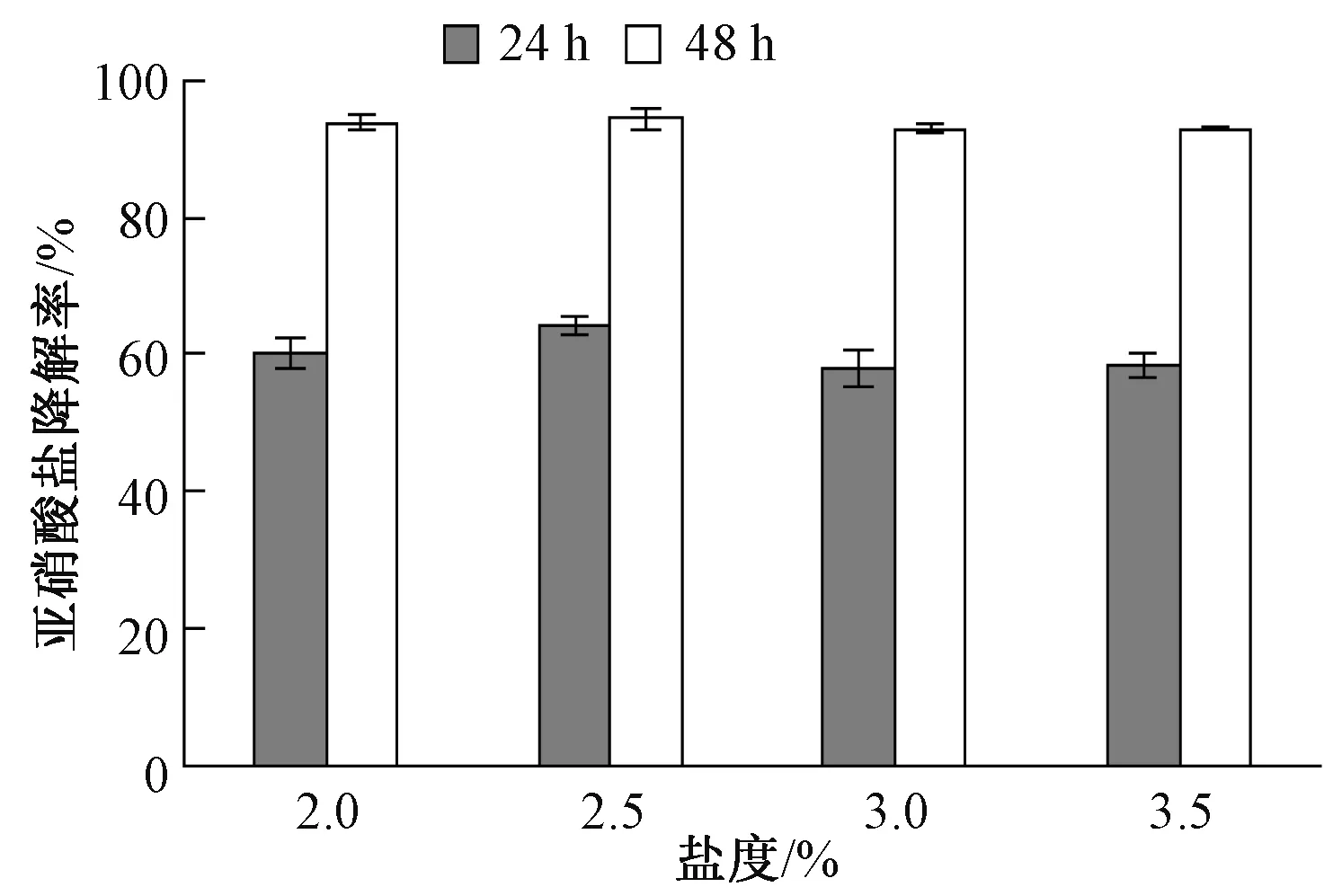
图4 盐度对亚硝酸盐去除能力的影响
温度梯度试验结果显示,菌株N29培养24 h,其亚硝酸盐去除率先随着温度的上升而提高,至温度为35 ℃时其去除率达到最高为58.3%,显著高于20 ℃和25 ℃时的去除率。但与30 ℃时去除率十分接近。培养48 h后N29亚硝酸盐去除率的变化趋势与24 h时相似,也是先随着温度的上升而显著升高,至30 ℃时达到最高为92.9%,35 ℃时略有下降但与30 ℃时差异不显著(图5)。结果表明,温度对N29亚硝酸盐降解率的影响较大,适宜的温度为30~35 ℃。
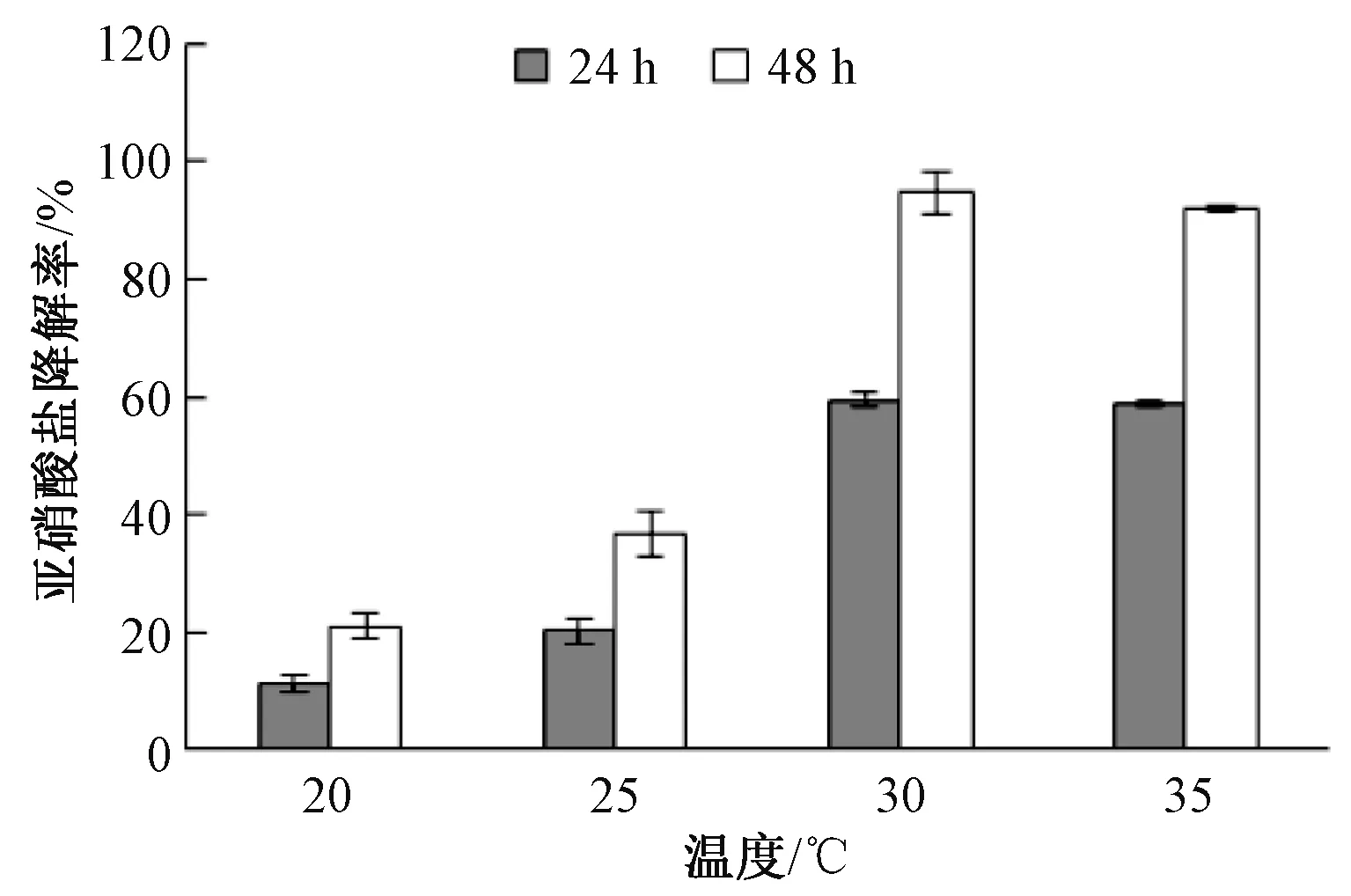
图5 温度对亚硝酸盐去除能力的影响
3 小结与讨论
本研究通过富集培养和分离纯化从南美白对虾高位精养池养殖后期水体中筛选到一株高效去除亚硝酸盐的菌株。高位精养池在养殖过程中由于养殖动物体重增加,池塘承载量明显加大,且养殖水体中大量的残饵、动物排泄物和死亡残体积累,水质情况很容易恶化,亚硝酸盐浓度急剧升高,因此采取有效的水质调控措施尤为重要。在高浓度亚硝酸盐的后期养殖水体中可能天然存在对亚硝酸盐有较好的耐受性和较高去除率的菌株,直接从自然条件下的养殖水体中筛选去除亚硝酸盐的菌株是寻找适合临床应用菌株的捷径。经该方法获取的菌株是水体中正常菌群成员之一,对养殖环境具有很强的适应性和较小的生物安全风险。本研究中筛选到的南美白对虾高位精养池亚硝酸盐去除菌经16S rRNA测序和生理生化检测鉴定为地衣芽孢杆菌。芽孢杆菌能分泌丰富的蛋白酶、脂肪酶、淀粉酶、纤维素酶等高活性酶类,可分解养殖环境中碳系、氮系、磷系、硫系污染物和复杂多糖、蛋白质和水溶性有机物,从而降低水体富营养化并减少底泥生成,且在其生长繁殖过程中会分泌一些细菌素等物质,对养殖水体中的异养细菌、弧菌等致病菌的生长和繁殖具有一定的抑制作用[12]。芽孢杆菌是水产养殖中常用的水质改良益生菌,但目前在水质的净化作用方面研究较多的主要还是枯草芽孢杆菌[13-15]。对于地衣芽孢杆菌在水质亚硝酸盐净化中的作用,曹煜成等[16-17]研究发现,地衣芽孢杆菌可显著降低黄鳍鲷(Acanthopagruslatus)、草鱼(Ctenopharyngodonidellus)等养殖水体中氨氮、亚硝酸盐的含量,使水质得到显著改善。白小丽等[18]采用枯草芽孢杆菌和地衣芽孢杆菌混合制剂对鳜(Sinipercachuatsi)及饵料鱼池塘进行水质调控,发现亚硝态氮的最大降解率可达77.5%。本研究中筛选到N29菌株对亚硝酸盐的降解率可达到90%以上,表明N29有较高的去除亚硝酸盐能力,可以用于开发新型的高效水质净化微生物态制剂。
在水产养殖过程中,养殖水体的理化因子一直处于不断变化中,而微生物的水质净化能力会受理化因子波动的影响。李炎生等[19]从活性污泥中分离筛选到一株异养型亚硝酸盐氧化细菌,当温度为30 ℃时菌株硝化作用最强, 温度高于或低于此温度都不利于菌株其硝化作用的进行,另外适度的盐浓度(1 g·L-1)对硝化细菌氧化亚硝酸盐具有一定的促进作用, 但是盐浓度过高反过来又会抑制硝化反应的进行。熊焰等[20]从养殖水体中筛选到一株降解亚硝酸盐的巨大芽孢杆菌(Bacillusmegaterium),研究发现pH值为5.5~7.0 时,菌株对亚硝酸盐的降解率随pH值的升高而上升;pH 值为7.0~8.5时,菌株对亚硝酸盐的降解率随pH值的升高而降低,pH值为7.0 时降解率最高达80.2%;温度从18 ℃到33 ℃过程中,菌株对亚硝酸盐的降解率逐步升高,从33 ℃到50 ℃时降解率呈下降趋势,在28~33 ℃, 菌株的降解率较高平均达88.9%。本研究单因素试验结果表明:pH值在7.0~8.5时N29去除亚硝酸盐能力随pH值升高呈现先上升后下降趋势,其中pH值为7.5时去除率最高,且在pH值为7.0~8.0均可以达90%以上;盐度在2.0%~3.5%时N29亚硝酸盐去除率没有显著差异,说明其有较广适盐性;温度对N29亚硝酸盐去除率有较明显的影响,其亚硝酸盐去除率先随着温度的上升显著提高,至温度为30~35 ℃时其去除率最高。温度对菌株去除亚硝酸盐有显著影响,这可能一方面是由于温度会影响微生物的生长增殖及代谢活动,另一方面是因为硝化作用过程本身包含了一系列的酶促反应,其反应速率也受温度影响。总体而言,N29去除亚硝酸盐的适宜pH值为7.5~8,盐度为2.0%~3.5%,适宜的温度为30~35 ℃,具有较广的pH值和盐度适应范围,比较适合用于夏季南美白对虾高位精养池养殖模式下水质亚硝酸盐的调节,但是关于其在生产养殖过程中实际水质调控效果还需后续进一步研究。
[1] CHENG S Y, CHEN J C. Effects of nitrite exposure on the hemolymph electrolyte, respiratory protein and free amino acid levels and water content ofPenaeusjaponicas[J]. Aquatic Toxicology, 1998, 44(1/2):129-139.
[2] 黄翔鹄,李长玲,郑莲,等. 亚硝酸盐氮对凡纳滨对虾毒性和抗病相关因子影响 [J]. 水生生物学报,2006,30(4):466-469.
[3] 董玉波,戴媛媛. 亚硝酸盐氮对水产经济动物毒性影响的研究概况 [J]. 水产养殖,2011,32 (4):28-32.
[4] 刘德生, 史彩华, 李志新. 降解养殖水体亚硝酸盐的研究进展和前景分析 [J]. 现代农业科学,2009 (4):14-15.
[5] 王新,吴逸飞,姚晓红. 微生态制剂对养殖后期虾池水质及细菌群落的影响 [J]. 浙江农业学报,2014,26(1):40-47.
[6] 侯海锋,李茜,史万玉,等. 微生态制剂在养殖生产中的应用现状与展望 [J]. 中国畜牧兽医,2011,38 (7):27-30.
[7] 侯颖,徐建强,孙军德. 养殖水体高效氨氮脱除菌的分离及脱除特性研究 [J]. 西北农林科技大学学报(自然科学版),2006,34(11):137-140.
[8] 郭静,熊焰,李华. 养殖水体中水质净化菌的筛选和鉴定 [J]. 水利渔业,2008,28(4):105-106.
[9] 布坎南, 吉本斯. 伯杰细菌鉴定手册 [M]. 8版. 北京:科学出版社,1984:734-830.
[10] 东秀珠,蔡妙英. 常见细菌系统鉴定手册 [M]. 北京:科学出版社,2001:108-110.
[11] 郭春叶,龚月生,刘林丽,等. 酵母菌生长曲线的测定及其转葡萄芪合酶基因重组菌遗传稳定性的检测 [J]. 安徽农业科学,2007,35(7):1909-1910.
[12] 王志丽. 中华鳖养殖中芽孢杆菌、嗜水气单胞菌及其噬菌体的分离和性质研究 [D]. 河北:河北大学,2015.
[13] ZHANG X P, FU L Q, DENG B, et al. Bacillus subtilis SC02 supplementation causes alterations of the microbial diversity in grass carp water [J]. World Journal of Microbiology & Biotechnology, 2013, 29(9):1645-1653.
[14] 何沅滨,李义,陈亚军,等. 泥鳅养殖水体中一株芽孢杆菌的筛选及其净水效果研究 [J]. 水生态学杂志,2015,36 (4):86-91.
[15] LIU F, HAN W Y. Reuse strategy of wastewater in prawn nursery by microbial remediation [J]. Aquaculture,2004,230 (1/4):281-296.
[16] 曹煜成,李卓佳,杨莺莺,等. 地衣芽孢杆菌De株对黄鳍鲷生长及其养殖池塘主要环境因子的影响 [J]. 南方水产,2010,6 (4):1-6.
[17] 曹煜成, 李卓佳, 林黑着,等. 地衣芽孢杆菌De在优质草鱼养殖中的应用研究 [J]. 南方水产, 2008, 4 (3):15-19.
[18] 白小丽,梁旭方,李卫芬,等. 投喂芽孢杆菌对鳜及饵料鱼养殖池塘水质和浮游生物的影响 [J]. 淡水渔业,2013,43(3):89-92.
[19] 李焱生,魏民,张艾晓,等. 一株异养型亚硝酸盐氧化细菌的分离及其降解特性的研究 [J]. 生物技术通报,2010(5):196-202.
[20] 熊焰,刘力源,罗睿,等. 1株亚硝酸盐降解菌的筛选、鉴定、降解条件及效果 [J]. 中国水产科学,2010,17 (6):1264-1271.

