超高效液相色谱-质谱法测定母乳中12 种低聚糖
陈新新,芦 晶,刘 鹭,逄晓阳,张书文,李 诚*,吕加平,*
(1.中国农业科学院农产品加工研究所,北京 100193;2.四川农业大学食品学院,四川 雅安 625014)
乳寡糖是母乳中主要营养成分之一,成熟乳中低聚糖的质量浓度为7~12 g/L,初乳中的质量浓度更高,约为24 g/L[1]。低聚糖又称寡糖,由2~10 个单糖通过糖苷键连接而成,构成母乳的单糖主要有葡萄糖(glucose,Glc)、半乳糖(galactose,Gal)、岩藻糖(fucose,Fuc)、N-乙酰葡萄糖胺(N-acetylglucosamine,GlcNAc)和N-乙酰神经氨酸(N-acetylneuraminic,NeuAc)5 种,且母乳低聚糖均存在1 个由半乳糖和N-乙酰葡萄糖胺组成的核心结构,其他糖单元通过不同的形式连接在周围构成了母乳低聚糖结构的多样性[2-3]。目前,已知的母乳低聚糖有200多种[4]。研究发现乳寡糖除了为新生儿提供营养之外还具有重要的生物学作用[5-7],其可以选择性地促进有益细菌如双歧杆菌在肠道中的生长,防止病原性细菌(例如痢疾杆菌、大肠杆菌等)的黏附,调节婴幼儿的免疫系统,从而降低新生儿患疾病的风险[8-9];近期也有研究发现酸性低聚糖对幼儿的大脑发育起着重要作用[10]。低聚糖的生理功能与结构特征密切相关,因此了解低聚糖的结构极其重要,而研究乳寡糖的结构功能的前提是对乳寡糖进行定性定量分析[8-11]。由于母乳低聚糖结构复杂且存在多种同分异构体,这使得乳寡糖的分离具有一定的难度[12]。目前对母乳低聚糖的定量研究较少,多侧重于乳寡糖的定性和相对定量,建立一种母乳低聚糖的快速测定及定量方法具有重要意义。
目前常用的低聚糖分析方法主要有核磁法、高效液相色谱法和液相色谱-质谱法等[13]。虽然核磁法在低聚糖的结果表征中起到重要作用,但由于所需样品量大、分析较为复杂使其应用受到局限[14-15]。近年来,高效液相色谱-串联质谱法已成功用于低聚糖的分离、鉴定和单糖组成分析[16]。
本实验旨在建立一种母乳中12 种低聚糖的快速测定方法。通过对母乳进行脱脂除蛋白前处理后,利用优化好的超高效液相色谱条件使母乳中的12 种低聚糖得到了很好分离,并采用三重四极杆质谱对其12 种母乳低聚糖成分实现了准确定量。
1 材料与方法
1.1 材料与试剂
母乳 北京某医院志愿者;母乳低聚糖标准品:2-岩藻糖乳糖(2-fucosyllactose,2FL)、3-岩藻糖乳糖(3-fucosyllactose,3F)、3-唾液酸乳糖(3-sialyllactose,3SL)、6-唾液酸乳糖(6-sialyllactose,6SL)、乳酰-N-岩藻五糖Ⅰ(lacto N-fucopentaoseⅠ,LNFPⅠ)、乳酰-N-岩藻五糖Ⅲ(lacto N-fucopentaose Ⅲ,LNFPⅢ)、乳酰-N-二岩藻六糖Ⅱ(lacto-N-difuco-hexaoseⅡ,LNDFHⅡ)、乳酰-N-己糖(lacto N-neohexaose,LNnH)、二唾液乳-N-四糖(disialyllacto-N-tetraose,DSLNT)、乳糖基四糖a(lactosialyl tetrasaccharide a,LSTa)、乳糖基四糖b(lactosialyl tetrasaccharide b,LSTb)、乳糖基四糖c(lactosialyl tetrasaccharide c,LSTc) 法国ElcitylOligoTech公司;乙腈(色谱纯) 美国Fisher公司;甲酸铵(色谱级) 美国Sigma公司;无水乙醇(分析纯) 北京化工厂。12 种母乳低聚糖具体结构信息[17]见表1。

表1 12 种母乳低聚糖结构Table1 Structures of 12 human milk oligosaccharides
1.2 仪器与设备
ACQUITY UPLC氨基色谱柱(2.1 mm×100 mm,1.7 μm) 美国Waters公司;MVS-1涡旋混合器 北京金北德工贸有限公司;3K15离心机 美国Sigma公司;ZLS-4真空旋转蒸发仪 湖南赫西仪器装备有限公司;ULUP-IV-10T超纯水装置 西安优普仪器设备有限公司;ME55精密电子天平 梅特勒-托利多仪器(上海)有限公司;JD-3电子天平 沈阳龙腾电子有限公司;MF50雪花制冰机 北京长流科学仪器公司;1290系列超高效液相色谱-串联三重四极杆质谱仪美国Agilent公司。
1.3 方法
1.3.1 标准溶液的配制
取所购12 种母乳低聚糖标准品各1 mg,溶解于1 mL的超纯水中,涡旋混匀后,得到质量浓度1mg/mL的标准品储备液,存放-80 ℃备用。由于12 种母乳低聚糖在母乳样品中含量差别较大,通过阅读文献,将12 种母乳低聚糖标准品分为两部分做标准曲线[18-19]。
取2FL、3FL各10 μL,加入80 μL超纯水,此时2 种标准品的混标质量浓度为100 mg/L,取此混合标样逐级稀释;取3SL、6SL、LNFPⅠ、LNFPⅢ、LNDFHⅡ、DSLNT、LNnH、LSTa、LSTb、和LSTc各5 μL,加入50 μL的超纯水混匀,此时该10 种标准品的混标质量浓度为50 mg/L,取此混合样逐级稀释成不同的质量浓度,如表2所示。
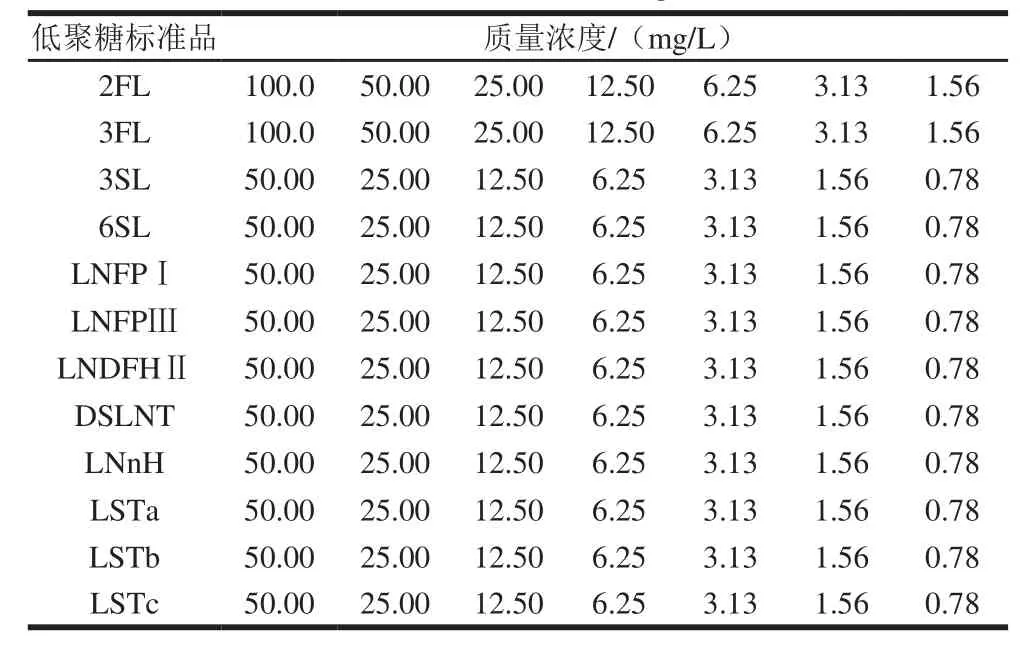
表2 12 种标准品溶液的质量浓度Table2 Concentrations of 12 standard oligosaccharide solutions
1.3.2 母乳低聚糖的提取
获得母乳低聚糖的关键在于除蛋白,目前最常用的脱除蛋白方法有乙醇沉淀法和乙腈沉淀法[20-21]。2 种实验方法具体如下:
取母乳样品5 mL,6 000 r/min、4 ℃离心10 min后,去除上层脂肪,然后将乳液装入特定规格的超高速离心管,(1×105)×g、4 ℃超高速离心90 min,离心后,乳样分为两部分,乳寡糖位于上清液中,底部沉淀为酪蛋白,获取上清液,加入2 倍体积的无水乙醇,4 ℃放置4 h,10 000 r/min、4 ℃离心10 min后取上清液,此操作重复2 次后真空浓缩至干,然后加入超纯水稀释过膜后用于检测[22]。
取母乳样品500 μL,加入等体积的超纯水,6 000 r/min、4 ℃离心10 min后,去除上层脂肪,取下层清液加入1.5 mL的乙腈,涡旋混匀后超声5 min,在10 000 r/min、4 ℃离心10 min后取上清液,此操作重复2 次,稀释后即可用来上样。
1.3.3 高效相色谱条件
ACQUITY UPLC氨基色谱柱(2.1 mm×100 mm,1.7 μm);柱温50 ℃;流速0.3 mL/min;流动相A为10 mmol/L的甲酸铵溶液,流动相B为乙腈;获得最优流动相条件:0~10 min,95%~75% B;10~15 min,75% B;15~20 min,75%~65% B;20~21 min,65%~10% B;21~24min,10% B;24~25 min,10%~95% B;25~35min,95% B。
1.3.4 质谱条件
电喷雾离子源;正离子扫描;干燥气体温度150 ℃,干燥气体流速16 L/min;雾化器压力35 psi;毛细管电压3 kV;保温气体温度300 ℃;保温气体流速12 L/min。
2 结果与分析
2.1 前处理方法的选择
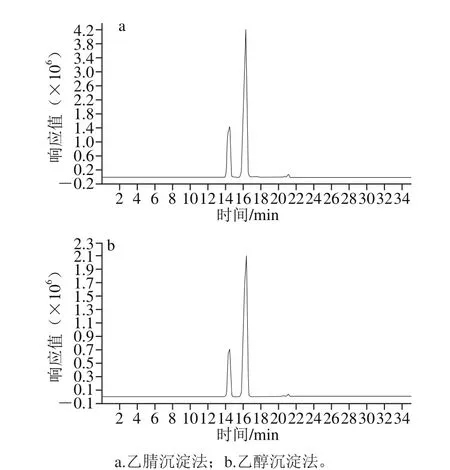
图1 不同前处理方法母乳低聚糖总离子流图Fig. 1 Total ion current chromatograms of human milk oligosaccharides with different pretreatment methods
用2 种不同的前处理方式处理后的母乳样品,按照优化好的超高效液相色谱-质谱条件进样测定,检测结果如图1所示。由于乙醇沉淀法采用旋干后加超纯水复溶,去除了乙醇的溶剂效应,故对比2 种前处理方法后母乳低聚糖总离子流图的响应值即可确定最优前处理方法。图1a用乙腈前处理的母乳低聚糖的响应值为4.4×106,明显高于图1b用乙醇处理后的母乳样品低聚糖的响应值,约为2.2×106,通过后台对比峰面积可知用乙醇沉淀蛋白时低聚糖的损失量较大(低聚糖通过峰面积来定量),因此,本实验采用乙腈沉淀法作为母乳蛋白质的脱除方法。
2.2 质谱条件的确定
2.2.1 全离子扫描结果
Scan type 选择MS2scan,分别对12 种母乳标准品进行母离子全扫描,如表3所示,在正离子模式下12 种低聚糖均出现加钠母离子峰[23-24]。
2.2.2 子离子扫描结果
在Scan Type选择Product Ion,对12 种母乳低聚糖标准品的加钠母离子做子离子扫描,以获得12种低聚糖的离子对,扫描结果见表4。由于糖本身并不容易裂解,12 种低聚糖均找到一个响应较好的子离子。
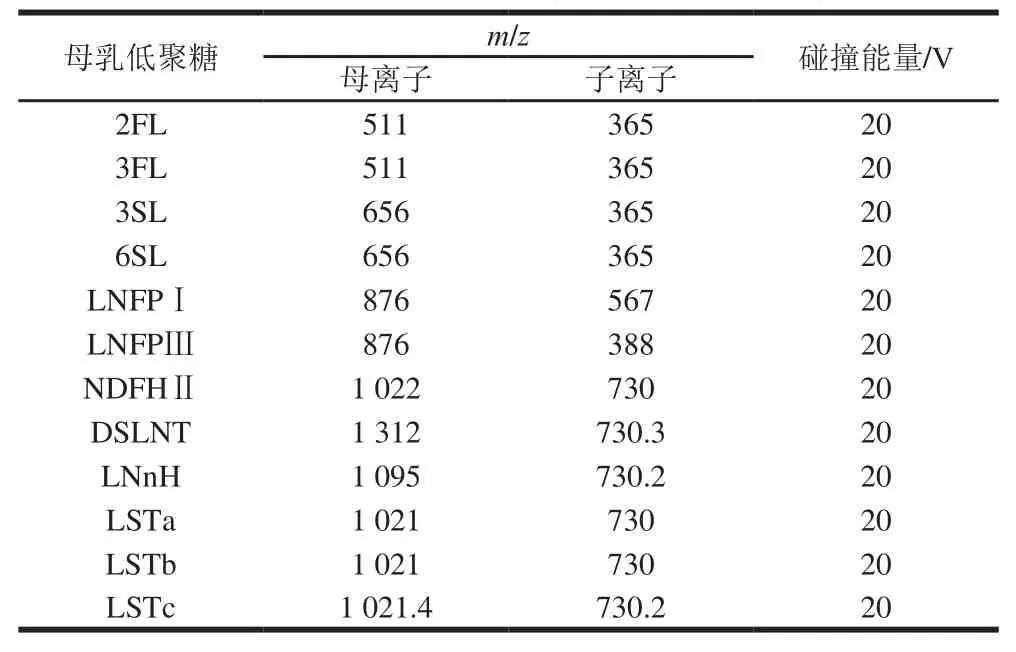
表4 12 种母乳低聚糖标准品子离子扫描结果Table4 Results of product ion scanning of 12 breast milk oligosaccharides
2.2.3 MRM优化结果

表5 12 种母乳低聚糖标准品多反应监测优化结果Table5 Results of MRM optimization for 12 oligosaccharides in breast milk
对已经找到的12 种母乳低聚糖标准品的离子对进行碰撞能量的优化,优化结果见表5。2FL、3FL、3SL、6SL、LNFPⅠ、LNFPⅢ、LNDFHⅡ、DSLNT、LNnH、LSTa、LSTb、LSTc 12种母乳低聚糖标准品多反应监测最优碰撞能量分别为40、38、35、34、58、67、46、34、67、43、40、34 V。
2.3 超高效液相色谱条件的确定
将12 种母乳低聚糖标准品配成5 mg/L混标用于液相条件优化实验。根据Amide氨基柱的特点(有机相不低于50%),初步设定流动相条件为:A为10 mmol/L甲酸铵,B为乙腈,流速为0.3 mL/min。采用梯度洗脱,0~40 min,95%~65% B,12 种母乳低聚糖混标的总离子流图见图2a。根据之前优化牛乳低聚糖获得的分离经验[13],在图2a的基础上进行液相条件的不断优化,实验结果证明改变进样时间对低聚糖的分离影响不大,故从流动相的配比上进行优化,通过改变梯度和走等度,获得最优梯度条件:0~10 min,95%~75% B;10~15 min,75% B;15~20 min,75%~65% B;20~21 min,65%~10% B;21~24 min,10% B;24~25 min,10~95% B;25~40 min,95% B,最优梯度条件下12 种母乳低聚糖混标的总离子流图见图2b。

图2 母乳低聚糖在不同流动相条件下的总离子流图Fig. 2 Total ion current chromatograms of human milk oligosaccharides under different mobile phase conditions
由图2可以看出,图2a中12 种母乳低聚糖并没有得到分离,而图2b中12 种低聚糖则得到了很好分离,且从后台提取12 种低聚糖的质谱多反应监测图谱,同分异构体均得到分离,该梯度条件下,可用于12 种母乳低聚糖的测定分析。
2.4 回归方程及精密度结果
将稀释好的不同质量浓度的母乳低聚糖标准品按优化好的条件进样分析,样品的质量浓度设为自变量X(mg/mL),色谱峰的峰面积Y设定为因变量,获得12 种低聚糖标准对照品标准曲线回归方程、线性相关系数以及其线性范围。按所述超高效液相色谱检测条件连续重复进样检测(n=3),根据物质的色谱峰峰面积相对标准偏差(relative standard deviation,RSD)来评价仪器的精密度,如表6所示。12 种母乳低聚糖标准品在设定的质量浓度范围内呈良好的线性关系(R2>0.98)。超高效液相色谱分析检测方法精密度良好,12 种糖类成分重复进样分析的RSD均控制在10%以内。
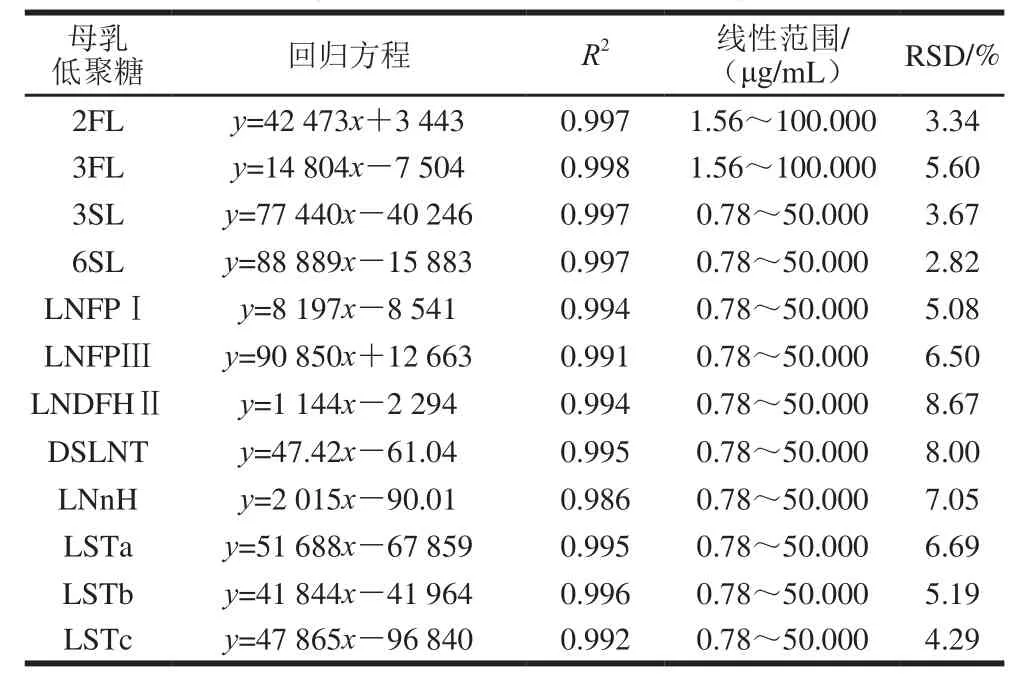
表6 12 种母乳低聚糖标准品回归方程Table6 Regression equations for 12 breast oligosaccharide
2.5 加标回收率实验结果
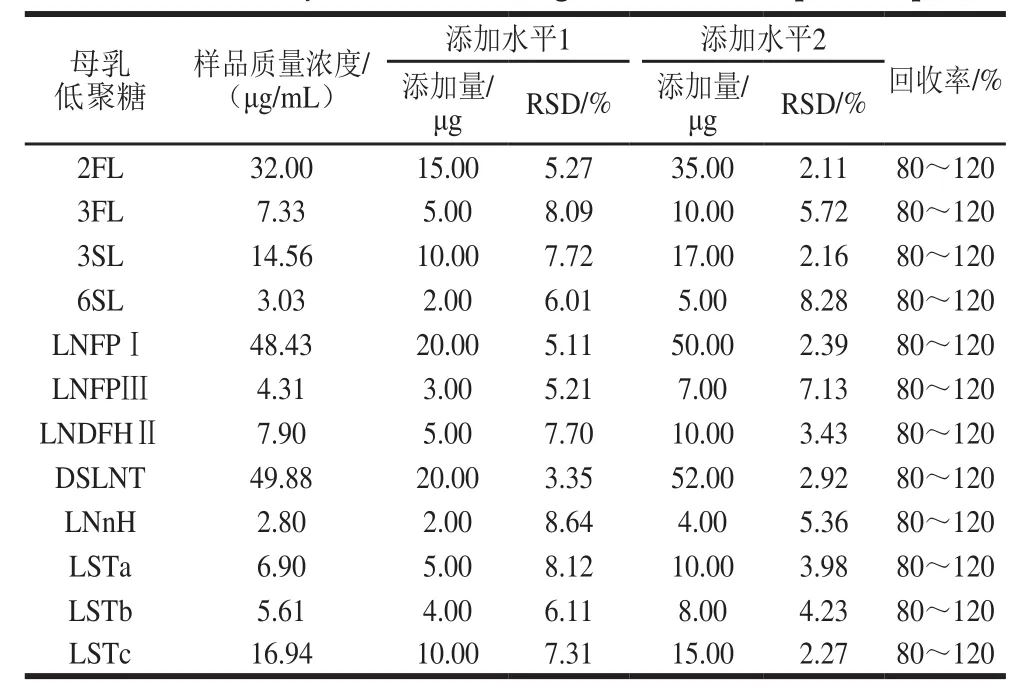
表7 12 种母乳低聚糖标准品回收率检测结果Table7 Recovery of 12 breast milk oligosaccharides from spiked samples
做加标回收实验评估方法的准确度。取母乳200 μL进行前处理后,并按照优化好的检测条件对其中的12 种低聚糖成分进行定量分析,获得不加标样品分析结果。然后取同一母乳样200 μL(每份样品重复3 次),根据测得的各低聚糖成分实际含量水平加标[25-26],并进行样品检测,12 种母乳低聚糖的加标回收结果见表7。不同添加量条件下,12 种母乳低聚糖的添加回收率均在80%~120%之间,样品前处理方法的准确性用RSD表示,且实验所得12 种低聚糖的RSD值均小于10%。因此,本实验所建立的方法可以用母乳中12 种低聚糖的检测分析[27]。
2.6 母乳低聚糖的测定结果
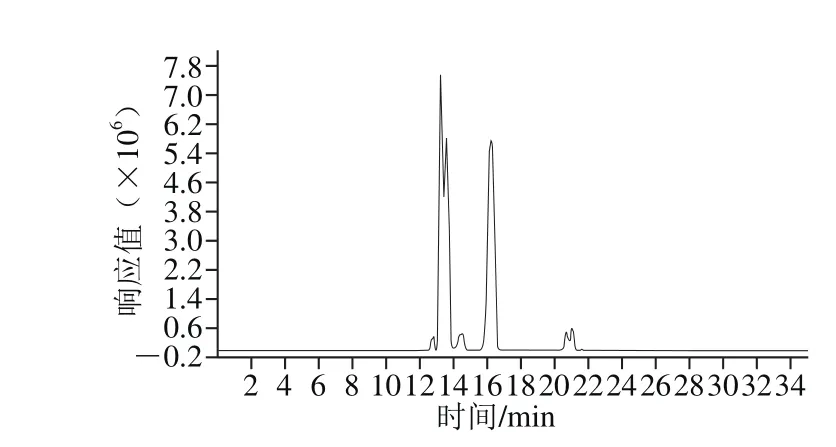
图3 母乳低聚糖总离子流图Fig. 3 Total ion current chromatogram of oligosaccharides in real breast milk sample
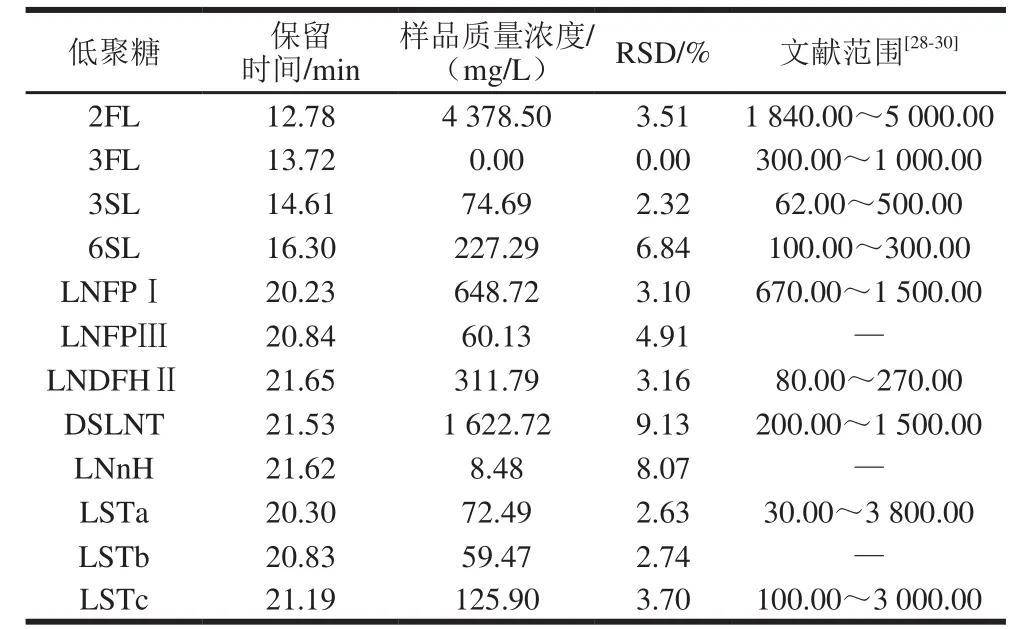
表8 成熟母乳中低聚糖测定结果Table8 Results of determination of oligosaccharides in mature human milk
对志愿者提供的成熟母乳进行前处理后按照建立的测定方法进行12 种低聚糖成分的测定,为减少实验误差,同1 份母乳样品测定3 次求平均值。母乳低聚糖的总离子流图见图3,测定结果见表8。通过阅读大量文献对12 种母乳低聚糖的质量浓度范围进行了总结,从母乳低聚糖的实验测定结果来看,12 种低聚糖的RSD均小于10%,且测定结果均在参考文献范围之内。12 种母乳低聚糖中2FL的质量浓度最高,与魏京华等[21]的结果一致。
3 结 论
本实验所建立的12 种母乳低聚糖的测定方法,前处理过程简单且所需样品量少,12 种低聚糖标准品在设定质量浓度范围内均线性良好(R2>0.98),添加回收率均在80%~120%之间,实验重复性和仪器精密度较好。
综上所述,本实验方法简单可行,可在短时间内对母乳中的12 种低聚糖进行准确的定性定量分析。
[1] MONTI L, CATTANEO T M, ORLANDI M, et al. Capillary electrophoresis of sialylated oligosaccharides in milk from different species[J]. Journal of Chromatography A, 2015, 1409(1): 288-291.DOI:10.1016/j.chroma.2015.07.076.
[2] THURL S, HENKER J, SIEGEL M, et al. Detection of four human milk groups with respect to Lewis blood group dependent oligosaccharides[J]. Glycoconjugate Journal, 1997, 14(7): 795-799.DOI:10.1023/A:1018529703106.
[3] 韩瑶, 吕志华, 姜廷福, 等. 电喷雾多级串联质谱技术区分人乳寡糖异构体[J]. 分析化学, 2006, 34(9): 1213-1218. DOI:10.3321/j.issn:0253-3820.2006.09.002.
[4] RUHAAK L R. Advances in analysis of human milk oligosaccharides[J]. Advances in Nutrition, 2012, 3(3): 406S-414S.DOI:10.3945/an.112.001883.
[5] GALEOTTI F, COPPA G V, ZAMPINI L, et al. On-line highperformance liquid chromatography-fluorescence detectionelectrospray ionization-mass spectrometry profiling of human milk oligosaccharides derivatized with 2-aminoacridone[J]. Analytical Biochemistry, 2012, 430(1): 97-104. DOI:10.1016/j.ab.2012.07.027.
[6] BOEHM G, STAHL B. Oligosaccharides from milk[J]. The Journal of Nutrition, 2007, 137(3): 847S-849S.
[7] KUNZ C, RUDLOFF S, BAIER W, et al. Oligosaccharides in human milk: structural, functional, and metabolic aspects[J]. Annual Review of Nutrition, 2000, 20(20): 699-722. DOI:10.1146/annurev.nutr.20.1.699.
[8] BODE L. Human milk oligosaccharides: every baby needs a sugar mama[J]. Glycobiology, 2012, 22(9): 1147-1162. DOI:10.1093/glycob/cws074.
[9] NEWBURG D S. Neonatal protection by an innate immune system of human milk consisting of oligosaccharides and glycans[J]. Journal of Animal Science, 2009, 87: 26-34. DOI:10.2527/jas.2008-1347.
[10] BING W. Sialic acid is an essential nutrient for brain development and cognition[J]. Annual Review of Nutrition, 2009, 29(1): 177-222.DOI:10.1146/annurev.nutr.28.061807.155515.
[11] URASHIMA T, SAITO T, NAKAMURA T, et al. Oligosaccharides of milk and colostrum in non-human mammals[J]. Glycoconjugate Journal, 2001, 18(5): 357-371.
[12] CHATURVEDI P, WARREN C D, RUIZ-PALACIOS G M, et al. Milk oligosaccharide profiles by reversed-phase HPLC of their perbenzoylated derivatives[J]. Analytical Biochemistry, 1997, 251(1):89-97. DOI:10.1006/abio.1997.2250.
[13] 王仲孚, 贺建宇, 尉亚辉, 等. 用于寡糖链分析的HPLC柱前衍生化方法研究进展[J]. 有机化学, 2006, 26(5): 592-598.DOI:10.3321/j.issn:0253-2786.2006.05.002.
[14] KOGELBERG H, PISKAREV V E, ZHANG Y, et al. Determination by electrospray mass spectrometry and1H-NMR spectroscopy of primary structures of variously fucosylated neutral oligosaccharides based on the iso-lacto-N-octaose core[J]. European Journal of Biochemistry, 2004, 271(6): 1172-1186. DOI:10.1111/j.1432-1033.2004.04021.x.
[15] CHAI W, PISKAREV V E, ZHANG Y, et al. Structural determination of novel lacto-N-decaose and its monofucosylated analogue from human milk by electrospray tandem mass spectrometry and1H NMR spectroscopy[J]. Archives of Biochemistry & Biophysics, 2005,434(1): 1161-1127. DOI:10.1016/j.abb.2004.09.035.
[16] MEYRAND M, DALLAS D C, CAILLAT H, et al. Comparison of milk oligosaccharides between goats with and without the genetic ability to synthesize αs1-casein[J]. Small Ruminant Research, 2013,113(2/3): 411-420. DOI:10.1016/j.smallrumres.2013.03.014.
[17] WARREN C D, CHATURVEDI P, NEWBURG A R, et al.Comparison of oligosaccharides in milk specimens from humans and twelve other species[J]. Advances in Experimental Medicine &Biology, 2001, 501(1): 325-332.
[18] HONG Q, RUHAAK L R, TOTTEN S, et al. Label-free absolute quantitation of oligosaccharidesusing multiple reaction monitoring[J].Analytical Chemistry, 2014, 86(5): 2640-2647. DOI:10.1021/ac404006z.
[19] TOTTEN S M, WU L D, PARKER E A, et al. Rapid-throughput glycomics applied to human milk oligosaccharide profiling for large human studies[J]. Analytical and Bioanalytical Chemistry, 2014,406(30): 7925-7935. DOI:10.1007/s00216-014-8261-2.
[20] MARTIN-ORTIZ A, SALCEDO J, BARILE D, et al. Characterization of goat colostrum oligosaccharides by nano-liquid chromatography on chip quadrupole time-of-flight mass spectrometry and hydrophilic interaction liquid chromatography-quadrupole mass spectrometry[J].Journal of Chromatography A, 2015, 1428: 143-153. DOI:10.1016/j.chroma.2015.09.060.
[21] 魏京华, 陈历俊, 赵军英, 等. 液相色谱-质谱法快速检测4 种乳源低聚糖[J]. 食品科学, 2016, 37(14): 86-91. DOI:10.7506/spkx1002-6630-201614015.
[22] NWOSU C C, ALDREDGE D L, LEE H, et al. Comparison of the human and bovine milk N-glycome via high-performance microfluidic chip liquid chromatography and tandem mass spectrometry[J].Journal of Proteome Research, 2012, 11(5): 2912-2924. DOI:10.1021/pr300008u.
[23] 薛向东, 张萍, 王仲孚, 等. 基于电喷雾电离质谱(ESI-MS)的苯胺稳定同位素标记对还原性寡糖(链)的定性定量分析方法[J]. 高等学校化学学报, 2010, 31(11): 2173-2180.
[24] AMANO J, OSANAI M, ORITA T, et al. Structural determination by negative-ion MALDI-QIT-TOFMSnafter pyrene derivatization of variously fucosylated oligosaccharides with branched decaose cores from human milk[J]. Glycobiology, 2009, 19(6): 601-614.
[25] 安小楠. 红枣低聚糖的HPLC分析及醇沉分离[D]. 保定: 河北农业大学, 2015.
[26] 陈海敏, 严小军, 郑立, 等. 不同水解模式下琼二糖多聚体的HPLC定量分析[J]. 中国海洋药物, 2004, 23(5): 30-34. DOI:10.3969/j.issn.1002-3461.2004.05.008.
[27] 王炼, 庞晶晶, 余辉菊. 超高效液相色谱法测定乳及乳制品中的三聚氰胺[J]. 分析试验室, 2010, 29(4): 53-55.
[28] MARYIN-SOSA S, MARTIN M J, GARCIA-PARDO L A, et al. Sialyloligosaccharides in human and bovine milk and in infant formulas: variations with the progression of lactation[J]. Journal of Dairy Science, 2003, 86(1): 52-59. DOI:10.3168/jds.S0022-0302(03)73583-8.
[29] THURL S, MUNZER M, HENKER J, et al. Variation of human milk oligosaccharides in relation to milk groups and lactational periods[J].British Journal of Nutrition, 2010, 104(9): 1261-1271. DOI:10.1017/S0007114510002072.
[30] MORENO F J, DR M L S. 1. Bioactivity of human milk oligosaccharides[M]//Food Oligosaccharides: Production, Analysis and Bioactivity. John Wiley & Sons, Ltd, 2014: 1-20.

