咪唑并嘧啶类杀菌剂对大肠杆菌抑菌活性的QSAR研究
余训爽
(长江大学化学与环境工程学院,湖北 荆州 434023)
余训民
(武汉工程大学化学与环境工程学院,湖北 武汉 430073)
咪唑并嘧啶是一类非常重要的杂环化合物。大量研究表明该类化合物具有较好的生物活性,如杀虫、杀菌、除草、抗病毒、抗癌等[1~6]。由于咪唑并嘧啶具有新型结构和独特的作用机理,有广谱的杀菌活性和低毒、高效等优点,因此在医药、农药等领域备受关注[7]。因此,利用定量结构—活性关系(QSAR)方法研究与开发新颖咪唑并嘧啶类杀菌剂具有十分重要的意义。Sacchi等[8~9]报道了以2-甲基-咪唑并[1,2-a]嘧啶为母核,分别合成了3-位被不同的羧酸衍生物取代的一系列2-甲基-咪唑并[1,2-a]嘧啶类衍生物,此类化合物对抑制环氧化酶(COX)具有较好的抑制活性,但未见对环氧合酶-2(COX-2)的选择性报道。戚繁等[10~14]在上述2类化合物结构的基础上,对咪唑并[1,2-a]嘧啶的结构进行修饰,合成了2-位和3-位被不同的芳烃基和卤代芳烃基取代的咪唑并[1,2-a]嘧啶类衍生物,并对所合成的化合物进行生物活性表征,实验测试表明,该类化合物具有潜在药理活性或生物活性,是一类选择性良好的COX-2抑制剂。为了寻求更高生物活性的咪唑并嘧啶类杀菌剂,本研究对2,3-二氢咪唑并[1,2-c]嘧啶类化合物的抑菌活性进行了探讨,以供咪唑并嘧啶类分子设计、合成与生物活性研究提供新的研究依据。
1 材料与方法
1.1 样本来源与分类

图1 标题化合物的基本结构
此类抗菌剂的结构与活性来源于Jani 等[1]的研究。为了确保QSAR模型具有代表性和稳定的可靠性,共筛选26个化合物分子,其基本骨架见图1。
根据随机和活性梯度分布原则,将化合物分为2组,其中1~20作为训练集,21~26作为测试集。所有化合物对大肠杆菌的抑制作用均以MIC/(μmol·dm-3)值表示,MIC值均转换成PMIC值[1],见表1。

表1 大肠杆菌的训练集和测试集化合物的生物学活性以及PMIC的预测结果
1.2 分子描述符的获取的方法
采用Gaussian 09W程序在DFT-B3 LYP/ 6-311++G(d,p)水平上全优化计算26个咪唑并嘧啶类抗菌剂分子结构,经振动分析确认无虚频,即势能面上的极小点,得到化合物的结构参数:分子最高占用和最低空轨道能(Ehomo和Elumo)、分子次最高占用和次最低空轨道能(Enhomo和Enlumo)、范德瓦尔斯能(EVDW)、正辛醇/水分配系数(logP)、分子极化度(a)、分子偶极矩(μx)、三维空间拓扑指数(Ys)等20余个参数。
1.3 分子描述符的筛选
结合遗传函数算法(GA)和主成分分析方法(PCA)在一定检验水平上挑选出的QSAR重要变量数作为输入层节点数;输出层神经元数对应于PMIC值。隐含层最佳节点数由训练结果确定。根据网络训练中训练集和预测集的均方根误差(RMSE)变化情况确定训练终止与否,为了避免过训练,本研究在训练过程中采用测试集进行监控,一旦测试集误差明显上升,则停止训练。
2 结果与分析
2.1 分子描述符筛选的结果
将获得的20余个参数用GFA-BPNN法找出与PMIC最密切相关的几个自变量。因GA算法的结果具有随机性,为此,设种群规模设定为30,交叉概率设定为0.8,变异概率设定为0.01,最大进化代数100。子代方程的优劣由复相相关系数来评价,子代的自适应性由Friedman的欠拟合函数LOF(lack-of-fit)来衡量[15]。若子代方程优于父代方程,保留子代方程,否则继续杂交,直至达到设定的目标。GFA-BPNN程序运行100次后,选取复相相关系数较大且将出现频率超过90%的结构参数用于建模。过多的描述符会导致模型的“过参数化”,为避免此情况发生,最终确定6个特征变量(表2)。由于结构描述符之间还存在一定的相关性,故用PCA法对原始数据进行降维,得到不相关的新变量,其结果见表2。

表2 主成分相关矩阵
经分析,前2个主成分因子的方差贡献率之和为86.74%(表3),故可用前2个主成分因子代表原始数据的绝大部分信息作为人工神经网络的输入因子,从而达到简化网络结构的目的。

表3 主成分及方差贡献
2.2 BPNN网络结构中隐含层个数的确定

图2 隐含层节点数与均方根误差的关系
神经网络的输入节点为2个主成分因子,输出节点为1个(PMIC),通过设定不同数目的隐含层节点数的网络体系,以训练10000次得到的训练集与预测集样本的均方根误差(RMSE)作为评价指标,训练结果见图2。根据图2,本研究选取2-3-1体系的网络用于随后的学习训练和预测验证。其他各参数如下:传递函数采用S型函数,训练函数为双曲正切(tansig)型函数,输出函数为“pureiin”线性函数;网络训练精度为0.0001,学习的初始速率为0.4,动量常数为0.9,其他参数为默认值。其结果平均标准误差为0.155,实验值与预测值的相关系数R2=0.9991,其预测结果见表1。
2.3 模型的检验与评价
为了确保模型应用于实际之前有良好的可靠性和预测能力,必须对模型进行严格的检验与评价。
2.3.1 模型的内部检验

图3 PMIC预测值与实验值的线性关系图
本研究用LOO法评价模型的内部预测能力和模型的稳健性,其检验统计参数见表4。
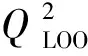
2.3.2 模型的外部检验
较强的内部预测能力不代表模型有较强的外部预测能力。为了确保模型的预测能力,将20个样本作训练集(Training set),6个样本为测试集(Testing set),其外部检验统计参数见表4。

表4 模型的相关统计参数
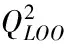
2.4 致毒机理探讨
由表2因子负载矩阵值可知:Elumo和logP是影响咪唑并嘧啶类杀菌剂活性的主要因素。
1)Elumo作为一个重要的分子电性参数,反映了不同分子抑制反应的相对难易程度。
由第一主成分因子系数可知:咪唑并嘧啶类杀菌剂对大肠杆菌的毒性大小与Elumo呈负相关,说明其值越小,咪唑并嘧啶类杀菌剂的毒性愈大。由此可以推测咪唑并嘧啶类杀菌剂在生物体内的毒性作用以亲电反应为主,咪唑并嘧啶类杀菌剂的Elumo愈低,亲电性愈强,越易进攻生物大分子的巯基、活性氧等富电子原子或原子团,毒性愈大。故在R取代基团中的吸电子效应越强,其分子的毒性愈大,且对位>邻位(表1)。
2)logP作为一个重要的热力学参数,反映了不同分子在受体内富集的相对难易程度。
第一主成分因子系数中logP的系数表明它们对化合物毒性呈正贡献,随着R1取代基的引入,分子体积的增加不足以影响其通过细胞膜,因为体积增大,分子疏水性增强,导致其分子有很好的脂溶性,易于生物富集,有利于增加化合物的毒性,可见咪唑并嘧啶类抗菌剂分子在生物体内的富集能力是影响化合物对大肠杆菌抑制作用的另一个方面。
另外,由表2还可知,分子的活性与空间拓扑指数(Ys)和x轴方向的偶极距(μx)有一定的相关性,表明基团的空间效应对活性和选择性均具有影响。
3 结论
研究结果表明,咪唑并嘧啶类分子对大肠杆菌的抑菌作用主要是通过在细胞膜内聚集(logP表征),进而与生物大分子发生电子转移(Elumo表征)而完成的,且抑菌活性随着取代基团中的吸电子效应的增强而增大。此结果可为设计新的此类药物分子提供理论依据和研究思路。
[1]Duardo Bores de Melo,Márcia Miguel Castro Ferreira.Multivariate QSAR study of 4,5-dihydroxypyrimidine arboxamides as HIV-1 integrase Inhibitors[J].Eur J Med Chem,2009,44:3577~3583.
[2]Lee S,Park S B.An Efficient One-Step Synthesis of Heterobiaryl Pyrazolo [3,4-b]pyridines via Indole Ring Opening[J].Org Lett,2009,11:5214~5217.
[3]马超,李坤,杨晨,等.吡唑衍生物合成研究进展[J].国外医药抗生素分册,2011,32(5):211~218.
[4]蔡继平,蒋华江,林显明.3(5)-氨基毗吟的合成工艺改进[J].化工时刊,2005,20(5):15~19.
[5]Zhang X Y,Song Y P,Gao L,etal.Sythesis pyrazolopyrimidines from 1,2-allenic ketones and Aminopyrazoles [J].Synfacts,2014,10:362~370.
[6]Revathi A,Satish G,Kaskhedikar.Synthesis,antitubercular activity and QSAR analysis of substituted nitroaryl analogs chalcone,pyrazole,isoxazole,and pyrimidines[J].Med Chem Res,2013,22:3863~3880.
[7]吴琴,宋宝安,胡德禹,等.嘧啶类化合物的合成及抗菌活性研究进展[J].有机化学,2009,29(3):365~379.
[8]Sacchi A,Ablignente E,Rossi F,etal.Research on heterocyclic canpounds.lmidazo[1,2-a]pyrinidine 2-acetic derivatives synthesis and anti-inflanmatory activity[J].Eue J Med Chem,1997,32:677~682.
[9]Laneri S,Sacchi A,Rossi F,etal.Research on 2-Methylimidazo[1,2-a]pyrinidine-3-carboxylic derivatives synthesis and anti-inflanatory activity[J].Eue J Med Chem,1998,33:163~170.
[10]戚繁,周金培,丁一为,等.咪唑并[ 1,2-a ]嘧啶类化合物的合成和抗炎活性[J].中国药科大学学报,2009,40(1):16~20.
[11]崔永涛,王建强,殷俊,等.以水作溶剂微波法合成 1,4-二氢苯并咪唑并[1,2-a]嘧啶类衍生物[J].应用化学,2010,27(1):53~57.
[12]阿布拉江·克依木.新型含三唑及噻唑环的腙类化合物的合成及生物活性研究[J].有机化学,2011,31(5):724~727.
[13]刘举,薛其俊,王颖,等.新型咪唑并[ 1,2-a ]嘧啶类化合物的合成[J].合成化学,2016,21(6):679~682.
[14]Xue-Jie Fang,Ponmani Jeyakkumary,Srinivasa Rao Avula,etal.Design,synthesis and biological evaluation of 5- fluorouracil-derived benzimidazoles as novel type of potential antimicrobial agents[J].Bioorganic & Medicinal Chemis Try Letters,2016,26:2584~2588.
[15]李冀.QSPR/QSAR在有机物危险特性预测中的应用[D].长沙:中南大学,2012.
[16]覃礼堂,刘树深,肖乾芬,等.QSAR模型内部和外部验证方法综述[J].环境化学,2013,32(7):2015~2010.
[17]Chirico N,Gramatica C.Real external predictivity of QSAR models:How to evaluate it comparison of different alidation criteria and the need for scatter plot inspectio[J].J Chem lnf Mode1,2012,52:2044~2058.
[18]Tropsha A,Gramatica P,Gombar V K.The importance of being earnest:Validation is the absolute essential for successful application and interpretation of QSPR models[J].QSAR Comb Sci,2003,22:69~77.

[编辑] 余文斌

