复合酶法结合液相色谱技术测定山药酒中薯蓣皂苷的含量
王晨慧,饶 静,2,辛 鹏,2,李春扬,2,张晓磊,2*,尹建军,2,宋全厚,2
(1.中国食品发酵工业研究院,北京 100015;2.国家食品质量监督检验中心,北京 100015)
山药是一种药食同源的保健佳蔬,具有独特的药用和保健价值[1]。随着人们对保健和功能性食品需求的不断上升,以山药为原料,经现代生物技术手段发酵而成的山药酒,不仅可以最大程度的保留山药中的活性成分,还可通过微生物的代谢合成多种有益物质,越来越受到消费者的青睐。近年来,食品中的活性功能成分日益受到关注,已成为热门的研究课题,薯蓣皂苷作为山药特有的活性成分,具有明显的抗肿瘤作用[2],在治疗心血管疾病、脑炎、皮肤病方面也有显著效果[3],其研究多集中于山药或其他制品[4-5],在山药酒中则未见报道,检测技术的缺失,极易导致对活性功能成分的过分夸大,影响行业健康有序的发展,因此,本研究旨在建立山药酒中薯蓣皂苷的检测技术,并对市售山药酒中薯蓣皂苷含量进行分析比较,以填补资料空白,为提高产品品质、促进行业科技进步与良性健康发展提供有力的技术支撑。
1 材料与方法
1.1 材料与试剂
6种山药酒样品(1种发酵原酒、4种山药发酵酒和1种以山药为原料的黄酒,品牌A、品牌B,分别编号为1#、2#、3#、4#、5#、6#):市售。
三氯甲烷、磷酸二氢钾、磷酸氢二钾(均为分析纯)、盐酸(纯度≥98%):北京化工厂;纤维素酶(100 U/mg)、淀粉酶(50 U/mg)、甲醇、乙腈(均为色谱纯)、薯蓣皂苷对照品(纯度≥98%):上海安谱实验科技股份有限公司。
1.2 仪器与设备
Waters高效液相色谱仪(high performance liquid chromatograph,HPLC)(配有2487UVD紫外检测器):美国Waters公司;Milli-Q Reference超纯水发生器:美国Millipore公司;AL204-IC万分之一天平:梅特勒-托利多仪器上海有限公司。
1.3 方法
1.3.1 酶解液制备
取200 mL山药酒于蒸发皿中,蒸发浓缩至5 mL左右,置于磷酸缓冲溶液中,加入一定量的酶(酶用量按浓缩前山药酒取样量计算),在一定温度条件下酶解一段时间,加入100 mL的5%盐酸-甲醇溶液(1∶1,V/V),沸水浴条件下回流5 h,冷却至室温后,调节pH=8,在55℃条件下旋蒸至30 mL,用50 mL三氯甲烷萃取3次,萃取后的有机相旋蒸近干,用2 mL甲醇溶解,过膜于色谱瓶中待测。
1.3.2 单因素试验优化山药酒酶解液制备工艺
量取200 mL山药酒于蒸发皿中,蒸发浓缩后,置于磷酸缓冲溶液中,分别考察酶的种类(淀粉酶、纤维素酶、复合酶(纤维素酶∶淀粉酶酶活力比=1∶1))、酶用量(0.5 U/mL、1 U/mL、2 U/mL、3 U/mL、4 U/mL)、酶解初始pH值(2.5、5.0、5.8、6.8、7.8)、酶解时间(3 h、6 h、12 h、24 h、48 h)、酶解温度(35℃、40℃、45℃、50℃、55℃)等因素对山药酒中薯蓣皂苷含量的影响。
1.3.3 正交试验优化山药酒酶解液制备工艺
在单因素试验的基础上,以薯蓣皂苷含量为考察指标,利用L9(34)正交试验分别考察复合酶用量(A)、酶解时间(B)、酶解温度(C)、酶初始pH值(D)对薯蓣皂苷含量的影响。正交试验因素与水平见表1。
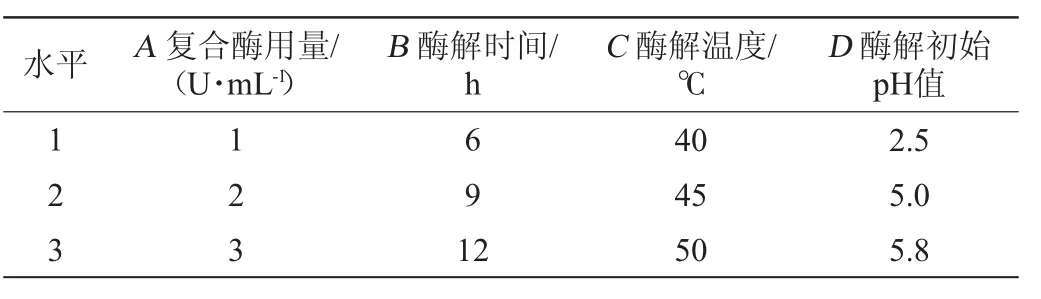
表1 山药酒酶解条件优化正交试验因素与水平Table1 Factors and levels of orthogonal experiments for enzymolysis conditions of yam wine
1.3.4 测定方法
采用高效液相色谱法测定薯蓣皂苷含量。色谱条件[6-10]为InertsilRODS-3色谱柱(250 mm×4.6 mm,5 μm);流动相:乙腈-水(50∶50,V/V);流速:1.0 mL/min;紫外检测波长:203 nm;柱温:30℃;进样量:10 μL。
标准曲线的绘制:准确配制质量浓度为1 g/L薯蓣皂苷标准储备液,再用甲醇分别配制成5mg/L、10mg/L、25mg/L、50 mg/L、100 mg/L、200 mg/L的薯蓣皂苷标准工作液。以薯蓣皂苷的峰面积(y)为纵坐标,质量浓度(x)为横坐标绘制标准曲线,经线性回归,回归方程为:y=2979.9x-11600;相关系数R为0.998 9,表明薯蓣皂苷在4.91~196.40 mg/L范围内线性关系良好。
2 结果与分析
2.1 单因素试验结果
2.1.1 酶种类的选择
薯蓣皂苷在植物体内多与糖以糖苷键的形式结合成甙,强酸和酶都可以破坏薯蓣皂甙的糖苷键,有利于薯蓣皂苷的分离。目前,薯蓣皂苷的提取方法主要有直接酸解法[11]、超声提取法[12]、回流提取法[6]和酶解法[13-15],而酶解法可采用温和的方式有效降解糖苷键,对薯蓣皂苷的提取效果优于超声提取法和回流提取法。本研究采用淀粉酶、纤维素酶和复合酶解法(纤维素酶∶淀粉酶酶活力比=1∶1)进行提取,以薯蓣皂苷的含量为指标,确定山药酒中薯蓣皂苷的最佳提取方法,试验结果如图1。

图1 单一酶解法与复合酶解法试验结果比较Fig.1 Comparison of experimental results of single and complex enzyme methods
由图1可知,复合酶解法提取薯蓣皂苷的效果优于单一酶解法,且采用复合酶解法得到的皂苷含量为1.147 mg/L,因此,选择复合酶解法进行样品提取。
2.1.2 复合酶用量对薯蓣皂苷含量的影响

图2 复合酶用量对薯蓣皂苷含量的影响Fig.2 Effect of complex enzyme addition on the content of diosgenin
由图2可知,薯蓣皂苷的含量随复合酶用量的增加呈先增加后趋于平缓的趋势,当复合酶用量为2 U/mL时,薯蓣皂苷的含量最大,为1.143 mg/L,继续增加酶用量,薯蓣皂苷含量略有下降。这可能与酶量增加到一定程度时,酶分子过于饱和,一部分酶不能与底物结合,使得水解速度变慢,从而导致薯蓣皂苷浓度降低相关。因此选择复合酶用量为2 U/mL进行后续试验。
2.1.3 酶解初始pH值对薯蓣皂苷含量的影响
由图3可知,薯蓣皂苷的含量随酶解初始pH值的升高呈先增加后减少的趋势,当酶解初始pH值为5.0时有利于复合酶发挥最大活力,薯蓣皂苷的含量最高,继续升高pH值,薯蓣皂苷含量开始减少。过高或过低都不利于酶解作用,浸提效率降低。因此选择酶解初始pH值为5.0进行后续试验。

图3 酶解初始pH值对薯蓣皂苷含量的影响Fig.3 Effect of enzymolysis initial pH on the content of diosgenin
2.1.4 酶解时间对薯蓣皂苷含量的影响

图4 酶解时间对薯蓣皂苷含量的影响Fig.4 Effect of enzymolysis time on the content of diosgenin
由图4可知,薯蓣皂苷含量随着酶解时间的延长呈先增加后缓慢减少的趋势,当酶解时间为9 h时,薯蓣皂苷含量达到最大值。继续延长酶解时间,薯蓣皂苷含量反而下降,这可能由于发酵时间过长,薯蓣皂苷本身结构进一步分解,从而影响酸解后薯蓣皂苷含量的测定。因此选择酶解时间为9 h进行后续试验。
2.1.5 酶解温度对薯蓣皂苷含量的影响

图5 酶解温度对薯蓣皂苷含量的影响Fig.5 Effect of enzymolysis temperature on the content of diosgenin
由图5可知,薯蓣皂苷含量随着酶解温度的升高呈先增加后减少的趋势,当酶解温度为45℃时,薯蓣皂苷含量最高,达到1.145 mg/L,然而继续升高酶解温度时,薯蓣皂苷含量开始下降。这可能由于温度过高导致复合酶部分失活或影响了其协同作用,从而影响山药酒中薯蓣皂苷的提取效率。因此选择酶解温度为45℃进行后续试验。
2.2 正交试验结果
在单因素试验的基础上,通过L9(34)正交试验确定最佳条件,正交试验结果与分析见表2。

表2 山药酒酶解条件优化正交试验结果与分析Table 2 Results and analysis of orthogonal experiments for enzymolysis conditions of yam wine
由表2可知,根据R值对酶解影响因素排序为复合酶用量>酶解初始pH值>酶解时间>酶解温度,根据正交试验极差分析确定最优条件为A2B3C1D2,即复合酶用量为2U/mL,酶解时间为12 h,酶解温度为40℃,酶解初始pH值为5.0。在此条件下,薯蓣皂苷含量为1.158 mg/L。
2.3 样品测定结果
采用上述方法对市售2个品牌的6种山药酒中薯蓣皂苷的含量进行测定,结果见表3。对照品及典型样品高效液相色谱分析图谱见图6。

表3 市售山药酒中薯蓣皂苷含量的测定结果Table 3 Determination results of diosgenin content in commercial yam wine
由表3可知,6种样品中薯蓣皂苷含量范围为0.106~1.156 mg/L。山药发酵原酒(1#)中薯蓣皂苷含量最高,为1.156 mg/L;4种山药发酵酒(2#、3#、4#、5#)薯蓣皂苷含量均低于以山药为原料的黄酒(6#);品牌A的3种山药发酵酒(2#、3#、4#)中薯蓣皂苷含量接近,品质较为稳定。上述结果为深入研究山药酒中薯蓣皂苷及其他活性功能成分提供了有价值的数据参考。

图7 对照品(A)及典型样品(B)高效液相色谱色谱图Fig.7 Chromatography of reference substances(A)typical samples(B)analysis by HPLC
3 结论
本研究确立复合酶法结合液相色谱测定山药酒中薯蓣皂苷的方法,酶解条件为复合酶用量为2U/mL,酶解时间为12 h,酶解温度为40℃,酶解初始pH值为5.0。采用InertsilRODS-3色谱柱(250 nm×250 nm,5 μm);流动相为乙腈-水(50∶50,V/V);流速1.0mL/min;柱温30 ℃;检测波长203 nm。采用这一技术对市售2种品牌6种山药酒产品进行测定,薯蓣皂苷含量范围为0.106~1.156 mg/L。本研究所建立的方法简便、准确、可靠,适用于山药酒中活性功能成分薯蓣皂苷的检测,可为提高产品品质提供有力的数据支撑和技术手段。
[1]刘绣华,白 冰.怀山药与同属植物甾体成分差异性比较研究[J].河南大学学报:自然科学版,2012,42(5):548-553.
[2]王晓荣,李湧健,程彬彬.薯蓣皂苷元抗肿瘤作用及其机制研究[J].西部中医药,2014,27(5):140-143.
[3]王淑荣,凌 霜,张庆光,等.薯蓣皂苷现代药理学研究进展[J].中国药理学通报,2017,33(2):161-166.
[4]李 祥,张 青,赵 倩,等.表面活性剂在盾叶薯蓣中萃取皂苷的应用研究[J].中国酿造,2012,31(2):68-71.
[5]周宝珍.不同产地黄精薯蓣皂苷元含量的研究[J].陕西农业科学,2017,63(8):42-45.
[6]周新勇,宋曙辉,罗 晖,等.反相高效液相色谱法测定紫山药中薯蓣皂苷的含量[J].食品工业科技,2011,32(7):420-422.
[7]CHEOK C Y,SALMAN H A K,SULAIMAN R.Extraction and quantification of saponins:A review[J].Food Res Int,2014,59(4):16-40.
[8]REN Y,CHEN Y,HU B,et al.Microwave-assisted extraction and a new determination method for total steroid saponins fromDioscorea zingiberensisC.H.wright[J].Steroids,2015,104:145-152.
[9]李惠芬,平 渊,陈 刚,等.高效液相色谱法和薄层色谱法测定重楼中薯蓣皂苷元的含量[J].中草药,2003,34(2):127-129.
[10]LUO J,SHEN Y X,ZHOU N,et al.Content determination of diosgenin inParis polyphyllavar.yunnanensisfrom 14 different habitats by HPLC[J].China Pharm,2015,26(21):2965-2967.
[11]张社利,许文静,张会菊,等.高效液相色谱法测定怀山药中的薯蓣皂苷元[J].理化检验:化学分册,2013,49(1):33-34.
[12]郭盛磊,王振月,王 博,等.超声波辅助提取穿山龙中薯蓣皂苷元的实验研究[J].黑龙江医药,2010,23(1):34-36.
[13]江 慧,孙 蓉,汪魏平,等.穿山龙中薯蓣皂苷酶提取工艺的优化[J].中成药,2017,39(3):621-624.
[14]王彦平,杨庆莹,孙瑞琳,等.不同酶法辅助提取紫山药皮薯蓣皂苷及其抗氧化活性研究[J].食品工业科技,2017,38(10):200-204.
[15]LI WJ,WANG C Z,ZHANG S J,et al.Application of multivariate composite enzymatic hydrolysis in extraction of the diosgenin from yellow ginger[J].Biomass Chem Eng,2014,48(4):23-27.

