诺丽酒增强免疫功能的实验研究
孟 君,滕 晖,张 凯,唐 雪,李晓娟*
(1.株洲千金药业股份有限公司,湖南 株洲 412000;2.江南大学 食品学院,江苏 无锡 214122)
诺丽(Morinda citrifoliaL.)又名海巴戟天、海巴戟,是南太平洋岛国及其他热带、亚热带地区生长的小型灌木或乔木,已有2 000多年的历史[1-2],在我国海南、西沙、台湾亦有种植。诺丽果富含多种必需氨基酸、维生素、微量元素、多糖等营养成分[3]以及酚类、黄酮类等植物活性物质[4],具有清除自由基、抗氧化、抗衰老、抗肿瘤、抗炎症、缓解疼痛、提高免疫力等功效[5]。研究表明,诺丽果汁含有丰富的多糖类、三萜类、环烯醚萜类及抗氧化物质,能激活细胞免疫系统(包括NK细胞、巨噬细胞、T淋巴细胞),刺激胸腺发育[6],促进炎症细胞因子的释放以增强免疫力[7],对多种疾病有预防和治疗作用。诺丽作为一种新兴保健食材,在西方社会的普及程度日益提高[8]。2010年,诺丽果浆已获批为我国新食品原料,对于诺丽果的加工和利用也在不断的改进和创新。
诺丽酒是以诺丽果汁为原料,结合现代新工艺自主研究制作的一款果酒,并依据传统中药组方加入枸杞、龙眼、黄精、红枣、人参等中药成分,具有补益心脾、养血安神、健脾润肺、补气养阴等功效。本研究分别从细胞免疫功能、体液免疫功能、单核-巨噬细胞功能、NK细胞活性和血清细胞因子水平5个方面评价了诺丽酒的免疫增强作用,以期为诺丽酒的保健研究和开发提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
诺丽酒(酒精度为9%vol):株洲千金药业股份有限公司。
1.1.2 培养基与试剂
RPMI1640细胞培养基:南京建成生物工程研究所;刀豆蛋白A(concanavalinA,ConA)、没食子酸(纯度≥98%):美国Sigma公司;印度墨汁:北京索莱宝科技有限公司;绵羊红细胞、豚鼠血清:南京森贝伽生物技术有限公司;细胞因子测定试剂盒:厦门慧嘉生物科技有限公司;芦丁(纯度≥98%):上海哈灵生物科技有限公司;Hank's液、胎牛血清:美国Gibco公司;YAC-1细胞:北京北纳科技有限公司。
1.2 仪器与设备
BioTek Epoch全波长酶标仪:美国Biotek公司;5804R离心机:德国Eppendorf公司;BBD6220细胞培养箱:美国ThermoFisher公司;FACSCalibur流式细胞仪:美国BD公司。
1.3 方法
1.3.1 酿造工艺流程

1.3.2 动物与分组
240只C57BL/6J小鼠(4周龄,(12.09±0.27)g):上海斯莱克实验动物有限责任公司,饲喂于江南大学实验动物中心。采用12/12 h光照周期(8∶00-20∶00),恒温(23±2)℃,恒湿(60±5)%条件,所有实验操作均按照江南大学动物使用和福利协会要求进行。
预饲1周后,小鼠随机分为:①空白组(CON,10只),灌胃生理盐水0.2 mL;②酒基对照组(CON-WB,10只),灌胃含9%乙醇生理盐水0.2mL;③蜂胶组(阳性对照,CON-PRO,10只),灌胃含10%蜂胶的溶液0.2 mL;④低/中/高剂量诺丽酒组(L-NONI/M-NONI/H-NONI,每组10只),灌胃10mL/kg体质量、20mL/kg体质量、40mL/kg体质量诺丽酒。整个实验周期为45 d,所有动物每天相同时间点灌胃1次,自由进食、饮水。
1.3.3 分析检测方法
蛋白质含量测定:采用GB5009.5—2010《食品中蛋白质的测定》凯氏定氮法;粗脂肪含量测定:采用GB/T 5009.6—2016《食品中粗脂肪的测定》索氏抽提法;总糖与还原糖含量测定:采用GB/T 15038—2006《葡萄酒、果酒通用分析方法》斐林试剂滴定法;总多酚(以没食子酸计):Folin-Ciocaleu法[9];总黄酮:分光光度法[10];增强免疫功能测定:参照卫生部《保健食品检验与评价技术规范》(2013版)中增强免疫力功能检验方法。
1.3.4 小鼠体质量及脏器指数
最后一次给药后禁食12 h,称体质量后脱臼处死,取脾脏、胸腺,去尽筋膜,用滤纸吸干表面血污,称质量,脏器指数计算公式如下:

1.3.5 细胞免疫功能测定
小鼠脾淋巴细胞转化实验采用四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT)法[11]:取6孔板,孔板上放置200目细胞筛,加入4 mL Hank's液,无菌取小鼠脾脏后置于细胞筛上,用注射器内芯磨碎,制成单细胞悬液,再用Hank's液洗涤两次。将细胞悬浮于2 mL完全培养基中,计数,调整浓度为3×106个/mL。取悬液1 mL于6孔板中(两孔),一孔加入100 μg/mL ConA75 μL,另一孔作为对照孔。置于细胞培养箱培养72 h。培养结束前4 h,吸去上清0.7 mL,加入0.7 mL不含小牛血清的RPMI1640培养基,同时加入MTT 50 μL/孔,继续培养4 h。培养结束后,毎孔加入1 mL酸性异丙醇,吹打使紫色结晶完全溶解,分装到96孔板中,于波长570 nm处测吸光度值。以加入ConA孔的光密度减去不加ConA孔的光密度值代表淋巴细胞的增值能力。脾淋巴细胞增值能力计算公式如下:

二硝基氟苯诱导的迟发型变态反应实验采用耳肿胀法[11]:取二硝基氟苯50 mg与5 mL丙酮麻油溶液(丙酮∶麻油=1∶1)混匀。小鼠腹部用8%硫化钠溶液脱毛后,用50 μL二硝基氟苯溶液均匀涂抹。5 d后,用二硝基氟苯溶液10 μL均匀涂抹于小鼠一侧耳朵。24 h后,用打孔器取下耳片,称质量,耳片质量差值表示迟发型变态反应强弱。耳肿胀率计算公式如下:

1.3.6 体液免疫功能测定
抗体生成细胞检测[11]:实验5 d前小鼠腹腔注射2%绵羊红细胞0.2 mL。取0.5 g琼脂糖加入100 mL生理盐水中,加热溶解,50℃时以1 mL/孔加入6孔板中,冷却凝固后,作为底层培养基。取0.5g琼脂糖加入100mLHank's液中,加热溶解,以0.5 mL/管加入试管中50℃保温,作为顶层培养基。无菌取小鼠脾脏制成单细胞悬液,调整浓度为1×107个/mL。取脾细胞悬液200 μL,20%绵羊红细胞50 μL加入顶层培养基中,迅速混匀,倒入底层培养基上。培养板放入细胞培养箱培养1 h,毎孔加入500 μL用培养基稀释10倍的补体,孵育2 h。结果以空斑数/106脾细胞数表示。
血清溶血素测定采用半数溶血值(halfhemolyticvalue,HC50)法:实验5 d前小鼠腹腔注射2%绵羊红细胞0.2 mL。小鼠眼球取血,放置1 h后4 000 r/min离心10 min,收集血清。样品管:取血清10 μL,用1 mL 5倍稀释的SA缓冲液(C4H4N2O30.46g,MgCl20.1g,CaCl2·2H2O0.2g,NaCl8.38g,NaHCO30.252 g,C8H11N2NaO30.3 g,加蒸馏水至1 000 mL)稀释,在离心管中加入100 μL。空白管:加入100 μL 5倍稀释的SA缓冲液。毎管依次加入10%绵羊红细胞50 μL,补体100 μL。37℃保温30 min,1 500 r/min离心10 min。样品管与空白管各取50 μL于96孔板中,加入都氏试剂150 μL。半数溶血空加入10%绵羊红细胞12.5 μL,加都氏试剂187.5 μL,放置10 min。在波长540 nm处测吸光度值。半数溶血值计算公式如下:

1.3.7 单核-巨噬细胞功能测定
小鼠碳廓清实验:小鼠称体质量,按毎10 g体质量0.1 mL从尾静脉注射用生理盐水稀释3倍的印度墨汁。注入后2 min、10 min,分别从小鼠内眦静脉丛取血20 μL,并立即加入到2 mL 0.1%Na2CO3溶液中。于波长660 nm处测吸光度值。吞噬指数a计算公式如下:

式中:OD1为2 min时的吸光度值;OD2为10 min时的吸光度值;t1为第一次取血时间;t2为第二次取血时间。
小鼠腹腔吞噬荧光微球实验:实验前5 d给小鼠腹腔注射0.2mL2%绵羊红细胞激活小鼠巨噬细胞。颈椎脱臼处死小鼠,腹腔注射加小牛血清的Hank's液3 mL/只,轻揉3 min,再将腹水吸出,调整巨噬细胞浓度为(4~6)×105/mL。取巨噬细胞1 mL于6孔板中,加入荧光微球(1×107/板),置于细胞培养箱孵育2 h,孵育后弃上清,用磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤2次。200目筛网过滤后上流式细胞仪分析。巨噬细胞吞噬荧光微球吞噬率计算公式如下:

1.3.8 NK细胞活性测定
靶细胞制备:实验前24 h将YAC-1细胞传代培养,用培养基调整细胞浓度为4×105个/mL。效应细胞制备:小鼠无菌取脾并制成单细胞悬液,调整浓度为2×107个/mL。取靶细胞和效应细胞各100 μL加入U形96孔板;靶细胞自然释放孔加靶细胞和培养基各100 μL;靶细胞最大释放孔加靶细胞和2.5%曲拉通各100 μL。置于细胞培养箱中孵育4 h,取出后1 500 r/min离心5 min,取上清100 μL置于96孔板中,同时加入乳酸脱氢酶(lactate dehydrogenase,LDH)基质液100 μL,静置3 min,毎孔加1 mol/L HCl 30 μL,波长490 nm处测吸光度值。NK细胞活性计算公式如下:

1.3.9 细胞因子测定
小鼠采用摘除眼球方法取血,分离血清,按照酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒说明书操作,测定小鼠血清中白细胞介素(interleukin,IL)-1、IL-6、IL-10以及肿瘤坏死因子(tumournecrosisfactor,TNF)-α含量。
1.3.10 数据处理
实验数据采用SPSS Statistics 23分析处理,以平均值±标准差表示。
2 结果与分析
2.1 诺丽酒主要营养成分
由表1可知,诺丽酒中蛋白质含量为(0.25±0.02)g/100mL,粗脂肪含量为(0.97±0.01)g/100 mL,总糖和还原糖含量分别为(6.21±0.09)g/100 mL和(5.49±0.10)g/100 mL。诺丽酒的总多酚和总黄酮含量丰富,分别为(553.60±0.82)μg/mL与(230.56±1.68)μg/mL,具有降脂、抗氧化、抗炎、镇痛、抗肿瘤等多种功效[12]。
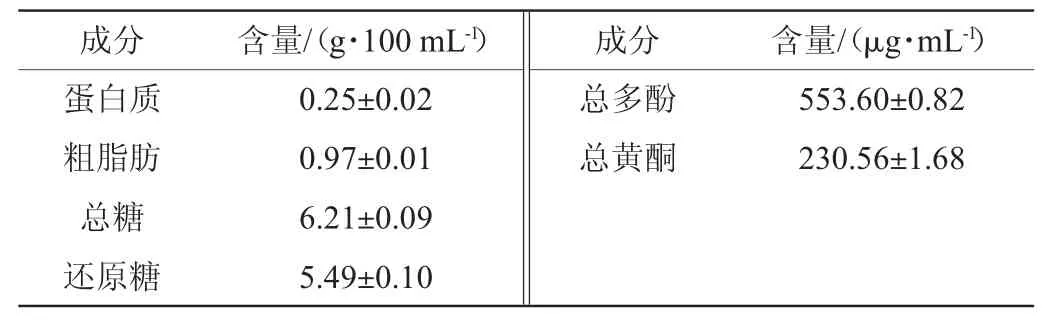
表1 诺丽酒的营养成分及活性物质分析Table 1 Analysis of nutritional components and active substances of Noni wine
2.2 小鼠体质量及脏器指数
脾脏和胸腺是动物机体内重要的免疫器官,是免疫细胞产生、分化、成熟、增值的主要场所。免疫器官的质量是反应机体非特异性免疫的重要指标[13]。由表2可知,连续灌胃45 d后,三个剂量诺丽酒组与CON-WB组相比均无显著性差异(P>0.05),表明诺丽酒对小鼠体质量和免疫脏器指数无明显影响。

表2 小鼠体质量及脏器指数Table 2 Body mass and visceral indexes of mice
2.3 细胞免疫功能

表3 小鼠细胞免疫功能Table 3 Cellular immune function of mice
当T淋巴细胞受到ConA刺激后发生母细胞增值反应,分化成为效应T细胞,具有细胞免疫的功能[14];迟发性变态反应是由致敏性T细胞与相应的抗原结合,引起单核细胞浸润和细胞变性坏死的局部变态反应炎症,炎症反应的强弱可以反应细胞免疫能力的高低[15]。由表3可知,与CON-WB组相比,中、高剂量诺丽酒可显著提高小鼠脾淋巴细胞转化能力(P<0.05),但对迟发型变态反应没有效果。PALU A K等[16]研究表明,诺丽果中的寡糖成分对正常小鼠脾淋巴有明显的促进增殖作用,并能增加脾细胞产生抗体数目,提高小鼠免疫力。结果表明,诺丽酒提高小鼠细胞免疫功能的作用可能与其保留了诺丽果中的有效功能成分有关。
2.4 体液免疫功能
绵羊红细胞与经过绵羊红细胞免疫的小鼠脾细胞悬液混合后,脾细胞分泌的抗体可使其周围的绵羊红细胞发生溶解,形成肉眼可见的空斑。经过免疫的小鼠血清中含有抗绵羊红细胞的抗体,可以溶解绵羊红细胞,释放血红蛋白,通过测定血红蛋白含量可以反应动物抗体产生量[17]。由表4可知,三个剂量诺丽酒对溶血空斑和HC50值均无显著性影响(P>0.05),表明诺丽酒不具有增强体液免疫功能作用。

表4 小鼠体液免疫功能Table 4 Humoral immune function of mice
2.5 单核-巨噬细胞功能
巨噬细胞具有吞噬异物的非特异性免疫功能,在体内参与免疫防御,能有效清除病原体,当异物入侵机体后,即可被巨噬细胞迅速吞噬,因此,巨噬细胞的吞噬能力是反应机体非特异性免疫的一项重要指标[18]。SASMITO E等[19]的研究表明,诺丽果汁中丰富的多糖类物质可显著提高巨噬细胞吞噬功能。由表5可知,与CON-WB组相比,中、高剂量诺丽酒可显著提高碳廓清吞噬指数和巨噬细胞吞噬荧光微球吞噬率(P<0.05),表明诺丽酒具有增强单核-巨噬细胞活性功能。
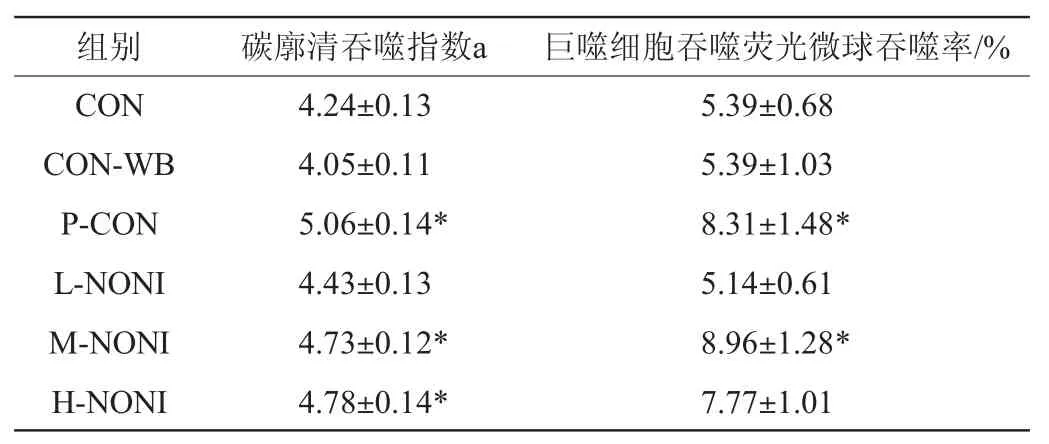
表5 小鼠单核-巨噬细胞活性Table 5 Monocyte-macrophage activity of mice
2.6 NK细胞活性
NK细胞是一种没有T和B细胞表面标志的淋巴细胞,具有非特异性杀伤功能,具有抗肿瘤、抗感染等作用,是机体内重要的免疫细胞。崔英等[20]研究表明,植物多酚具有较强的抗氧化和免疫细胞调节作用。FURUSAWA E等[21]研究表明,诺丽果汁中的多糖类物质可明显提高小鼠体内NK杀伤能力。由表6可知,中、高剂量诺丽酒可显著提高小鼠NK细胞活性(P<0.05),表明诺丽酒中含有的多酚及多糖物质可能是提高NK细胞活性的主要活性物质。

表6 小鼠NK细胞活性Table 6 NK cell activity of mice
2.7 细胞因子含量
巨噬细胞是机体免疫的重要成员,具有杀伤、吞噬、分泌活性物质、递呈抗原、调控机体免疫以及抑制肿瘤等多种活性,活化后的巨噬细胞能分泌近百种与免疫应答及炎症密切相关的活性物质[22]。由表7可知,诺丽酒对IL-1的分泌无显著性影响(P>0.05),但可显著提高IL-6、IL-10和TNF-α分泌(P<0.05)。IL-6能活化T细胞并产生淋巴因子,能使B细胞前体成为产生抗体的细胞,增强自然杀伤细胞的裂解功能;IL-10为一种细胞因子合成抑制剂和巨噬细胞失活剂,抑制内毒素入侵引起的促炎症因子释放,同时还能促进B细胞增殖和抗体产生[23];TNF-α可杀伤或抑制肿瘤细胞,提高中性粒细胞的吞噬能力[8]。SUN W J等[24]的研究表明,多糖是诺丽果中的重要活性成分,能够激发IL-1、IL-10、TNF-α、TFN-γ等炎症细胞因子的释放,促使机体的免疫系统能力提升,表明诺丽酒的免疫调节作用与影响细胞因子水平有关。
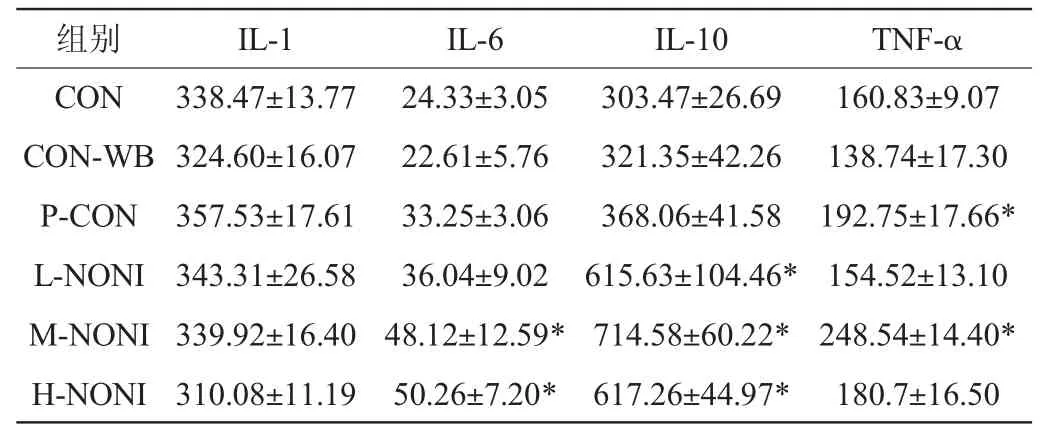
表7 小鼠血清细胞因子水平Table 7 Serum cytokine levels of mice
3 结论
以10 mL/kg体质量、20 mL/kg体质量、40 mL/kg体质量剂量的诺丽酒灌胃小鼠45 d,结果表明,各剂量组对小鼠体质量、胸腺指数和脾脏指数无显著性影响(P>0.05)。20 mL/kg体质量和40 mL/kg体质量剂量诺丽酒组的脾淋巴细胞增值能力、巨噬细胞吞噬活力及NK细胞活性均显著高于空白对照组与酒基对照组,并且血浆中IL-6、IL-10与TNF-α含量也显著高于空白对照组与酒基对照组,表明中高剂量的诺丽酒可以促进小鼠体内细胞因子的释放,从而提高小鼠体内免疫应答能力,增强机体免疫力。
[1]YANG J,PAULINO R,JANKE-STEDRONSKY S,et al.Free-radical-scavenging activity and total phenols of noni(Morinda citrifoliaL.)juice and powder in processingand storage[J].Food Chem,2007,102(1):302-308.
[2]DENG S,WEST B J,PALU A K,et al.Noni as an anxiolytic and sedative:a mechanism involving its gamma-aminobutyric acidergic effects[J].Phytomed Int J Phytother Phytopharmacol,2007,14(7-8):517.
[3]YANINE C B,FABRICE V.The noni fruit(Morinda citrifoliaL.):A review of agricultural research,nutritional and therapeutic properties[J].J Food Compos Anal,2006(19):645-654.
[4]张洪财,王文姌,刘树民.诺丽果化学成分的研究进展[J].哈尔滨医药,2011,31(3):213-214,216.
[5]ASSI R A,DARWIS Y,ABDULBAQI I M,et al.Morinda citrifolia,(Noni):A comprehensive review on its industrial uses,pharmacological activities,and clinical trials[J].Arabian J Chem,2017,26(10):691-707.
[6]龚 敏.诺丽活性成分研究[D].石河子:石河子大学,2009.
[7]PRATAP U P,HIMA L,PRIYANKA H P,et al.Noni(Morinda citrifolia L.)fruit juice reverses age-related decline in neural-immune interactions in the spleens of old F344 rats[J].J Ethnopharmacol,2017,198(23):363-371.
[8]PAWLUS A D,SU B N,KELLER W J,et al.An anthraquinone with potent quinone reductase-inducing activity and other constituents of the fruits of Morinda citrifolia(Noni)[J].J Nat Prod,2005,68(12):1720-1722.
[9]LI X C,WU X T,HUANG L.Correlation between antioxidant activities and phenolic of radixAngelicae sinensis(Danggui)[J].Molecules,2009,14(12):5349-5361.
[10]郑媛媛,李 辰,封士兰,等.油橄榄叶中总黄酮含量测定方法探讨[J].光谱学与光谱分析,2011,31(2):547-550.
[11]中华人民共和国卫生部卫生法制与监督司.保健食品检验与评价技术规范[M].北京:中华人民共和国卫生部,2003:22-34,94.
[12]ASENSI M,ORTEGA A,MENA S,et al.Natural polyphenols in cancer therapy[J].Critical Rev Clin Lab Sci,2011,48(5-6):197-216.
[13]徐 荣,杨朴丽,徐 通,等.诺丽果粉增强免疫力功能实验研究[J].食品工业科技,2017,38(8):1-10.
[14]李敬双,刘英姿,唐雨顺,等.苜蓿多糖对小鼠淋巴细胞增殖和NK细胞活性影响的研究[C].天津:2013中国北方实验动物科技年会,2013:89-93.
[15]吕方军,许一平,叶国华,等.莱阳沙参茎叶提取物对小鼠迟发型变态反应的影响[J].时珍国医国药,2012,23(5):1115-1116.
[16]PALU A K,KIM A H,WEST B J,et al.The effects ofMorinda citrifolia L.(Noni)on the immune system:its molecular mechanisms of action[J].J Ethnopharmacol,2008,115(3):502-506.
[17]彭 亮,王彦武,傅伟忠,等.纳豆粉对小鼠免疫调节作用的试验研究[J].中国食品卫生杂志,2014,26(4):336-339.
[18]曲芸芸,马春燕,朱 敏,等.免疫复合物对单核巨噬细胞的调节作用[J].山东大学学报:医学版,2010,48(4):54-58.
[19]SASMITO E,HERTIANI T,NOVLITA R T,et al.Polysaccharide-rich fractionofnonifruit(MorindacitrifoliaL.)asdoxorubicinco-chemotherapy:evaluation of catalase,macrophages,and tcd8+lymphocytes[J].Sci Pharm,2015,83(3):479-488.
[20]崔 英,梁新强,岳惠芬,等.茶多酚对肝癌高危人群T淋巴细胞亚群和NK细胞活性的影响[J].中华肿瘤防治杂志,2005,12(2):92-94.
[21]FURUSAWA E,HIRAZUMI A,STORY S,et al.Antitumour potential of a polysaccharide-rich substance from the fruit juice ofMorinda citrifolia(Noni)on sarcoma 180 ascites tumour in mice[J].Phytother Res,2003,17(10):1158-1164.
[22]冯燕玲.茶多糖对免疫抑制小鼠腹腔巨噬细胞与脾淋巴细胞免疫功能的影响[D].南昌:南昌大学,2015.
[23]HIRAZUMI A,FURUSAWA E.An immunomodulatory polysaccharide-rich substance from the fruit juice ofMorinda citrifolia(Noni)with antitumour activity[J].Phytother Res,2015,13(5):380-387.
[24]SUN W J,MENG K,Qi C H,et al.Immune-enhancing activity of polysaccharides isolated fromAtractylodis macrocephalaeKoidz[J].Carbohyd Polym,2015,126(1):91-96.

