应用植入遥测技术对恒河猴部分生理指标的观测
卢祺炯,陈敏华,徐 聪,邓 军,徐志伟,宣尧仙
(长三角绿色制药协同创新中心药物安全性评价团队,浙江省医学科学院安全性评价研究中心,杭州 310053)
国家食品药品监督管理总局2014年发布的《药物安全药理学研究技术指导原则》[1]与ICH发布的《Safety Pharmacology Studies for Human Pharmaceuticals》[2],均建议采用清醒动物进行实验。应用遥测技术,可以长时间不间断获取清醒无束缚动物的呼吸、血压、心电和体温等核心数据,实验方法不仅符合各类指导原则的要求,而且获取的数据更加真实可信。但因动物自身存在着昼夜差异与应激变化,在需要长时间连续观察的实验场合,无法避免上述影响因素的干扰,所以了解动物生理信号的昼夜变化规律和对应激因素的反应程度,是合理设计实验方案、客观分析实验结果所必须的。近年来已有许多国内外学者对恒河猴的生理数据的自身规律做了一定的研究,齐卫红[3]、仉怀林[4]等观察了猴的心电、血压的周期性和应激变化,Kaiser等[5]观察了猴的生活环境对生理信号的影响,但上述研究或者是在麻醉、束缚状态下进行,或者应用了遥测系统但观察指标数量少,范围窄,不能作为GLP条件下的安全药理学研究的参考数据。作者用恒河猴建立应用植入遥测技术的动物模型,获取了恒河猴清醒无束缚状态下24 h的呼吸、血压、心电和体温等指标,了解了恒河猴核心生理指标的昼夜节律以及部分应激条件下的变化情况,为今后恒河猴在药理毒理学中的应用提供可靠的参考。
1 材料和方法
1.1 实验动物
恒河猴,普通级,年龄3~5岁,体重3.1~6.5 kg,8只,雌雄各半,由宁波市鄞州东吴天童猕猴养殖场提供 [SCXK (浙) 2013-0027],动物质量合格证号:0002570。饲养于浙江省医学科学院安全性评价研究中心普通级猴饲养室中,温度16℃~26℃,相对湿度40%~70%,中央空调集中通风每小时8~10次,光照12 h明、12 h暗 [SYXK (浙) 2012-0176]。喂饲猴全价颗粒营养饲料,LAWS-2000实验动物反渗透纯水机处理的饮水。经IACUC批准动物使用申请书编号:GLP-A-033。
1.2 主要试剂与仪器
注射用头孢西丁钠(2 g),兽用复方氨基比林注射液,戊巴比妥钠,异氟烷。DSI电生理遥测系统,植入子型号TL11M3-D70-PCTR,美国DSI公司;Matrix动物麻醉机,美国Midmark公司。
1.3 实验方法
1.3.1 动物模型的建立
(1)术前准备:猴下肢建立静脉通道静注戊巴比妥钠溶液(3%,1 mL/kg)诱导麻醉后备皮,手术台恒温37℃,麻醉机维持麻醉后静脉滴注注射用头孢西丁钠,每只猴0.5 g,3 mL/min。开启遥测系统主机与植入子电源,监测植入子信号,植入子浸泡于0.9% NaCl注射液20 min以上。
(2)植入手术:沿术侧股动脉搏动最明显位置纵向切开皮肤(切口1,见图1),切口长度3~4 cm。钝性分离皮下组织和肌肉层,暴露并分离股动脉后,沿股动脉下方穿三根非吸收线备用,盖上浸润0.9% NaCl注射液的无菌纱布预防切口干燥。术侧腹斜肌位置,以脐部横向延伸线为中点,切开6~7 cm皮肤,分离皮下组织,分离腹斜肌5~6 cm并扩张成一大小合适的“口袋”供植入子主体放入,在已分离的腹斜肌层靠近股动脉侧穿孔引出压力导后沿皮下穿至切口1,将植入子放入已分离的腹斜肌层内,电极导线自分离处引出备用。结扎已分离股动脉远心端,动脉夹夹住近心端,开口后插入压力导管到达腹主动脉横膈膜上方,导管到位后用预留的非吸收线结扎并固定,遥测系统观察确认检测到血压并且正常后,分层缝合切口1组织和皮肤。
(3)切口3、4、5位置的确定:沿着动物侧面的腋窝褶皱向尾部延伸至第7肋骨处为中点,在动物身体双侧对称位置各作约4 cm的纵向切口,即切口3、4。切口5位于动物右胸锁骨正中下方,横向,长约2 cm,放置ECG负极。所有负极放在动物右侧,所有正极放在左侧,绿色参考电极固定在植入子本体处(切口2)。见图1。
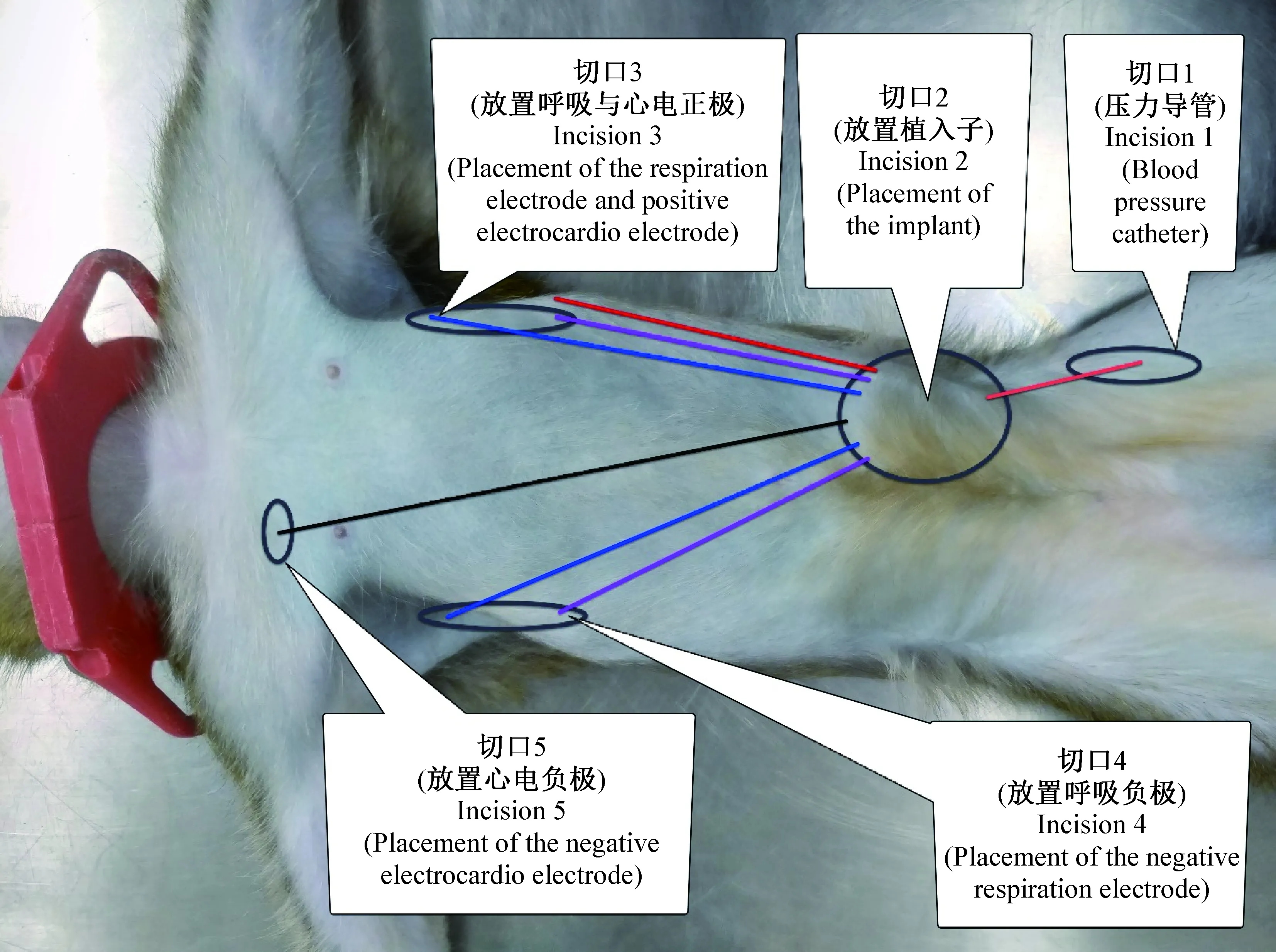
图1 手术区域示意图Fig.1 Diagram of operation regions
(4)电极导线穿引顺序:先将所有心电、呼吸电极导线从切口2穿引至切口3。再将ECG负极和呼吸测量负极从切口3穿引至切口4,其余留在切口3处。最后将ECG负极由切口4穿引至切口5。所有电极头部剥去适量导线外皮制作电极环。
(5)呼吸电极的埋植:钝性分离切口3、4的胸腔肌肉形成小的“口袋”,可将环状的电极平放在肌肉下的“口袋”中。紫色电极朝头部方向,蓝色电极朝尾部方向,暂不缝合固定。随后打开Ponemah软件监测下微调电极距离至呼吸电阻信号50~70 Ω之间,非吸收线缝合固定。之后分层缝合3、4、5切口。
(6)将植入子本体和切口2用生理盐水冲洗干净。整理电极导线一并放入肌肉下“口袋”内,分层缝合切口2肌肉层、皮下组织和皮肤。每个切口缝合前预先用抗生素溶液冲洗腔体,完成缝合后即碘伏消毒。待头孢西丁钠注射液滴注完毕后,拔去留置针。解除动物固定,肌注复方氨基比林注射液,停止吸入麻醉,立即将动物转移至动物笼中观察动物状态至清醒。
1.3.2 术后护理
术后次日注射复方氨基比林注射液1次,连续3 d肌注青霉素,碘伏消毒切口5 d后拆线。定期观察伤口恢复情况,防止动物撕咬或抓挠伤口将导管、导线或主体拉出。伤口如出现血清肿,用注射器抽取皮下积液。恢复期3周后进行实验。
1.3.3 数据采集与分析
连续观察分析24 h猴的II导心电图、呼吸、血压,并用Ponemah分析软件进行各指标分析,同时比较猴昼夜生理指标的变化。观察期间设定上午9:00、下午14:00时间段实验室工作人员进入猴房清洗、喂食。
1.3.4 观察指标
猴心电指标:心率(HR)、P波幅度(P-A)、PR间期(PR-I)、R波幅度(R-A)、QRS时程(QRS)、ST位移(STE)、T波幅度(T-A)、QT间期(QT-I)、校正QT间期(QTcb);猴呼吸指标:呼吸频率(BPM)、分钟通气量(MV)、潮气量(TV);血压指标:收缩压(SYS)、舒张压(DIA)、平均动脉压(MAP);体温。以及上述指标的白昼均值、夜晚均值。
1.4 统计学方法
2 结果
经数据分析、整理与统计,下列表1、表2、表3所示数据为本次研究获取的恒河猴呼吸、血压、心电、体温的24 h连续检测结果。表4为本次研究获取的恒河猴各项生理指标的白昼、黑夜与全天均值。
2.1 恒河猴24 h呼吸、体温分析
根据表1、表3、表4可知,恒河猴的潮气量(TV)、分钟通气量(MV)、呼吸频率(RR)、体温的白昼均值明显高于夜晚(P< 0.01),其中TV均值白昼为(64.5±20.9) mL,夜晚为(36.6±17.0) mL;MV均值白昼为(1931.9±887.2) mL/min,夜晚为(920.1±527.5) mL/min;RR均值白昼为每分钟(32.3±5.7)次,夜晚为每分钟(25.4±4.3)次;体温白昼均值为(38.0±0.4) ℃,夜晚为(36.9±0.3) ℃。上午9:00为呼吸、体温的峰值时段,夜晚的22:00为TV和MV的最低点,夜晚0:00为RR的最低点,1:00为体温的最低点。自17:00起,猴的呼吸和体温的四项参数值均开始下降,至19:00趋于平稳。猴的呼吸和体温指标中,TV、MV的昼夜变异系数均> 10%,RR和体温的昼夜变异系数均< 10%。
表1 恒河猴24 h各项呼吸指标列表
表2 恒河猴24 h各项心电指标列表
表3 恒河猴24 h体温和血压生理指标列表
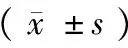
表4 恒河猴24 h呼吸、心电、体温、血压各指标分析结果
注:与白昼比较,*P< 0.05,**P< 0.01。
Note. Compared with daytime,*P< 0.05,**P< 0.01.
2.2 恒河猴24 h心电分析
根据表1~4可知,恒河猴的心律(HR)、呼吸频率间期(RR-I)、T波幅度(T-A)、PR间期(PR-I)、QT间期(QT-I)、校正QT间期(QTcb)等心电指标存在昼夜差异,且差异有显著性(P< 0.05或P< 0.01),R波幅度(R-A)、P波幅度(P-A)、ST位移(STE)、QRS时程(QRS)等心电指标无的昼夜差异无显著性(P> 0.05)。差异有显著性的各项心电指标中,HR白昼均值为每分钟(155.0±29.6)次,黑夜为每分钟(122.4±32.1)次;RR-I白昼为(410.8±77.4) ms,黑夜为(535.7±130.6) ms;T-A白昼为(0.181±0.046) mV,黑夜为(0.157±0.071) mV;PR-I白昼为(80.4±8.4) ms,黑夜为(87.4±9.9) ms;QT-I白昼为(224.8±21.6) ms、黑夜为(263.9±17.9) ms;QTcb白昼为(352.3±18.0) ms,黑夜为(366.7±23.1) ms。恒河猴24 h心电指标中,峰值或谷值出现在上午9:00的有RR-I、HR、QRS、PR-I、R-A、QT-I和QTcb等指标,P-A的峰值出现在1:00,T-A和STE峰值分别出现在17:00和1:00。RR-I、HR、T-A、PR-I、QT-I、QTCb等昼夜差异有显著性的心电指标中,均可见17:00~19:00时间段有着稳定且幅度较大的变化。ECG各指标中P-A、T-A夜晚的变异系数> 10%,STE昼夜变异系数均> 10%,其余指标均< 10%。
2.3 恒河猴24 h动态血压分析
根据表3、表4可知,恒河猴的收缩压(SYS)、舒张压(DIA)、平均动脉压(MAP)白昼均值明显高于夜晚(P< 0.01),其中SYS均值白昼为(144.6±20.1) mmHg、夜晚为(131.6±18.9) mmHg,DIA均值白昼为(99.8±12.0) mmHg、夜晚为(89.9±12.5) mmHg,MAP均值白昼为(121.5±15.1) mmHg、夜晚为(110.2±14.9) mmHg。猴的SYS、DIA、MAP的峰值均出现在上午9:00,自17:00起猴的血压指标均逐渐下降,至19:00趋于平稳,三个血压指标的昼夜变异系数均< 10%。
3 讨论
安全性评价研究中使用的灵长类动物常用恒河猴或食蟹猴。本机构实验用猴年龄段一般为3~5岁,体重因种属、性别、体型的不同,食蟹猴一般使用3~5 kg,恒河猴为3~7 kg。
遥测系统植入子的植入手术操作造成的创口多,并且动物的依从性较差,一旦植入失败或者植入子导线因为伤口裂开被动物撕咬破坏会造成较大的损失,所以此类手术对成功率的要求是非常高的,所以手术中缝合技术和术后护理方案的选择是在整个实验流程中非常重要的一环,梁春南[6]曾报道过一例植入手术后创口开裂无法愈合,所以作者对不同层次的组织分别选用以下方法:肌肉层使用8字缝合法,皮下组织连续缝合,皮肤层皮内连续缝合法,缝合前一律用抗生素溶液清洗浸润创口。术后每日检视伤口恢复状况,发现伤口愈合良好,没有出现伤口开裂,抓挠或撕咬伤口拉扯埋置导线的情况。
在实验前期,因作者低估了猴的破坏能力,在使用全不锈钢半封闭猴笼(侧面封闭、正面钢管门、上下方与后方为钢管与不锈钢网)的条件下,植入子接收器导线因为布线不合理,在术后恢复期间被猴拉入笼内并咬断2根,修复导线之后作者重新调整了接收器的固定位置和导线的布线,避开猴肢体可能接触到的位置,才避免了猴对实验设施的继续破坏。
实验结果表明,在实验人员活动集中的时间段(上午9:00),出入动物房进行清扫、喂食、加饮水等此类非直接接触动物的行为,对恒河猴的呼吸、血压、心电和体温有着一定的应激影响,猴目视实验人员后在笼内跳跃、快速行走,待实验人员结束动物房内的操作离开后,猴会很快安静下来,从实验结果可见上午10:00时间段的各指标基本恢复至上午8:00的水平。但下午14:00时间段实验人员进行第二次清扫、喂食、加饮水操作时,猴的应激反应不再像上午9:00时间段那样激烈,基本上都比较安静,猴的呼吸、血压、心电、体温等指标的变化幅度也未见大范围的波动。笔者认为9:00时间段出现的应激变化比较明显的原因,是上午喂食之前猴基本都空腹12 h左右,饥饿感比较强,猴经过一段时间的驯养,已了解上午工作人员出现的时候就是喂食时间,所以更容易兴奋导致的。而下午14:00时间段操作时,猴的进食意愿就不如上午强烈,应激反应较小。
实验结果还表明,猴的生理指标存在明显的昼夜差异,其潮气量、分钟通气量、呼吸频率、收缩压、舒张压、平均动脉压、心率、T波幅度、体温均为白天(8:00~16:00)明显高于夜晚(20:00~4:00),PR间期、呼吸频率间期、QT间期、校正QT间期则相应地表现为白天明显低于夜晚。而R波幅度、P波幅度、ST位移、QRS时程这四个指标则未显示昼夜差异。从上述实验结果可以发现,呼吸、血压、体温的昼夜差异存在着一致性和相关性,但心电的时间指标中RR间期、PR间期、QT间期、校正QT间期等四项有昼夜差异,而QRS时程则无昼夜差异,电压指标中仅T波幅度显示有昼夜差异,R波幅度、P波幅度、ST位移则未显示昼夜差异。本实验结果中计算的变异系数(CV),以≥ 10%为界,认为在统计学意义上的变化无参考意义,其中昼夜波动幅度均≥ 10%的有潮气量、分钟通气量和STE三项指标,另P波幅度、T波幅度的夜晚CV ≥ 10%,其余指标的昼夜CV均< 10%。根据实验结果,因猴的呼吸、血压、心电、体温等生理指标存在昼夜节律,所以在实验设计时应当充分考虑此因素,在给药和观察时间段应按已获取的基线结果设计,例如给药和观察时间较短,并且在白昼给药的,应把实验时间安排在7:00~16:00内。如发现猴对工作人员的应激反应比较剧烈,应记录此类应激反应特点和时间,此时间段的实验数据在后期分析时也应有合适的解释。在对获取的呼吸指标进行统计分析时,应综合其他因素判断受试物对呼吸指标的影响,而不是简单地参照统计学意义的结果进行判断。总而言之,在应用无创遥测系统进行安全药理学研究时,应当在正式实验之前,尽量考虑到所有对猴的各种应激因素[4],获取完善的基线(baseline)数据,并对应正式实验操作的特点,在记录动物baseline数据的时候安排合适的应激因素(可以人工模拟),包括喂食、巡视、清扫、短时间固定、给药等,为该批次动物进行的实验提供正确的参考依据。
本文应用植入遥测技术观察到的恒河猴呼吸、血压、心电、体温等生理指标基本上均有明显的昼夜节律变化,呼吸、血压、心电、体温等指标白昼均高于夜晚,符合正常恒河猴的生理周期特性。经过驯养的恒河猴在饥饿状态下对工作人员的喂食清扫活动的应激影响比较强烈。应用植入遥测技术可以对清醒无束缚状态下恒河猴心电、血压、呼吸、体温等进行连续监测,能真实地反映恒河猴24 h内上述生理指标的变化规律,为恒河猴在药理毒理学研究中的应用提供参考。同时应用植入遥测技术,有助于提高药物安全药理学研究的效率,减少动物的使用数量,符合3R原则。
[1] 国家食品药品监督管理总局 [EB/OL]. http://www.sda.gov.cn/WS01/CL1616/101015.html, 2014-05-13.
[2] ICH. ICH Guidance for Industry ICH S7A: Safety Pharmacology Studies for Human Pharmaceuticals [S]. ICS 2001.
[3] 齐卫红, 李伟, 李继红, 等. 健康恒河猴心电图研究 [J]. 实验动物科学, 2011, 28(3): 47-50.
[4] 仉怀林, 吕锡太. 太行山猕猴动脉血压的研究 [J]. 河南师范大学学报(自然科学版), 1989, 30(2): 116-119.
[5] Kaiser R, Tichenor S, Regalia D, et al. Evaluation of jacketed external telemetry in multiple social housing paradigms for cynomolgus monkey [J]. J Pharmacol Toxicol, 2015, 75: 180.
[6] 梁春南. Beagle犬安全药理遥测系统埋植手术术位开裂处治失败1例报告 [J]. 实验动物科学, 2012, 29(4): 52-54.

