促红细胞生成素在缺氧缺血性脑病大鼠模型中的神经保护作用
段 淼,曹云涛,王旭芹
(贵州省遵义市第一人民医院新生儿科,贵州 遵义 563002)
新生儿缺氧缺血性脑病(hypoxic-ischemic encephalopathy,HIE)是造成新生儿死亡及神经后遗症的主要原因之一[1],目前无特殊治疗办法。促红细胞生成素(erythropoietin,EPO)是一种多功能性的细胞因子,除能促进红细胞生成外,还对多种脑损伤模型有神经保护作用[2-4]。巢蛋白(neuroepithelial stem cell protein,nestin)是胚胎形成早期神经上皮细胞内的一种中间丝蛋白,神经细胞发生病理性损伤之后再生时广泛表达于神经系统,因此巢蛋白表达常用作判定神经系统发生病损后能否促进神经细胞再生的标志物。本研究拟建立新生大鼠HIE模型,外源性给予EPO,通过检测海马区的巢蛋白表达水平来探讨EPO对新生鼠HIE的保护作用。此外,肠道与脑通过神经、内分泌及免疫系统的互作形成肠-脑轴[5],本实验还将通过高通量测序的方法,分析EPO处理前后大鼠的肠道微生物菌群变化,旨在观察肠道菌落多样性变化与新生鼠HIE的相关性。
1 材料和方法
1.1 实验动物
清洁级SD大鼠48只,雌雄不限,体重13~16 g,由重庆第三军医大学野战外科研究所动物室提供 [SCXK (渝) 2012-0001]。饲养的环境温度:(22±2) ℃,相对湿度50%~60%,光照12 h/12 h明暗交替,每笼5只饲养 [SYXK (渝) 2017-0012]。
1.2 主要试剂与仪器
重组人促红素注射液:3000 IU/支,购自哈药集团生物工程有限公司,产品批号:S20050090;rabbit anti-nestin:博士德生物工程有限公司,编号:BA0056;QIAamp FAST DNA Stool Mini Kit:德国Qiagen;缓冲液:buffer AW1,buffer AW2,buffer ATE,德国Qiagen。显微镜:Leica DM4000B;防脱磨砂载玻片:北京中杉金桥生物技术有限公司;Leica Qwin细胞图像分析仪:德国Leica公司;Image-Pro Plus 6.0图像分析软件:美国Media Cybernetics公司。
1.3 实验方法
1.3.1 动物模型建立
参照改良Rice-Vannuncci法建立模型[6],在乙醚吸入麻醉状态下,消毒切开颈部皮肤,分离右侧颈总动脉结扎剪断,缝合切口,术后放入37℃恒温箱中30 min,以1.5 L/min输入含8% O2和92% N2的低氧气源2.5 h。
1.3.2 实验分组及给药[7]
随机分为HIE模型组和EPO实验组,分别给予相应剂量的EPO和生理盐水。对照组16只,仅分离右侧颈总动脉,不结扎,不干预。HIE模型组16只大鼠,缺氧缺血术后正常饲养,与EPO治疗在相同时间按体重给予相应体积生理盐水;EPO实验组16只,术后30 min内腹腔注射EPO [5 IU/(kg·d)],均连用14 d。三组大鼠于术后第14、21天(每个时点8只)用4%多聚甲醛心脏注射处死,暴露心脏后迅速注入5~10 mL生理盐水,尽量冲洗循环血液。剪下头颅,沿头颅中线剪开皮肤和颅骨,取出脑组织放入4%多聚甲醛中固定24 h,石蜡包埋,切片机沿海马冠状切片备用。同时收集对照组和HIE模型组两组的粪便颗粒于无菌管中,贮存在-80℃冰箱备用。实验过程中按实验动物使用的3R原则给予人道主义关怀。
1.3.3 脑组织切片免疫组织化学染色
对三组新生大鼠术后14 d、21 d大脑海马组织连续冠状切片,隔5取1,HE染色观察右侧海马CA1区病理改变,免疫组织化学SABC法检测右侧海马区nestin阳性细胞,按操作规程进行。
1.3.4 海马区nestin表达的检测
采用Leica DM2500显微镜及Leica Qwin软件观察、计数nestin阳性细胞。每个标本随机挑选3张切片、每张切片随机选择4个视野进行阳性细胞观察及计数,每个标本共12个视野,取其平均值。
1.3.5 粪便DNA制备和微生物群落分析
称取粪便样本180~220 mg至2 mL离心管中,按照QIAamp FAST DNA Stool Mini Kit试剂盒说明书提取细菌DNA,送上海美吉生物公司按指定测序区域进行PCR扩增及MiSeq测序,进行生物信息学分析。
1.4 统计学方法

2 结果
2.1 成功复制新生大鼠缺氧缺血性脑病模型
2.1.1 参照孙金峤等建模评分标准[8]分析各组行为特征
实验组和模型组术后2 h内呼吸节律改变,活动减少,3~4 d后侧推抵抗力减弱,出现旋尾动作,3周之后好转,活动正常。
2.1.2 HE染色
对照组大鼠脑组织结构紧密,细胞核清晰;实验组脑组织结构较对照组变得疏松,核仁不清晰;模型组脑组织严重损伤,细胞结构紊乱,部分存活神经元坏死,细胞核溶解。见图1。
2.2 Nestin在海马DG区的表达变化
对照组阳性细胞数目少,EPO实验组的阳性细胞数目与对照组、HIE模型组相比明显增多,不同时点之间比较差异有显著性(P< 0.05)。HIE模型组术后第14天海马DG区nestin表达增加,与对照组比较差异有显著性(P< 0.05),术后14 d、21 d海马DG区的nestin在各组间的表达均差异有显著性(P< 0.05),实验组表达最多,HIE模型组次之,对照组最少。见图2、图3。

注:A:对照组;B:HIE模型组;C:EPO实验组。图1 新生大鼠缺氧缺血性脑病模型海马CA1区病理改变(HE染色,× 400)Note. A: Control group; B: HIE model group; C: EPO experimental group.Fig.1 Pathological changes in the hippocampal CA1 area of neonatal rats with HIE. HE staining
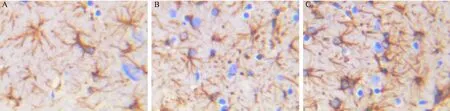
注:A:对照组;B:HIE模型组;C:EPO实验组。图2 新生SD大鼠术后海马区的nestin表达水平(免疫组织化学染色,× 400)Note. A: Control group; B: HIE model group; C: EPO experimental group.Fig.2 Expression levels of nestin in the hippocampus of neonatal SD rats after EPO treatment. Histoimmunochemical staining
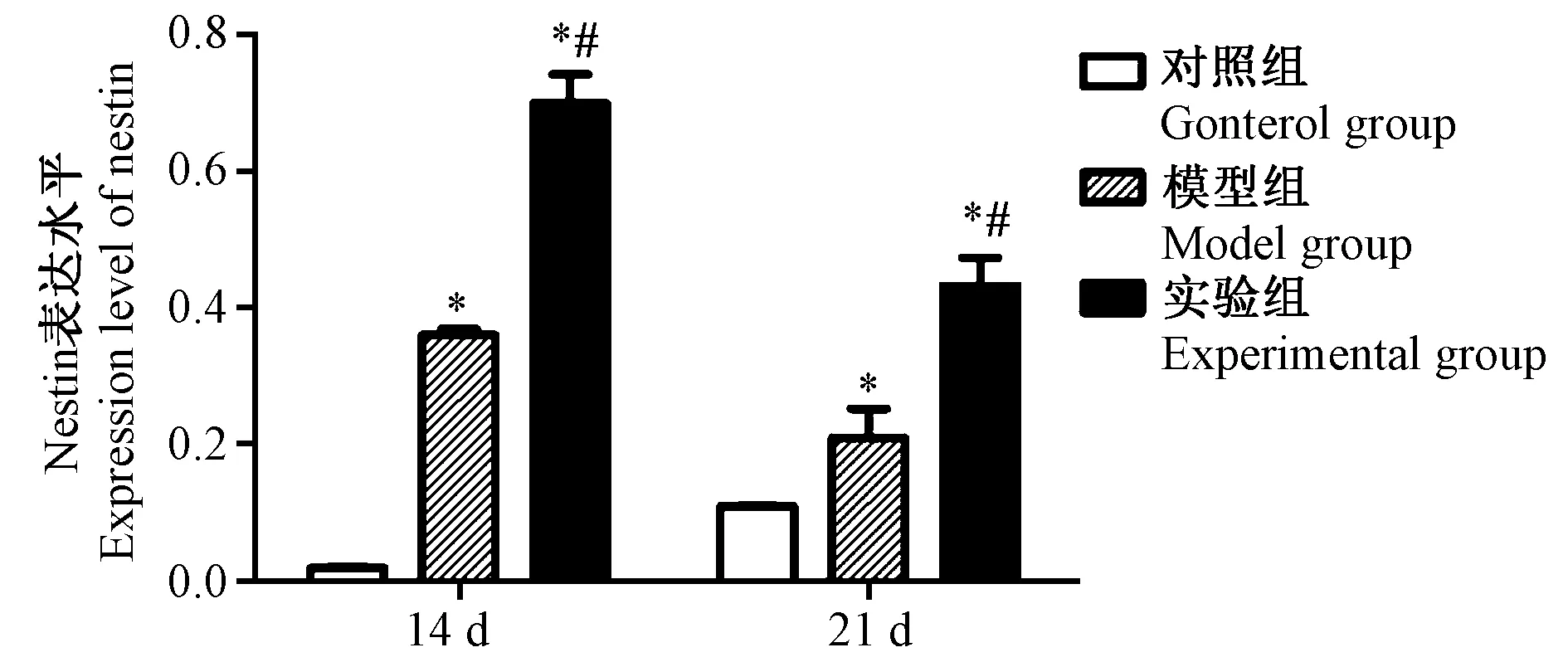
注:与对照组相比,*P< 0.05;与模型组相比,#P< 0.05。图3 新生SD大鼠海马区nestin在14 d、21 d时的表达变化Note. Compared with the control group,*P < 0.05. Compared with the model group,#P < 0.05.Fig.3 Changes in the expression level of nestin in the hippocampus of neonatal SD rats at 14 d and 21 d
2.3 肠道微生物菌群相对丰度的变化
根据可操作分类单元(operational taxonomic units,OTU,是在系统发生学或群体遗传学研究中,为了便于进行分析,人为给某一个分类单元设置的统一标志)在门水平上分析出5种细菌种类,包括放线菌门、拟杆菌门、蓝藻门、脱铁菌门和厚壁菌门。模型组与对照组的菌群结构比较差异无显著性,未发现两组在菌群上的明显变化。见表1。
2.4 微生物群落Shannon指数比较
香农-威纳指数(Shannon-Wiener index)是用来估算样本中微生物多样性的参数之一。Shannon值越大,说明群落多样性越高。Shannon指数比较结果表明,HIE模型组较对照组呈降低趋势,两组比较菌群多样性有显著性(P< 0.05)。见表2。
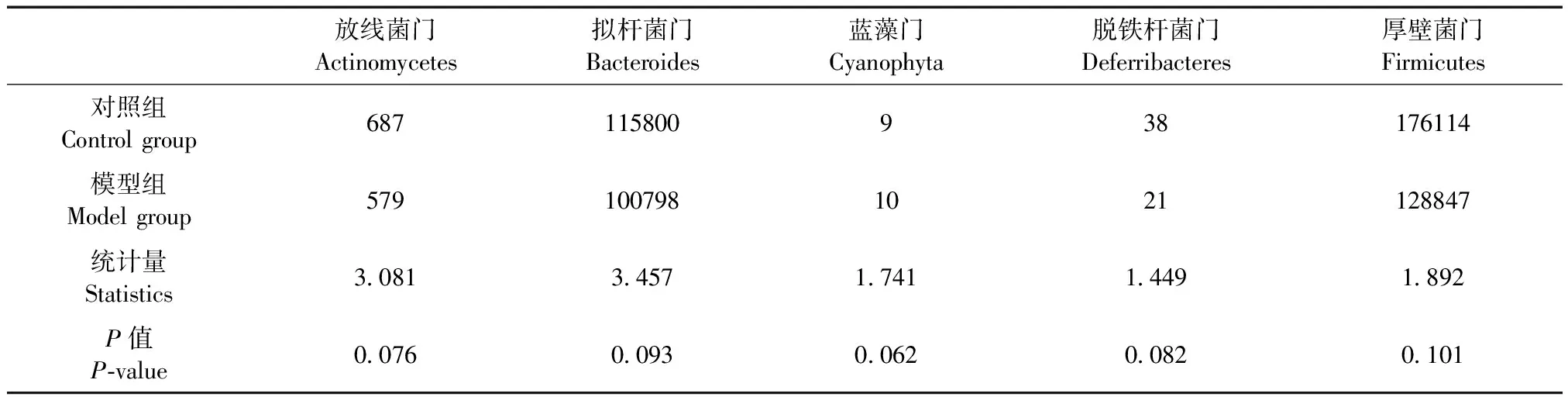
表1 在门的水平上整体的群落结构差异(OTU)
注:模型组与对照组相比,P> 0.05,差异无显著性。
Note. The model group vs. the control group,P> 0.05, showing non-significant differences.

表2 Shannon指数比较
注:与对照组比较,*P< 0.05。
Note. Compared with the control group,*P< 0.05.
3 讨论
近来有关动物缺氧缺血性脑损伤模型的制作方法推陈出新,总结国内研究动物模型现大致有以下几种:①脂多糖(lipopolysaccharide)等神经毒素诱导的[9];②注射神经毒素联合缺氧缺血制成的[10];③缺氧缺血的,这种模型有两种制作手段,其一是夹闭临产孕鼠的双侧子宫动脉,造成新生乳鼠宫内缺氧缺血的状态;其二是将幼鼠放入极度缺氧中制成脑瘫模型,或将幼鼠单侧颈总动脉阻断,再置于缺氧环境中制成脑瘫模型[11]。本实验在借鉴了国内外经验的基础上,采用的是将SD新生大鼠单侧颈总动脉结扎并缺氧制作模型,有文献报道选择将临产的孕鼠子宫动脉夹闭的方式制作缺血缺氧的模型较简单易行[12]。近年来也有学者用昆明小鼠进行颈动脉结扎缺氧制备模型[13]。
巢蛋白是第VI类中间丝蛋白,主要在神经和肌肉的干细胞中表达;随着细胞分化成熟,逐渐减低,最后消失[14]。当中枢神经系统受损伤时,nestin的表达重新升高[15-16],因此,nestin可作为神经干细胞的标志物。本研究通过制备7日龄新生大鼠HIE模型,设置对照组、HIE模型组、EPO实验组,分别检测三组大鼠术后第14、21天海马DG区nestin的表达,提示EPO可促进nestin的表达。
人体内的微生物生态系统对人类的健康有着深远的影响[17],有学者称肠道菌群为宿主内部的“微生物器官”,认为肠道菌群是一个新的人体生理系统。现国内外对肠道菌群的研究已成为热点,大量实验证明肠道菌群与各种疾病是有关联的,但具体的作用机制尚未阐明[18-20]。通过对肠道菌群的深入研究,许多学者已证实肠道微生物群的变化可以对肠-脑轴进行调节,在神经发育、老化及神经退行性病变中起重要作用[21-22],同时有不少学者认为菌群也可以调节鼠的海马神经发生,并已用实验证实发表[23]。本研究通过对比HIE模型组与对照组粪便中菌群多样性的变化揭示了肠道菌群组成的改变可能与缺氧缺血性脑病的发病相关,HIE模型组Shannon指数较对照组呈降低趋势,细菌多样性明显低于对照组,为肠-脑轴的存在提供了实验证据,但本实验并未分析出菌群的差异性变化,这可能与鼠便不能完全覆盖肠道内的所有菌群有关,如果采集小肠组织进行研究,可能更能反映肠道菌群的变化。
总之,本实验建立了新生大鼠缺氧缺血性脑病的模型,并研究了促红细胞生成素的神经保护作用以及肠-脑轴存在的实验依据。
[1] Perez A, Ritter S, Brotschi B, et al. Long-term neurodevelopmental outcome with hypoxic-ischemic encephalopathy [J]. J Pediatr, 2013, 163(2): 454-459.
[2] Fang AY, Gonzalez FF, Sheldon RA, et al. Effects of combination therapy using hypothermia and erythropoietin in a rat model of neonatal hypoxia-ischemia [J]. Pediatr Res, 2013, 73(1): 12-17.
[3] Gonzalez FF, Larpthaveesarp A, McQuillen P, et al. Erythropoietin increases neurogenesis and oligodendrogliosis of subventricular zone precursor cells after neonatal stroke [J]. Stroke, 2013, 44(3): 753-758.
[4] Aloizos S, Evodia E, Gourgiotis S, et al. Neuroprotective effects of erythropoietin in patients with severe closed brain injury [J]. Turk Neurosurg, 2015, 25(4): 552-558.
[5] Zhu X, Han Y, Du J, et al. Microbiota-gut-brain axis and the central nervous system [J]. Oncotarget, 2017, 8(32): 53829-53838.
[6] Demarest TG, Waite EL, Kristian T, et al. Sex-dependent mitophagy and neuronal death following rat neonatal hypoxia-ischemia [J]. Neuroscience, 2016, 335: 103-113.
[7] 段淼, 曹云涛. 促红细胞生成素对新生鼠缺氧缺血性脑损伤后5-溴-2-脱氧尿嘧啶核苷表达的影响 [J]. 中国临床药理学杂志, 2015, 31(23): 2337-2339.
[8] 孙金峤, 曹云涛, 刘华庆, 等. 碱性成纤维细胞生长因子对新生鼠缺氧缺血性脑损伤的保护作用 [J]. 中华儿科杂志, 2007, 45(5): 354-359.
[9] 李晓捷, 高晶. 宫内感染致早产鼠脑损伤动物模型建立的实验研究 [A]. 中国康复医学会首届儿童康复学术会议暨中国残疾人康复协会第八届小儿脑瘫学术会议论文汇编 [C]. 2004.
[10] 温林豹. 腹腔注射脂多糖联合缺氧在脑瘫模型评价的实验研究 [D]. 新疆医科大学, 2009.
[11] Arteaga O, Revuelta M, Urigüen L, et al. Pretreatment with resveratrol prevents neuronal injury and cognitive deficits induced by perinatal hypoxia-ischemia in rats [J]. PLoS One, 2015, 10(11): e0142424.
[12] 宋文杰, 沈瑞乐, 武海波. 两种新生大鼠缺氧缺血性脑损伤模型制备的比较 [J]. 中国误诊学杂志, 2005, 5(17): 3221-3223.
[13] 胡晓丽, 王雪峰, 张亮, 等. 新生小鼠缺氧缺血性脑损伤模型的制作研究 [J]. 现代生物医学进展, 2014, 14(1): 57-61.
[14] Lendahl U, Zimmerman LB, McKay RD. CNS stem cells express a new class of intermediate filament protein [J]. Cell, 1990, 60(4): 585-595.
[15] Scorza CA, Arida RM, Cavalheiro EA, et al. Expression of nestin in the hippocampal formation of rats submitted to the pilocarpine model of epilepsy [J]. Neurosci Res, 2005, 51(3): 285-291.
[16] Gozal D, Row BW, Gozal E, et al. Temporal aspects of spatial task performance during intermittent hypoxia in the rat: evidence for neurogenesis [J]. Eur J Neurosci, 2003, 18(8): 2335-2342.
[17] 武庆斌. 益生菌在儿童抗生素相关性腹泻病的应用 [J]. 中国实用儿科杂志, 2017, 32(2): 98-101.
[18] Bisgaard H, Li N, Bonnelykke K, et al. Reduced diversity of the intestinal microbiota during infancy is associated with increased risk of allergic disease at school age [J]. J Allergy Clin Immunol, 2011, 128(3): 646-652, e1-e5.
[19] Ismail IH, Oppedisano F, Joseph SJ, et al. Reduced gut microbial diversity in early life is associated with later development of eczema but not atopy in high-risk infants [J]. Pediatr Allergy Immunol, 2012, 23(7): 674-681.
[20] Wang M, Karlsson C, Olsson C, et al. Reduced diversity in the early fecal microbiota of infants with atopic eczema [J]. J Allergy Clin Immunol, 2008, 121(1): 129-134.
[21] Vincent AM, TenBroeke M, Maiese K. Neuronal intracellular pH directly mediates nitric oxide-induced programmed cell death [J]. J Neurobiol, 1999, 40(2): 171-184.
[22] Dinan TG, Cryan JF. Gut instincts: microbiota as a key regulator of brain development, ageing and neurodegeneration [J]. J Physiol, 2017, 595(2): 489-503.
[23] Ogbonnaya ES, Clarke G, Shanahan F, et al. Adult hippocampal neurogenesis is regulated by the microbiome [J]. Biol Psychiatry, 2015, 78(4): e7-e9.

