p14基因启动子甲基化在上皮性卵巢癌临床检测中的意义
丁红岩 高金瑜# 张燕 李长华 孙广琴
(1南京医科大学附属淮安一院 江苏淮安223300;2山东大学附属省立医院中心实验室 济南250021)
卵巢癌是严重威胁女性健康的恶性肿瘤之一,其死亡率居妇科恶性肿瘤第1位。抑癌基因的失活是卵巢癌发生及发展的关键因素,其主要表现有基因突变、缺失以及启动子区域(CPG岛)的过甲基化。p14是细胞周期调控因子,通过MDM2-p53通路履行调控细胞进程的职责。上皮性卵巢癌中的表达异常是否由p14基因启动子的甲基化所致,尚未见报道。本文旨在探讨p14基因启动子甲基化在上皮性卵巢癌中的存在情况,同时检测p14基因的突变情况,观察其与p14甲基化的关系。现报告如下:
1 资料与方法
1.1 一般资料 选取2007年9月~2009年6月我院收治的45例上皮性卵巢癌患者、30例卵巢良性肿瘤患者及20例卵巢组织正常者作为研究对象,所有患者的病理诊断及组织分级明确,术前均未进行任何化疗或放疗等治疗。上皮性卵巢癌患者中,根据细胞分化程度有14例高分化癌,18例中分化癌,13例低分化癌;平均年龄(45.5±6.2)岁;25例浆液性囊腺癌,13例黏液性囊腺癌,6例子宫内膜样癌,1例透明细胞癌。卵巢良性肿瘤患者中,有17例浆液性囊腺瘤,13例黏液性囊腺瘤;平均年龄(44.9±5.1)岁。卵巢组织正常患者均为宫颈良性病变者,患者平均年龄(46.7±5.2)岁。三组患者的一般资料相比较,差异无统计学意义,P>0.05,具有可比性。所有手术标本的采集均已得到患者的同意并签署知情同意书,标本切除后立即-80℃保存备用。
1.2 甲基化特异性PCR检测
1.2.1 组织DNA提取 组织DNA的提取采用酚-氯仿-异戊醇法,之后通过紫外分光光度法进行组织DNA浓度及纯度的检测。
1.2.2 DNA修饰及纯化 取 2 μg DNA、3 mol/L NaOH 5 μl加入到50 μl疗效反应体系中,充分混匀后于75℃反应15 min,随后加入4.8 mol/L亚硫酸氢钠(购自Sigma公司)320 μl和20 mmol/L的氢醌12.6 μl,充分混匀后再加入 10 μl矿物油,于 55 ℃中水浴过夜。另外,将1 ml DNA纯化树脂(购自Promega公司)加入到每个DNA样本中,通过纯化柱,再加入80%异丙醇溶解树脂2 ml、NaOH脱硫3 mol/L 5 μl、醋酸钠 5 mol/L 5 μl,用 100%冰乙醇进行DNA沉淀,75%乙醇吹洗,离心,弃上清液,随后溶于30 μl TE缓冲液中进行备用。
1.2.3 甲基化特异PCR反应 反应体系共25 μl,主要有 DNA 2 μl、10×PCR buffer 2.5 μl、引物 0.5 μl、dNT 2 μl,Taq 酶 0.2 μl,双蒸水补足至 25 μl。反应条件:95℃预变性5 min;94℃反应30 s,57℃退火 45 s,72℃反应 30 s,35 个循环,72 ℃延伸 10 min。注意非甲基化反应退火温度为54℃。以甲基转移酶SssI处理和未处理的正常人外周血细胞DNA为阳性和阴性对照,空白对照采用双蒸水。甲基化引物序列:上游引物F5'-GGT ATA TTT TCG AGG GGT ACG-3',R5'-TTC CCG ACC CGC ACT CCG C-3',预期产物为90 bp;非甲基化引物序列如下:F5'-TGT GAG GGT ATA TTT TTG AGG GGT AT-3',R5'-CTT CTC TCT CCA CTT CCC AAC CCA-3',预期产物为109 bp,由上海生工合成。
1.2.4 电泳 取5 μlPCR产物,采用2%琼脂糖凝胶进行电泳,实验重复3次。
1.3 荧光定量PCR(FQ-PCR)检测组织标本p14mRNA表达 采用SYBR Green荧光染料进行FQ-PCR:(1)按Trizol试剂说明提取组织总RNA;(2)引物序列:p14mRNA:F5'-GAG ACA GAA TGG AGG TGC TGC-3',R5'-GTA AGA TGA TTG GAA TTA TCTTCT-3', 预 期 产 物 为 170bp;GAPDHmRNA:F5'-AAC GGA TTT GGT CGT ATT GGG-3',R5'-TTGATTTTGGAGGGATCTCGC-3',预期产物233 bp,由上海生工合成:逆转录第一链cDNA 合成:取总 RNA 10 μl,Oligo(dT)5 pmols,65℃ 5 min之后插入冰中,加入 5× Buffer 4 μl,10 mmolPL dNTPs 2 μl,MMLV 逆 转 录 酶 100 U,RNase抑制剂 20 U,加 DEPC 水至 20 μl,42 ℃ 1 h;FQ-PCR 反应体系为 25 μl,其中包含 0.7 μl SYBR Green染料,Mg2+浓度为3.5 mol/L,扩增条件为95℃预变性 5 min,95℃反应 30 s,56℃复性 30 s,72℃延伸30 s,共50个循环后,72℃延伸7 min,每样本4个复孔,在CFD-3220 DNA Engine Option自动荧光PCR仪上进行反应。
1.4 p14基因蛋白表达的检测 p14即用型多克隆抗体(购自福州迈新生物技术开发公司)、第一抗体兔抗人p14多克隆抗体、第二抗体超敏链酶卵白素-过氧化酶(S-P)试剂盒和DAB显色试剂盒均为即用型。提取卵巢癌组织、良性肿瘤组织和正常卵巢组织的蛋白。采用免疫组织化学法检测p14蛋白的表达,具体方法为:将切片脱蜡至水,于3%过氧化氢甲醇液中37℃孵育10 min,以阻断内源性过氧化物活性。以1∶10稀释的抗原修复液高温修复,加一抗室温下孵育60 min,加生物素标记的二抗室温孵育20 min,加S-P溶液37℃孵育30 min。DAB显色,显微镜下观察3~10 min,苏木素复染,脱水透明,中性树胶封片。
1.5 结果判定标准 在400倍显微镜下观察患者标本中p14蛋白表达的情况,其中阳性表达细胞的细胞核和(或)胞浆为棕黄色颗粒。观察时,每张切片均选定10个观察视野,每个视野以100个细胞计数。阴性:细胞数<5%,以“-”表示;弱阳性:细胞数为5%~25%,以“+”表示;中等强度:阳性细胞数为25%~50%,以“++”表示;强阳性:细胞数>50%,以“+++”表示。
1.6 统计学分析 数据处理采用SPSS11.0统计学软件,甲基化频率等计数资料采用χ2检验及Fisher检验,各组患者蛋白相对含量等计量资料以(±s)表示,采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组患者p14基因甲基化情况分析 所有患者中均未发现p14的高甲基化。见图1。
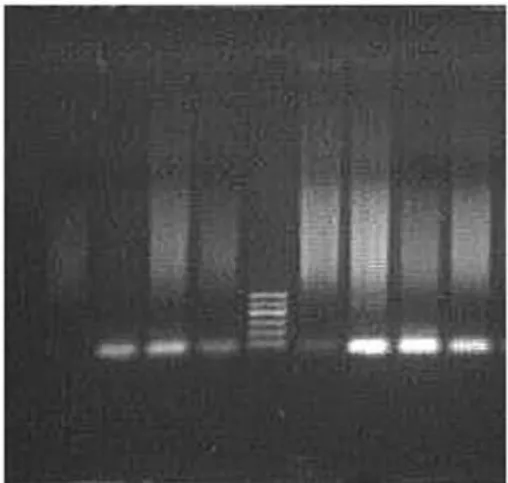
图1 p14基因甲基化情况
2.2 p14mRNA表达水平 p14mRNA在正常卵巢组织中的水平为(0.57±0.41),在卵巢癌组织的水平为(0.83±0.07),在良性肿瘤组织中的水平为(0.62±0.39)。p14mRNA在卵巢癌组织中的水平与正常组织和良性肿瘤组织中的相比较,差异有统计学意义,P<0.05;p14mRNA在正常组织和良性肿瘤组织中的水平相比较,差异无统计学意义,P>0.05。
2.3 p14蛋白的表达变化 p14蛋白表达在上皮性卵巢癌、良性卵巢肿瘤和正常卵巢组织中的阳性率分别为37.8%、73.3%和85.0%,三组中p14蛋白表达的阳性率比较,差异有统计学意义,P<0.05。p14蛋白在13例G3病例中只有3例阳性,阳性率为23.1%;18例G2病例中6例阳性,阳性率为33.3%;14例G1病例中8例阳性,阳性率为57.1%。卵巢癌Ⅰ~Ⅱ期p14蛋白阳性表达率为40.0%、Ⅲ期p14蛋白阳性表达率为37.5%和Ⅳ期p14蛋白阳性表达率为33.3%,各组间差异无统计学意义,P>0.05。见表1。

表1 卵巢肿瘤中p14蛋白表达情况分析
3 讨论
在正常细胞中,p14基因参与细胞周期和细胞增殖的调控,其产物p14蛋白可与MDM2-P53结合产生P53-MDM2-ARF三聚体复合物,阻断MDM2诱导的p53蛋白降解,将p53蛋白的半衰期延长至15~75 min,使p53发挥门卫作用,调控细胞周期,诱导周期停滞,促进细胞凋亡,抑制肿瘤的发生。甲基化是抑癌基因失活的机制之一,主要是胞嘧啶-磷酸 -鸟嘌呤(Cytosine-phosphate-Guanosine,CpG)二核苷酸发生甲基化,甲基化后抑癌基因不表达,这可能是肿瘤发生的关键机制之一,在某些情况下可能是唯一机制[1]。p14基因表达异常包含遗传学层面(基因突变和缺失)和表观遗传学层面(DNA甲基化)的。p14异常表达可表现为高度甲基化,这可能是p14-p53作用途径的主要调节机制之一,影响着癌症的发展。据文献显示,在肺癌、膀胱癌、肝癌、鼻咽癌及肠癌患者中p14基因出现高甲基化。Xiaofang L等研究发现胆管癌中p14的甲基化率为24.0%,而正常组织中未发现甲基化,且甲基化程度与胆管癌的病理生物学行为及患者预后有关[2]。Lassacher A等研究发现Merkel细胞癌中p14的甲基化率为42.0%,未发现p14基因的突变,认为p14的甲基化与皮肤Merkel细胞癌的发生有关[3]。有关子宫内膜癌的研究显示,p14表达异常促进了子宫内膜癌的发展[4~5]。卵巢癌的发生与甲基化密切相关,研究发现 RASSF1A[6]、OPCML[7]、BRCA1[8]、WWOX[9]和ING4[10]在卵巢癌均出现高甲基化。但Teodoridis JM检测了106例Ⅲ/Ⅳ期上皮性卵巢癌中24个基因的CpG岛甲基化情况,其结果显示OPCML、DCRI、RASSGIA、HICI、BRCAI和 MINT25 的甲基化率分别是 33.3%、30.7%、36.4%、17.3%、12.3%和 12.0%,其余的基因未检测到甲基化(APAF-1,DAPK,FANCF,FAS,p14,p21,p73,SOCS-3 和 SURVIVIN)或 是 低 甲 基 化 (OPCML,DCR1,RASSF1A,MINT25,HIC1 和 SFRP1)[11]。
本研究显示,在正常卵巢组织和卵巢良性肿瘤中未发现p14的高甲基化,上皮性卵巢癌中也未发现p14甲基化。采用荧光定量PCR(FQ-PCR)检测组织标本中的p14mRNA表达水平,结果显示卵巢癌标本中p14mRNA表达水平明显高于卵巢良性肿瘤及正常卵巢组织,差异有统计学意义,P<0.05。免疫组化显示上皮性卵巢癌中p14蛋白表达明显低于良性卵巢肿瘤和正常卵巢组织中的表达,三组之间比较,差异有统计学意义,P<0.05。分化程度随组织异型性和p14蛋白缺失率增高而增高,但各组之间相比较,差异无统计学意义,P>0.05。Ⅲ期和Ⅳ期卵巢癌中p14蛋白表达缺失率较Ⅰ~Ⅱ期低,但差异无统计学意义,P>0.05。提示p14基因异常表达与卵巢癌的发生、发展有一定关系,但表达异常可能不是甲基化所致,p14基因甲基化失活在散发性卵巢癌中并不常见。与汤绍辉等研究的大肠癌中p14基因表达异常是p14基因甲基化所致不同[12],这可能与缺少同类研究以及我们的研究在病例种类的构成、标本量等方面的局限有关,也可能与实验方法的不同有关;再者可能是甲基化发生率与卵巢上皮性肿瘤的组织学类型及卵巢癌分期密切相关,这样可以解释各研究者所报道的同一种基因在卵巢癌中的甲基化率不同,先前报道的卵巢癌中高甲基化多是在生殖细胞癌和透明细胞癌中[13],而本研究中无卵巢生殖细胞癌病例,透明细胞癌仅1例。本实验的结论有待进一步的研究和扩大标本量得以证实。
[1]Métivier R,Gallais R,Tiffoche C,et al.Cyclical DNA methylation of a transcriptionally active promoter[J].Nature,2008,452(7183):45-50
[2]Xiaofang L,Kun T,Shaoping Y,et al.Correlation between promoter methylation of p14ARF,TMS1/ASC,and DAPK,and p53 mutation withprognosis in cholangiocarcinoma[J].World Journal of Surgical Oncology,2012,10:5
[3]Lassacher A,Heitzer E,Kerl H,et al.p14ARF和p53 hypermethylation is common but INK4a-ARF locus or p53 mutations are rare in Merkel cell carcinoma[J].J Invest Dermatol,2008,128(7):1788-1796
[4]何培芝,刘少扬,江大琼.p14ARF、p73和p53在宫颈癌中的表达及其临床意义[J].中国临床医学,2004,11(5):820-822
[5]冯艳玲,刘富元,高克菲,等.p14ARF和p53在子宫内膜癌组织中的表达及其临床意义[J].肿瘤防治杂志,2005,12(21):1646-1650
[6]Fu L,Zhang S.RASSF1A promtes apoptosis and suppresses the proliferationofovariancancercells[J].IntJMed,2014,33(5):1153-1160
[7]Zhou F,Tao G,Chen X,et al.Methylation of OPCML promoter in ovarian cancer tissues predicts poor patient survial[J].Clin Chem Lab Med,2014,52(5):735-742
[8]Stefansson OA,Jonasson JG,Olafsdottir K,et al.CpG island hypermethylation of BRCA1 and loss of pRb as co-occurring events in bassa/triple-negative breast cancer[J].Epigenetics,2011,6(5):638-649
[9]Yan H,Sun J.Methylation status of WWOX gene promoter CpG islands in epithelial ovarian cancer and its clinical significance[J].Biomed Rep,2013,1(3):375-378
[10]柳英兰,王英炜,吴迪,等.卵巢上皮癌中ING4基因启动子的甲基化状态及其临床意义[J].现代生物医学进展,2014,14(4):688-693
[11]Teodoridis JM,Hall J,Marsh S,et al.CpG island methylation of DNA damageresponsegenesinadvancedovariancancer[J]CancerRes,2005,65(19):8961-8967
[12]汤绍辉,杨东华,黄卫,等.大肠癌组织p14ARF与P53基因变异研究[J].中国病理生理杂志,2006,22(6):1191-1195
[13]Dhillon VS,Shahid M,Husain SA.CpG methylation of the FHIT,FANCF,cyclin-D2,BRCA2 and RUNX3 genes in Granulosa cell tumors(GCTs)of ovarian origin[J].Mol Cancer,2004,3(1):1-8

