替加环素与5种抗生素对多重耐药鲍曼不动杆菌体外联合药敏实验的研究
张肖冰, 杨事达, 姚志成, 单风平
(1.中国医科大学基础医学院 免疫学教研室,辽宁 沈阳 110122;2.辽宁省人民医院 检验科,辽宁 沈阳 110015;3.辽宁省人民医院 神经内科,辽宁 沈阳 110015)
鲍曼不动杆菌(Acinetobacterbaumanii,ABA) 是一种革兰阴性杆菌,广泛存在于自然界水及土壤、医院及人体皮肤表面、呼吸道、消化道和泌尿生殖道。鲍曼不动杆菌作为一种条件致病菌,当机体免疫力低下或免疫功能缺陷时会引起感染,如呼吸道系统感染、手术切口感染、败血症、获得性肺炎、伤口感染、泌尿生殖道感染和继发性脑膜炎等[1-3]。鲍曼不动杆菌的耐药机制较为复杂,但主要以外排泵的方式为主[4-6],这使得多重耐药菌株或泛耐药株的大量出现,因此临床医生选择药物比较困难,成为临床治疗的一大难题[7]。通过比较2005至2014年的CHINET不动杆菌属耐药性监测数据表明[8],我国不同地区19家医院2005年从临床分离的鲍曼不动杆菌共2 016株,2013年则达到顶峰9 024株。鲍曼不动杆菌对各种抗生素的敏感性逐年减低,多重耐药鲍曼不动杆菌(multidrug-resistantA.baumannii, MDR-ABA)和泛耐药的鲍曼不动杆菌(extremely-drug resistantA.baumannii)占比逐年增加,2014年基本都达到了45%以上。从患者分布来看,ICU患者分离出的鲍曼不动杆菌的耐药率较高,一般均在75%以上。这可能与ICU患者免疫力较差,且长期大量使用广谱抗生素有关。因此也有学者将多重耐药的鲍曼不动杆菌形象地称为21世纪革兰阴性杆菌中的“耐甲氧西林金黄色葡萄球菌”(Methicillin-resistantStaphylococcusaureus,MRSA)[9]。2012年《中国鲍曼不动杆菌感染诊治与防控专家共识》中提出对于泛耐药鲍曼不动杆菌的治疗提倡联合用药[10]。替加环素为甘氨酰环素类抗菌药物的第一个品种,对多重耐药的鲍曼不动杆菌有着较高的敏感性。但由于其在人体组织分布广泛,因此血药浓度、脑脊液药物浓度较低,需与其他抗菌药物联用较好[11]。因此本研究通过对替加环素与亚胺培南、头孢哌酮-舒巴坦、头孢曲松、左氧氟沙星、庆大霉素5种临床常用于鲍曼不动杆菌治疗的抗生素单药及两药联用的体外活性药敏的实验研究,以期发现较好的联合用药方案,为临床合理使用抗生素提供用药参考。
1 材料与方法
1.1 材料
1.1.1 菌株 2015年3月至2016年10月由辽宁省人民医院微生物室从临床分离出的鲍曼不动杆菌260株,经过纸片扩散法测试,将对3个及以上种类抗生素耐药的鲍曼不动杆菌列入实验菌株,共计50株(痰标本26株,血标本8株,脓标本4株,尿液标本3株,胆汁标本3株,穿刺液标本2株,透析液标本2株,腹水标本1株,创口分泌物标本1株);标准质控菌株:ATCC35218、ATCC25922均由辽宁省人民医院微生物室提供。
1.1.2 仪器及试剂 VITEK-2 compact全自动细菌鉴定及药敏分析系统(法国梅里埃公司),比浊仪(法国梅里埃公司);药敏纸片:哌拉西林、头孢哌酮/舒巴坦、氨苄西林/舒巴坦、哌拉西林/他唑巴坦、头孢他啶、头孢噻肟、头孢吡肟、亚胺培南、阿米卡星、庆大霉素、环丙沙星、左旋氧氟沙星、复方新诺明、四环素的药敏纸片(Oxoid赛默飞世尔科技有限公司)、替加环素(辉瑞制药有限公司)、硫酸庆大霉素注射液(河南润弘制药股份有限公司)、头孢曲松钠(上海罗氏制药有限公司)、盐酸左氧氟沙星(扬子江药业集团有限公司)、头孢哌酮舒巴坦(辉瑞制药有限公司)、亚胺培南西司他丁钠(杭州默沙东制药有限公司)。
1.1.3 培养基 哥伦比亚血琼脂平板(法国梅里埃公司)、Muller-Hinton(MH平板)(天津金章科技发展有限公司)、Muller-Hinton钙离子调节肉汤干粉(Oxoid赛默飞世尔科技有限公司)。
1.2 方法
1.2.1 鲍曼不动杆菌的判定 选取临床标本分离出的细菌,经哥伦比亚血平板或麦康凯平板培养18~24 h后,Vitek 2 compact全自动分析仪鉴定,确认为鲍曼不动杆菌后放入脱脂牛奶中于-80 ℃冰箱中保存。
1.2.2 纸片扩散药敏法 取菌落配置0.5麦氏浊度的菌悬液,用棉签涂布于MH平板,室温静置3~5 min,用纸片分配器将抗生素药片贴于平板表面,将其贴平后置于5%的CO2培养箱中18~24 h后,准确测量抑菌环直径,根据CLSI M100的最新标准判定结果。
1.2.3 多重耐药鲍曼不动杆菌的判定 将对青霉素类、头孢类、碳青霉烯类、氟喹诺酮类、氨基糖苷类、四环素类中的3类或3类以上抗生素耐药的鲍曼不动杆菌划归为多重耐药的鲍曼不动杆菌。
1.2.4 微量肉汤稀释法 从-80 ℃冰箱中取出已经配置好的抗生素各一支,待室温溶解后将其置于振荡器混匀,并配置成相应浓度的抗生素应用液,其中:替加环素、亚胺培南、头孢哌酮舒巴坦、头孢曲松、左氧氟沙星、庆大霉素的第一孔稀释浓度分别为128、1 024、1 024、1 024、 1 024、4 096 μg/mL。根据不同的抗生素选取不同的稀释液机制,将抗生素做倍比稀释以作备用。分别加入96孔聚苯乙烯板孔中,其中第1~11孔加入抗生素,每孔100 μL,第12孔加入100 μL的肉汤,为生长对照。将浓度为106cfu/mL的菌悬液加入第1孔至第12孔中,每个实验菌株为一排,使得最终的每孔细菌数为5×105cfu/mL。此时,每孔中含200 μL的实验液体,抗生素与菌悬液各100 μL。将加好的96孔聚苯乙烯板放入37 ℃孵育箱中孵育18~24h后观察结果,每行以肉眼可见的不生长鲍曼不动杆菌的实验孔的抗生素浓度作为该抗生素的最小抑菌浓度值,并分别记录。
1.2.5 联合药敏实验 棋盘法设计:纵向(A~H)加入替加环素的降梯度方向,横向(1~12)分别加入5种抗生素。每孔分别加入2种联合用药的抗生素各50 μL后再加入浓度为5×105cfu/mL的菌悬液100 μL,震荡混匀后,将96孔板放入孵育箱中,培养18~24 h后观察5种抗生素与替加环素两两应用后的MIC替加环素和MIC5种抗生素。
1.2.6 FIC指数计算与判读 FIC指数=MIC甲药联合/MIC甲药单用+MIC乙药联合/MIC乙药单用。FIC指数判读标准:当FIC指数<0.5时,两种药为协同作用;当FIC指数=0.5~1时,两种药为相加作用;当1
1.2.7 统计方法 应用SPSS软件,采用配对T检验和几何均数,统计数据。
2 结果与分析
2.1 多重耐药鲍曼不动杆菌的检出率
经过纸片扩散法复核后,多重耐药鲍曼不动杆菌的检出率为86.2%(50/58)。
2.2 50株多重耐药鲍曼不动杆菌药敏耐药性分析
由表1可以看出,50株鲍曼不动菌对14种临床常用治疗鲍曼不动杆菌的抗生素耐药性均达到80%以上,其中对阿米卡星(14%)、复方新诺明(14%)、四环素(14%)、亚胺培南(12%)敏感性较高,但也不十分理想;耐药性中,头孢哌酮-舒巴坦(80%)、阿米卡星(84%)、复方新诺明(84%)相对较低,头孢哌酮-舒巴坦中介率最高(18%),见表1。
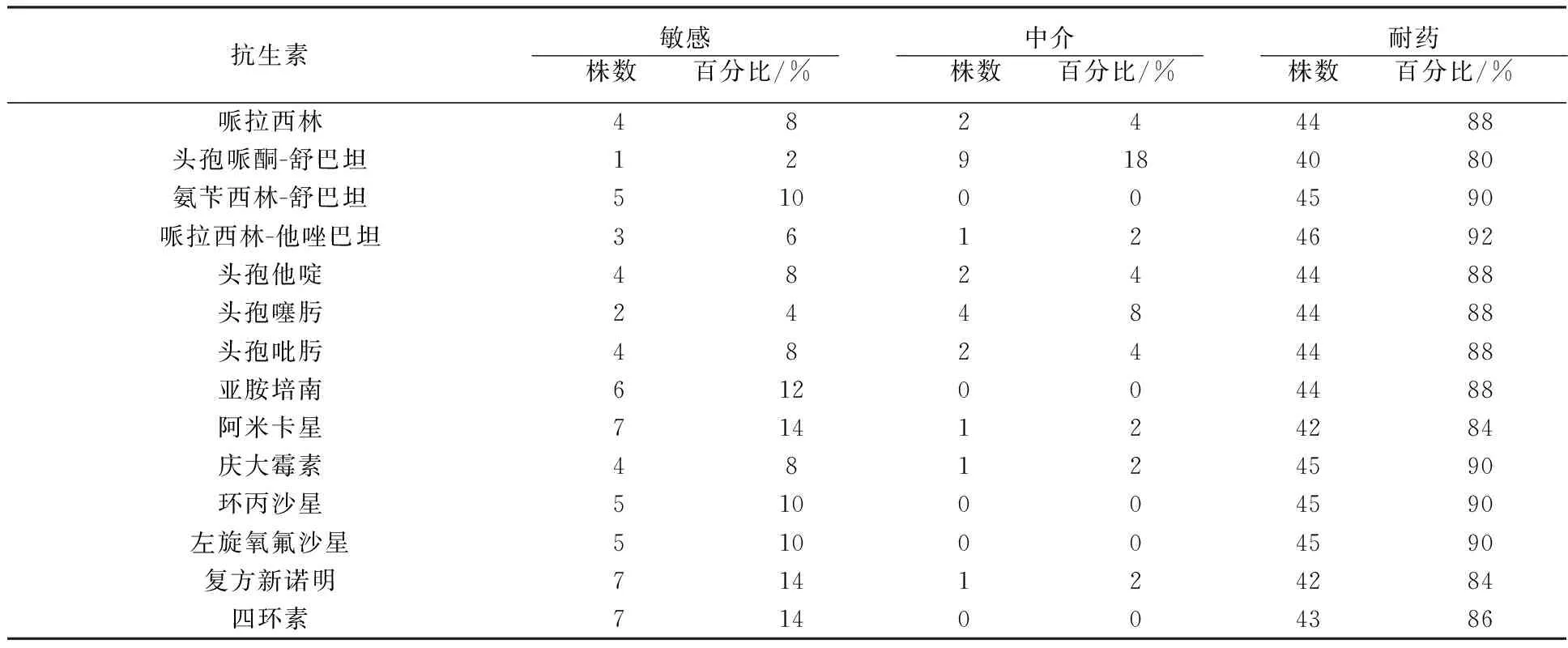
表1 50株MDR-ABA的K-B法药敏实验结果
2.3 替加环素与5种抗生素分别应用的MIC数据分析
替加环素在与亚胺培南、头孢哌酮舒巴坦、头孢曲松、左氧氟沙星联用后,MIC50、MIC90、MICG均为下降趋势,而与庆大霉素联用后MIC50、MIC90、MICG均为上升趋势,且替加环素与5种抗生素的单用MIC和联用MIC比较,均有显著性差异(P<0.05)。见表2。

表2 替加环素与亚胺培南、头孢哌酮舒巴坦、头孢曲松、左氧氟沙星、庆大霉素单用和联合应用对MDR-ABA(n=50)的MIC50、MIC90、MICGTable 2 The MIC50,MIC90,MICG of Tigecycline and Imipenem, cefoperazone sulbactam, ceftriaxone, levofloxacin, gentamicin alone and in combination with MDR-ABA (n=50)
注: TGC:替加环素;IPM:亚胺培南;SCF:头孢哌酮舒巴坦;CRO:头孢曲松;LEV:左氧氟沙星;CN:庆大霉素
2.4 替加环素与5种抗生素的抑菌百分率曲线分析
由图1可知,亚胺培南(图1A)、头孢哌酮舒巴坦(图1B)、头孢曲松(图1C)、左氧氟沙星(图1D)在与替加环素联用后,浓度累积抑菌曲线均向左侧移动,说明更低的药物浓度能够达到相同的抑菌效果,但庆大霉素(图1E)与替加环素联用后浓度累积抑菌曲线均向右侧移动,说明为了达到相同的抑菌效果,需要更高的药物浓度。

图1 替加环素与5种抗生素对MDR-ABA抑菌百分率曲线(n=50)Fig.1 The concentration cumulative percentage inhibition curves of tigecycline and 5 antibiotics alone and in combination on MDR-ABA (n=50)A:替加环素与亚胺培南;B:替加环素与头孢哌酮舒巴坦;C:替加环素与头孢曲松;D:替加环素与左氧氟沙星;E:替加环素与庆大霉素;下图同A: tigecycline and imipenem; B: tigecycline and cefoperazone sulbactam; C: tigecycline and ceftriaxone; D: tigecycline and levofloxacin; E:tigecycline and gentamicin;same the follow
2.5 替加环素与与5种抗生素的FIC指数分布分析
亚胺培南(图2A)、头孢哌酮舒巴坦(图2B)、头孢曲松(图2C)、左氧氟沙星(图2D)在与替加环素联用后,FIC指数的分布大部分在0.5~1之间,说明这4种抗生素与替加环素具有协同或相加的作用。但是庆大霉素(图2E)与替加环素联用后FIC指数的分布均在2以上,说明庆大霉素与替加环素之间的作用为拮抗作用(见图2)。
3 讨 论
替加环素具有广谱的抗菌型、对革兰阳性菌、革兰阴性菌、厌氧菌、耐甲氧西林金黄色葡萄球菌等均有很好的抗菌效果[12],是目前面对多重耐药鲍曼不动杆菌治疗时的“最后手段”。但根据数据显示,有些医院的鲍曼不动杆菌对替加环素的耐药率甚至达到了50%以上,辽宁省人民医院的这一数据也达到30%以上。这可能与体外敏感实验的操作不当有关,如替加环素纸片的保存及M-H平板是否为新鲜配制等[13]。本研究严格遵照2009年王辉等[13]发布的新型甘氨酰环素类抗菌药物替加环素的体外药敏试验操作规程操作,在进行肉汤稀释法测试MIC值时,严格保证肉汤为新鲜配制[14-15],结果替加环素的耐药结果由之前用纸片检测的30%耐药率下降至2%中介,无耐药菌株。可见替加环素对辽宁省人民医院分离的鲍曼不动杆菌仍具有较好的抗菌效果。但近年来随着抗菌素的大量使用,替加环素的耐药率也有上升趋势[16]。因此合理地与其他抗生素联合使用,减少替加环素的使用量但却达到同样的效果,从而减少替加环素耐药情况的发生就成了目前临床医生的共识。2012年,我国发布了多重耐药鲍曼不动杆菌的治疗准则,其中也提到建议采取联合用药的方式。
临床如何制定用药方案,很大程度上取决于细菌的体外敏感实验。而如何制定联合用药方案,临床医生可能更多地是依靠经验,但是FIC指数给临床医生提供了一个合理选择抗生素联合应用的数据支撑,使得临床医生可以选择FIC数值较低,即两者之间存在协同或相加的药物来对患者进行治疗。本研究选取临床常用的几大类抗生素,并在其中选取了有代表性的亚胺培南、头孢哌酮舒巴坦、左氧氟沙星、头孢曲松和庆大霉素。结果显示,替加环素、亚胺培南、头孢哌酮舒巴坦、左氧氟沙星、头孢曲松这4种抗生素均对替加环素表现出较好的协同和相加作用,但是庆大霉素与替加环素联合使用后显示出拮抗作用,这可能与两药均与核糖体30S亚基结合,造成作用位点过于相近有关。但是对于其他的氨基糖苷类药物在与替加环素联合使用时,是否也会产生拮抗作用,本文并未讨论。
综上,在临床选择治疗药物时可以根据体外药敏实验,制定用药方案,并结合其他抗生素的MIC结果,合理地选择抗生素与替加环素联合应用,达到更好地抗菌效果且减少替加环素的使用,从而降低替加环素耐药情况的发生,并且对减少药物的不良反应有很大的帮助。
[1] Peleg A Y, Seifert H, Paterson A D L.Acinetobacterbaumannii: emergence of a successful pathogen[J]. Clinical Microbiology Reviews, 2008, 21(3):538-582.
[2] Munozprice L S, Weinstein R A.Acinetobacterinfection[J]. New England Journal of Medicine, 2008, 358(26):2846-2847.
[3] 李显志, 凌保东. 2006年细菌对抗菌药物耐药机制研究进展回顾[J]. 中国抗生素杂志, 2007, 32(4):193-202.
[4] Ughachukwu P, Unekwe P. Efflux pump-mediated resistance in chemotherapy[J]. Annals of Medical & Health Sciences Research, 2012, 2(2):191-198.
[5] Amaral L, Martins A. Efflux pumps of Gram-negative bacteria: what they do, how they do it, with what and how to deal with them[J]. Frontiers in pharmacology,2014, 4:168.
[6] Calgin M K, Sahin F, Turegun B, et al. Expression analysis of efflux pump genes among drug-susceptible and multidrug-resistantMycobacteriumtuberculosisclinical isolates and reference strains[J].Diagnostic Microbiology & infectious Disease, 2013, 76(3):291-297.
[7] Gootz T D, Marra A.Acinetobacterbaumannii: an emerging multidrug-resistant threat[J]. Expert review of anti-infective therapy, 2008, 6(3):309-325.
[8] 张辉, 张小江, 徐英春,等. 2005-2014年CHINET不动杆菌属细菌耐药性监测[J]. 中国感染与化疗杂志, 2016, 16(4):429-436.
[9] 俞云松. 多药耐药鲍曼不动杆菌——21世纪革兰阴性菌的“MRSA”[J]. 中华临床感染病杂志, 2009, 2(2):65-68.
[10] 陈佰义, 何礼贤, 胡必杰,等. 中国鲍曼不动杆菌感染诊治与防控专家共识[J]. 中华医学杂志, 2012, 92(2):3-8.
[11] Waites K B, Duffy L B, Dowzicky A M J. Antimicrobial susceptibility among pathogens collected from hospitalized patients in the United States and in vitro activity of tigecycline, a new glycylcycline antimicrobial[J]. Antimicrobial Agents & Chemotherapy, 2006, 50(10):3479-3484.
[12] Doan T L, Fung H B, Mehta D, et al. Tigecycline: a glycylcycline antimicrobial agent[J]. Clinical Therapeutics, 2006, 28(8):1079-1106.
[13] 王辉, 倪语星, 陈民钧,等. 新型甘氨酰环素类抗菌药物替加环素的体外药敏试验操作规程[J]. 中华检验医学杂志, 2009, 32(11):1208-1213.
[14] Petersen P J, Bradford P A. Effect of Medium Age and Supplementation with the Biocatalytic Oxygen-Reducing Reagent Oxyrase on In Vitro Activities of Tigecycline against Recent Clinical Isolates[J]. Antimicrobial Agents & Chemotherapy, 2005, 49(9):3910-3918.
[15] Jones R N, Ferraro M J, Reller L B, et al. Multicenter Studies of Tigecycline Disk Diffusion Susceptibility Results forAcinetobacterspp.[J]. Journal of Clinical Microbiology, 2007, 45(1):227.
[16] 周秀珍, 刘建华, 王艳玲,等. 鲍曼不动杆菌连续12年的感染分布及耐药性动态变迁[J]. 中国临床药理学杂志, 2011, 27(10):755-758.