不同适应温度对镉暴露中大型溞生理和亚细胞水平的作用
李爽,盛连喜,姜海波
1. 北华大学林学院环境科学系, 吉林 132013 2. 东北师范大学环境科学系, 长春 130024
污染物的毒理学实验一般在20 ℃或者在测试生物的最适饲养温度下进行。但温度是非常重要的生态因子,温度的改变会影响水生生物的代谢、移动、觅食活动从而影响其吸收、清除和解毒速率[1-3]。温度变化诱导的保护蛋白也会改变生物对化合物的敏感性[4]。在温度耐受限附近,温度本身也会变成环境压力并且扩大污染物对生物的副作用[5-6]。有研究显示[7]:实验温度和适应温度的不同可能导致污染物的毒性作用被低估。
镉是一种剧毒金属,由冶炼等过程释放到环境中,具有高毒性、难降解、易残留等特点[8]。镉能引起DNA损伤和氧化应激,损害繁殖,干扰生物体内的电子平衡[9]。不同适应温度对镉生物效应的影响未见报道。大型溞(Daphniamagna)是一种重要的水生生物,是水生食物链中重要的一环。本研究中,大型溞在20 ℃(一般毒性试验中使用的标准温度)、24 ℃和28 ℃下适应三代后暴露于0、20和40 μg·L-1的镉溶液中6 h,测定其子代48 h急性毒性、21 d存活率、21 d累积繁殖数(21-d CR)、第一次生育时间(TFB)、能量储存和电子转移活性(ETS)、热应激蛋白hsp70和金属硫蛋白(MT)的变化。我们期望通过以上指标的调查增加对温度在污染物暴露中作用的理解,为生态毒理学评价提供参考。
1 材料与方法(Materials and methods)
1.1 适应条件
本研究中使用的大型溞来自中国科学院武汉水生生物研究所,已经在本实验室培养10年以上。大型溞培养在不含EDTA的M7介质中,光照比16 h:8 h,温度20 ℃[10]。把驯养3 d的大型溞随机分成3组,其中2组使用鱼缸加热器(HCH-50W, 创星,中山)将水温以1 ℃·d-1的速度加热到24 ℃和28 ℃,另一组继续在20 ℃下培养。3组的后代分别再各自温度下适应3代,第4代用于镉暴露。一周更新培养介质2次,同时丢弃新生个体。大型溞每天3次喂以悬浮绿藻(羊角月牙藻(Pseudokirchneriellasubcapitata)),喂食率大约2×105cells·(mL·d)-1。藻按照ISO 8692指导培养[11]。
1.2 实验程序
试验使用氯化镉(分析纯, 德国默克)进行,0.2%的硝酸酸化。对照也同样进行酸化。配制1 g·L-1镉储备液。测试液中的镉浓度使用火焰原子吸收光谱(M1100, 美国,铂金埃尔默)进行分析,1 g·L-1镉标准液(德国默克)。实验稀释水为不含EDTA的M7介质。测量浓度和名义浓度的偏差不大于10%。对照和暴露后所有水中的未检出镉。
适应三代后的镉急性毒性实验根据OECD 202标准[12]大型溞急性毒性试验进行,暴露温度为标准规定的20℃。
镉暴露实验使用经实验室驯养3 d的大型溞进行。暴露时间为6 h,镉浓度分别为0(对照组),20和40 μg·L-1。暴露后生物转移到对照水体中,分成2部分:(1)根据OECD大型溞繁殖实验,生物一直培养21 d,记录大型溞21 d的存活率、第一次繁殖时间(TFB)和繁殖数(幼体数,21-d CR);(2)暴露3 d后收集大型溞,在-80 ℃的液氮下冷冻直至测量(能量储存,电子转移活性(ETS),hsp70和MT)。
采用蒽酮比色法测定糖含量、采用索氏抽提法测定脂肪含量、采用考马斯亮兰染色法测定蛋白质含量,三者的总和为大型溞的能量储存;采用氯化碘硝基四氮唑 (INT) 分光光度法测定电子转移活性(ETS)[13];采用SDS-PAGE电泳凝胶法[14-15]测定hsp70的变化;采用银饱和法测定MT的变化[16]。
1.3 统计分析
48 h-EC50s及95%的置信区间使用Origin软件计算(8.0 SR4, OriginLab Corporation, USA);采用Shapiro-WilkW检验法进行数据的正态分布检验;使用Friedmann ANOVA进行各个处理之间的差异分析;满足正态分布和同质性假设的48 h-EC50s值进行单因素方差分析(Dunnett 检验);能力储存、电子转移活性(ETS)、hsp70、MT值用非参数的Wilcoxon秩检验,P<0.05为差异显著。
2 结果(Results)
2.1 急性毒性
急性毒性试验结果如图1(A)。大型溞的平均急性镉耐性随着适应温度的升高而降低。48 h-EC50从20 ℃的(40.2±9.9) μg·L-1降低到24 ℃的(15.6±2.7) μg·L-1和28 ℃的(10.7±1.9) μg·L-1,不同适应温度下差异显著。
2.2 21 d存活和繁殖
图1(B)为镉暴露后大型溞的21 d存活率,对照组升高的适应温度并不影响大型溞的存活。20 μg·L-1镉暴露下,28 ℃的适应温度会导致存活率一个明显的、大约23%的降低。40 μg·L-1镉暴露下,24 ℃和28 ℃的适应温度都会导致存活率的明显变化,分别降低18%和87%左右。单一的温度适应和镉暴露并不影响大型溞的存活率,但双因素方差分析显示了一个明显的温度×镉的相互作用(表2)。

图1 (A)不同适应温度下大型溞的48 h-EC50及其标准偏差;(B)第4代大型溞在镉暴露之后的21 d存活率注:差异性分析中第一个字母代表不同适应温度下的差异,第二个字母代表不同镉浓度下的差异,不同的字母代表P<0.05。Fig. 1 (A) 48 h EC50 values with standard deviation (error bars) for three generations of Daphnia magna which have acclimated to different temperature; (B) 21-days survival with standard deviation (error bars) of fourth generation of D. magna after different Cd exposure Note: The first letter represents the difference between different temperatures under the same concentrations and the second represents the difference between different concentrations under the same temperature. Different letters indicate significant differences at P<0.05.
表1为存活溞的第一次生产时间(TFB)和21-d累积繁殖数(21-d CR)。总体上,20 ℃和24 ℃的适应温度下镉暴露并不影响大型溞的TFB和21-d CR,只有24 ℃时20 μg·L-1的镉暴露增加了TFB、24 ℃时40 μg·L-1的镉暴露降低了21-d CR。在28 ℃,镉暴露明显降低21-d CR且40 μg·L-1的暴露也明显增加了TFB。
2.3 能量储存和电子转移(ETS)系统活性
图2(A)为大型溞总能量储存(总的蛋白、糖和脂肪)的变化。能量储存随温度的升高而降低,24 ℃时分别降低了46%、48%和80%。28 ℃时分别降低了62%、60%和91%。而在同一温度下,只有镉浓度达到40 μg·L-1时,对大型溞的能量储存有明显影响。双因素方差分析显示温度、镉以及温度×镉都对能量储存具有明显影响。

图2 不同镉暴露浓度和不同适应温度下大型溞的能量储存(A)和电子转移活性(ETS)(B)注:差异性分析中第一个字母代表不同适应温度下的差异,第二个字母代表不同镉浓度下的差异,不同的字母代表P<0.05。Fig. 2 (A) Energy reserves with standard deviation (error bars) and (B) Energy transport system (ETS) activity (oxygen consumption) of Daphnia magna after different Cd exposure and acclimated temperaturesNote: The first letter represents the difference between different temperatures under the same concentration and the second represents the difference between different concentrations under the same temperature. Different letters indicate significant differences at P<0.05.
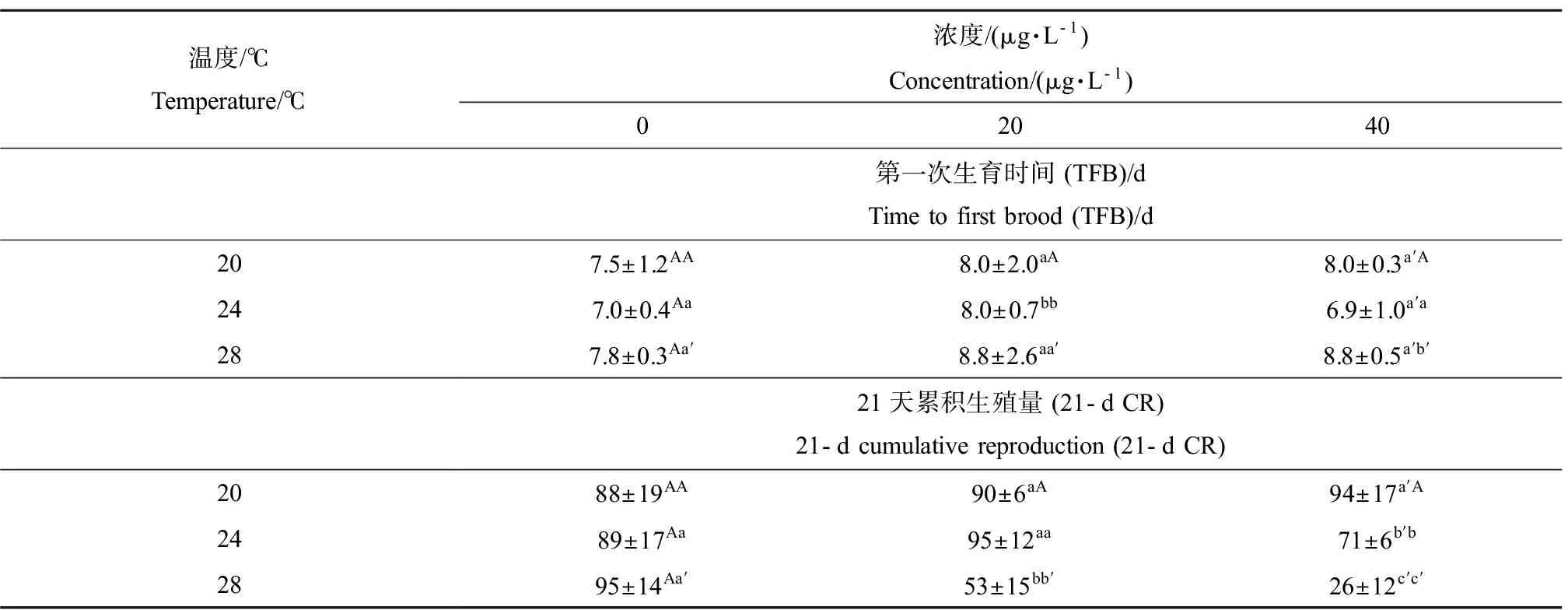
表1 不同镉暴露浓度和适应温度下的第一次生育时间(TFB)和21 d累积生殖量(21-d CR)Table 1 Time to first brood (TFB)±SD and 21-d cumulative reproduction (21-d CR) ±SD under different Cd concentrations and temperatures
注:第一个字母代表不同适应温度下的差异,第二个字母代表不同镉浓度下的差异。不同的字母代表P<0.05。
Note: The first letter represents the difference between different temperatures under the same concentration and the second represents the difference between different concentrations under the same temperature. Different letters indicate significant differences atP<0.05.
图2(B)为大型溞电子转移活性(ETS)的变化。任何适应温度和镉浓度下,ETS之间并无显著差异。双因素分析也并未显示任何明显的作用。
2.4 热应激蛋白hsp70
图3为不同适应温度和镉浓度下hsp70的变化。对照组只有适应温度为28 ℃时hsp70明显增加。20 μg·L-1镉暴露下,温度从20 ℃升高到24 ℃时hsp70明显上升,24 ℃和28 ℃之间没有变化。40 μg·L-1镉暴露下,当温度从20 ℃升高到24 ℃时hsp70明显上升,而28 ℃时的hsp70明显低于24 ℃时。同时,在20 ℃,40 μg·L-1的暴露能明显增加hsp70的水平但20 μg·L-1的暴露下hsp70没有明显变化。在24 ℃,镉浓度从0到 20 μg·L-1hsp70的水平随着镉浓度的增加而增加,从20 μg·L-1到 40 μg·L-1hsp70的水平随着镉浓度的增加而降低。在28 ℃,hsp70的水平随着镉浓度的增加而降低。双因素方差显示温度、镉以及温度×镉都对hsp70有明显作用。
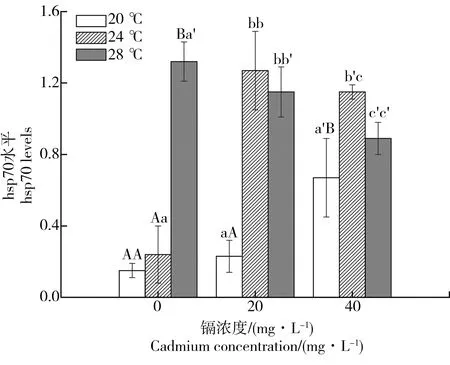
图3 不同镉浓度和适应温度下大型溞的hsp70水平注:差异性分析中第一个字母代表不同适应温度下的差异,第二个字母代表不同镉浓度下的差异。不同的字母代表P<0.05。Fig. 3 Hsp70 levels with standard deviation (error bars) of Daphnia magna after different Cd exposure and acclimated temperaturesNote: The first letter represents the difference between different temperatures under the same concentration and the second represents the difference between different concentrations under the same temperature. Different letters indicate significant differences at P<0.05.
2.5 金属硫蛋白MT
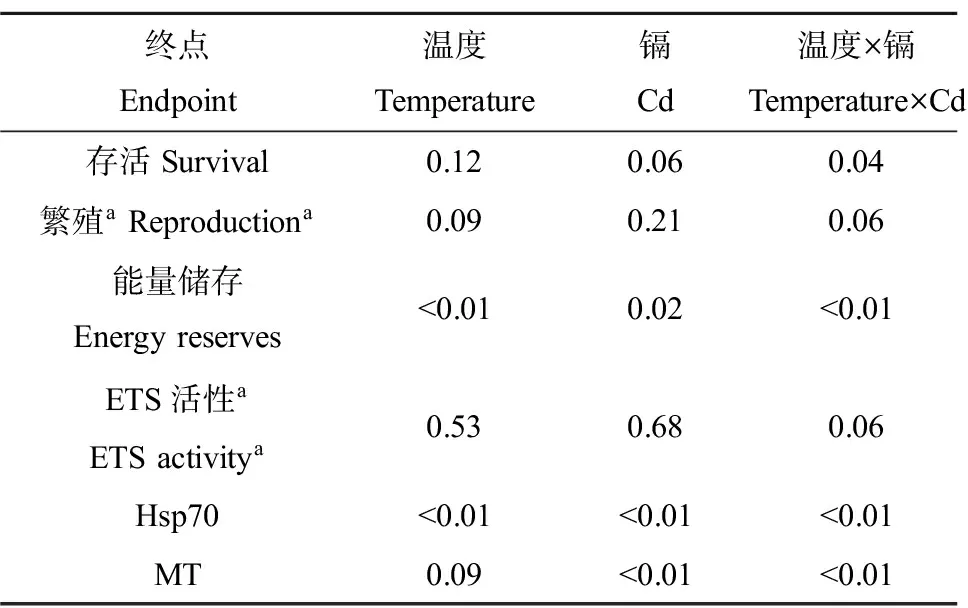
表2 温度、镉及其相互作用对大型溞不同实验终点影响的双因素方差分析结果Table 2 Results for two-way ANOVA for effects of temperature (T), cadmium (Cd) and their interactions on the different endpoints measured in Daphnia magna
注:a数据分析前进行秩转换。
Note:aData were rank transformed prior to analysis.
图4为温度适应和镉暴露对大型溞MT水平的影响。对照组只有适应温度达到28 ℃才能引起MT水平的变化。而20和40 μg·L-1镉暴露下,MT水平明显随着适应温度的增高而增高。同一温度下,MT的水平随着镉浓度的增加而增加。双因素方差显示了单独镉和温度×镉的相互作用。
3 讨论(Discussion)
温度是生物毒性暴露结果的重要影响因素,能引起水生变温生物对金属暴露的敏化[6-7]。温度影响大型溞镉耐性的形成[17],温度较高时(从10 ℃到35 ℃)镉对大型溞的急性毒性更强[4]。这与本研究中48 h-EC50值的变化相一致,这可能是由于温度较高时生物的代谢增强,促进了生物对镉的吸收。
Work和Gophen (1999)[18]报道温度影响翼弧溞(Daphnia.lumholtzi)的存活,使其生命周期从20 d(15 ℃)降低为17 d (29 ℃)。但本研究中,对照组大型溞在24 ℃和28 ℃下的存活几乎不受影响。然而,镉暴露下温度明显降低大型溞的21-d CR(除了24 ℃时20 μg·L-1的镉暴露)并且这一作用似乎随着镉浓度的增加而增加(在28 ℃时,40 μg·L-1的镉暴露下的存活只有13%)。
能量代谢是维持压力适应和耐性的关键。在变温生物中,温度决定生理生化反应的速率,升高的温度导致基础代谢需要的能量增加。金属暴露也会导致细胞为了修复和解毒而需要进行更多的代谢。温度和有重金属作用下生物的代谢需求增强,能量储存降低[19-20]。这与本研究的结果一致,温度和镉暴露都降低大型溞的能量储存。然而,温度在镉对大型溞能量储存影响中的作用并不确定。20 μg·L-1镉溶液暴露下,生物的能量储存并不低于对照组,只有镉浓度达到40 μg·L-1时才能观察到镉对大型溞能量储存的影响。
能量储存的降低意味着由于温度升高和镉暴露而增加的能量需求超过了能量供给。但降低的能量储存并不一定意味着能量供给的降低。生物能通过摄入更多的食物[21],上调消化酶,调节系统功能(呼吸和循环)和细胞代谢机制,如,线粒体功能来应对变化[7]。本研究中,不同的温度和不同浓度的镉暴露之间代表细胞氧消耗和最大代谢活性的ETS活性并没有显著差异,ETS活性不受温度、镉暴露以及它们的联合作用的影响。这一结果和Muyssen等[22]的研究相似,与Cherkasov等[23]和Lannig等[24]的结果不同。在前者的研究中,ETS活性不受温度和镉的影响,在后面的2个研究中,升高的温度和镉会增加生物的氧需求、降低血氧浓度,从而降低ETS活性。这一差异可能是由于溞体内的有效呼吸速率并不仅仅与ETS活性相关[25]。供氧、心率和其他与呼吸有关的生理过程也可能发生改变[20]。
为了应对较低的能量储存,生物会降低生育投入以限制能量损失。而本研究中,虽然对照组24 ℃和28 ℃生物的能量储存降低,但21-d CR并没有降低。相似的生育数量并不一定意味着投入给后代的能量相同,生物可能生育更小的后代,这种转换关系在温度影响下溞的后代中普遍存在[26]。相比于20 ℃的镉暴露,28 ℃下大型溞的21-d CR明显下降。这一结果与Heugens等[27]的研究不同,他们认为温度并不增强镉对大型溞繁殖量的副作用,但该研究也报道了升高温度能强化镉对种群增长率的副作用[27]。本研究中,由于21-d CR较低,种群增长率会随之降低。
hsp70能保护生物免受外界压力(包括热压力和有毒重金属)的损伤,同时作为分子伴侣,参与蛋白质代谢、细胞周期调控等重要的生命活动[15, 28-29]。本研究中,hsp70在温度(28 ℃)升高时显著上调,这与已有的对水生生物的研究相似[30-31]。较低的适应温度(24 ℃)并没有诱导hsp70,也许是因为水生生物hsp70的诱导温度一般在其适应温度的7~12 ℃以上[32-35]。
经过6 h镉暴露,大型溞hsp70的最高水平出现在中间温度(24 ℃),而在最高温度(28 ℃)时下降,这也许是由于hsp70的合成机制受到损伤[36]。虽然对照组大型溞hsp70的水平随着温度的升高而升高,但镉暴露大型溞hsp70在高温时的降低仍旧来自于镉暴露和温度的联合作用,因为在我们以前的研究中,只有镉浓度达到80 μg·L-1以上时,大型溞hsp70的表达才会受到抑制,而本研究中的镉浓度只有20 μg·L-1[29]。目前这种损伤的机制还不清楚。一个可能的解释是镉暴露损伤了细胞的生物合成能力,如转录和翻译过程[37-39]。另一个可能的解释是温度和镉暴露的联合压力导致线粒体功能受损、生物缺乏能量,生物合成hsp70或者hsp70发挥功能所需的ATP不足[40]。
金属硫蛋白(MT)的主要功能是调节细胞内必需和非必需金属(包括镉)的水平,帮助生物进行金属解毒[41-42]。对照组升高的温度(28 ℃)也能引起MT的上调。这在对其他水生生物温度作用的研究中也有出现[43-44]。本研究中MT水平在镉暴露后增加,镉暴露和温度的联合作用则诱导了更高的MT表达。众所周知,镉通过激活金属转录因子MTF-而诱导MT[45-46],而热诱导MT的上调以及结合作用的机制并不清楚。有研究者认为,和哺乳动物中的反应一样,热应激转录子(HSF)可能直接诱导MT启动子[47-48],或者热诱导氧化应激间接激活MT启动子中的抗氧化反应元件[49-50]。无论温度以及它与镉暴露的联合作用诱导MT的机制如何,MT似乎并不应该作为金属暴露的特殊生物标志物。
[1] Vergauwen L, Knapen D, Hagenaars A, et al. Hypothermal and hyperthermal acclimation differentially modulate cadmium accumulation and toxicity in the zebrafish [J]. Chemosphere, 2013, 91: 521-529
[2] Vergauwen L, Benoot D, Blust R, et al. Long-term warm or cold acclimation elicits a specific transcriptional response and affects energy metabolism in zebrafish [J]. Comparative Biochemistry and Physiology Part A: Molecular and Integrative Physiology, 2010, 157: 149-157
[3] Fisher S W, Hwang H, Atanasoff M, et al. Lethal body residues for pentachlorophenol in zebra mussels (Dreissenapolymorpha) under varying conditions of temperature and pH [J]. Ecotoxicology and Environment Safety, 1999, 43: 274-283
[4] Heugens E H W, Jager T, Creyghton R, et al. Temperature-dependent effects of cadmium onDaphniamagna: accumulation versus sensitivity [J]. Environmental Science and Technology, 2003, 37: 2145-2151
[5] Donker M H, Abdel-Lateif H M, Khalil M A, et al. Temperature, physiological time, and zinc toxicity in the isopodPorcellioscaber[J]. Environmental Toxicology and Chemistry, 1998, 17(8): 1558-1563
[6] Heugens E H W, Hendriks A J, Dekker T, et al. A review of the effects of multiple stressors on aquatic organisms and analysis of uncertainty factors for use in risk assessment [J]. Critical Reviews in Toxicology, 2001, 31(3): 247-284
[7] Sokolova I M, Lannig G. Interactive effects of metal pollution and temperature on metabolism in aquatic ectotherms: Implications of global climate change [J]. Climate Research, 2008, 37: 181-201
[8] Pinot F, Kreps S E, Bachelet M, et al. Cadmium in the environment: Sources, mechanisms of biotoxicity, and biomarkers [J]. Reviews Environmental Health, 2000,15: 299-323
[9] Vergauwen L, Hagenaars A, Blust R, et al. Temperature dependence of long-term cadmium toxicity in the zebrafish is not explained by liver oxidative stress: Evidence from transcript expression to physiology [J]. Aquatic Toxicology, 2013, 126: 52-62
[10] Organization for Economic Cooperation and Development. Report of the final ring test of theDaphniamagnareproduction test. OECD Series on Testing and Assessment 6 [S]. Paris: OECD, 1997
[11] International Organization for Standardization. ISO 8692. Water quality—Freshwater algal growth inhibition test withScenedesmussubspicatusandSelenastrumcapricornutum[S]. Geneva: ISO, 1989
[12] Organization for Economic Cooperation and Development. Guideline 202.Daphniasp, Acute Immobilisation Test [S]. Paris: OECD, 2004
[13] De Coen W M, Janssen C R. The use of biomarkers inDaphniamagnatoxicity testing. IV. Cellular energy allocation: A new methodology to assess the energy budget of toxicant-stressed Daphnia populations [J]. Journal of Aquatic Ecosystem Stress Recovery, 1997, 6: 4-55
[14] Haap T, Triebskorn R, Köhler H R. Acute effects of diclofenac and DMSO toDaphniamagna: Immobilisation and hsp70 induction [J]. Chemosphere, 2008, 73: 353-359
[15] Haap T, Köhler H R. Cadmium tolerance in sevenDaphniamagnaclones is associated with reduced hsp70 baseline levels and induction [J]. Aquatic Toxicology, 2009, 94: 131-137
[16] Scheuhammer A M, Cherian M G. Quantification of metallothioneins by a silver-saturation method [J]. Toxicology and Applied Pharmacology, 1986, 3: 417-425
[17] Stuhlbacher A, Bradley M C, Naylor C, et al. Variation in the development of cadmium resistance inDaphniamagnastraus: Effect of temperature, nutrition, age and genotype [J]. Environmental Pollution, 1993, 80: 153-158
[18] Work K A, Gophen M. Factors which affect the abundance of an invasive cladoceran,Daphnialumholtzi, in U.S. reservoirs [J]. Freshwater Biology, 1999, 42: 1-10
[19] Sibly R M, Calow P. A life-cycle theory of responses to stress [J]. Biological Journal of the Linnean Society, 1989, 37: 101-116
[20] Pörtner H O. Climate variations and the physiological basis of temperature dependent biogeography: Systemic to molecular hierarchy of thermal tolerance in animals [J]. Comparative Biochemistry and Physiology A: Physiology, 2002, 132: 739-761
[21] Soetaert A, Vandenbrouck T, Van D V K, et al. Molecular responses during cadmium-induced stress inDaphniamagna: Integration of differential gene expression with higher-level effects [J]. Aquatic Toxicology, 2007, 83: 212-222
[22] Muyssen B T A, Janssen C R. Multi-generation cadmium acclimation and tolerance inDaphniamagna[J]. Environmental Pollution, 2004, 130: 309-316
[23] Cherkasov A S, Biswas P K, Ridings D M, et al. Effects of acclimation temperature and cadmium exposure on cellular energy budgets in marine molluscCrassostreavirginica: Linking cellular and mitochondrial responses [J]. Journal of Experimental Biology, 2006, 209: 1274-1284
[24] Lannig G, Cherkasov A S, Pörtner H O, et al. Cadmium-dependent oxygen limitation affects temperature tolerance in eastern oysters (CrassostreavirginicaGmelin) [J]. American Journal of Physiology, 2008, 294: 1338-1346
[26] Yampolsky L Y, Scheiner S M. Why larger offspring at lower temperatures? A demographic approach [J]. American Naturalist, 1996, 147: 86-100
[27] Heugens E H W, Tokkie L T B, Kraak M H S, et al. Population growth ofDaphniamagnaunder multiple stress conditions: Joint effects of temperature, food, and cadmium [J]. Environmental Toxicology and Chemistry, 2006, 25: 1399-1407
[29] Li S, Xu J B, Sheng L X. The trans-generation effect during pulsed cadmium exposure: Tolerance and induction of hsp70 [J]. Ecotoxicology and Environment Safety, 2014, 107: 300-305
[30] Osovitz C J, Hofmann G E. Thermal history-dependent expression of the hsp70 gene in purple sea urchins: Biogeographic patterns and the effect of temperature acclimation [J]. Journal of Experimental Marine Biological Ecology, 2005, 327(2): 134-143
[31] Deane E E, Woo N Y S. Cloning and characterization of the hsp70 multigene family from silver sea bream: Modulated gene expression between warm and cold temperature acclimation [J]. Biochemical and Biophysical Research Communications, 2005, 330(3): 776-783
[32] Buckley B A, Owen M E, Hofmann G E. Adjusting the thermostat: The threshold induction temperature for the heat-shock response in intertidal mussels (genusMytilus) changes as a function of thermal history [J]. Journal of Experimental Biology, 2001, 204: 3571-3579
[33] Hamdoun A M, Cheney D P, Cherr G N. Phenotypic plasticity of HSP70 and HSP70 gene expression in the pacific oyster (Crassostreagigas): Implications for thermal limits and induction of thermal tolerance [J]. The Biological Bulletin, 2003, 205: 160-169
[34] Fangue N A, Hofmeister M, Schulte P M. Intraspecic variation in thermal tolerance and heat shock protein gene expression in common killifish,Fundulusheteroclitus[J]. Journal of Experimental Biology, 2006, 209: 2859-2872
[35] Tomanek L. Variation in the heat shock response and its implication for predicting the effect of global climate change on species' biogeographical distribution ranges and metabolic costs [J]. Journal of Experimental Biology, 2010, 213: 971-979
[36] Hofmann G E. Patterns of hsp gene expression in ectothermicmarine organisms on small to large biogeographic scales [J]. Integrative Comparative Biology, 2005, 45: 247-255
[37] Poynton H C, Varshavsky J R, Chang B.Daphniamagnaecotoxicogenomics provides mechanistic insights into metal toxicity [J]. Environmental Science and Technology, 2007, 41(3): 1044-1050
[38] Connon R, Hooper H L, Sibly R M. Linking molecular and population stress responses inDaphniamagnaexposed to cadmium [J]. Environmental Science and Technology, 2008, 42(6): 2181-2188
[39] Poynton H C, Taylor N S, Hicks J, et al. Metabolomics of microliter hemolymph samples enables an improved understanding of the combined metabolic and transcriptional responses ofDaphniamagnato cadmium [J]. Environmental Science and Technology, 2011, 45(8): 3710-3717
[40] Bodar C W M, Van Donselaar E G, Herwig H J. Cytopathological investigations of digestive tract and storage cells inDaphniamagnaexposed to cadmium and tributyltin [J]. Aquatic Toxicology, 1990, 17(4): 325-337
[41] Klaassen C D, Liu J, Choudhuri S. Metallothionein: An intracellular protein to protect against cadmium toxicity [J]. Annual Review of Pharmacology and Toxicology, 1999, 39: 267-294
[42] Amiard J C, Amiard-Triquet C, Barka S. Metallothioneins in aquatic invertebrates: Their role in metal detoxification and their use as biomarkers [J]. Aquatic Toxicology, 2006, 76: 160-202
[43] Olsson P E, Larsson A, Haux C. Influence of seasonal changes in water temperature on cadmium inducibility of hepatic and renal metallothionein in rainbow trout [J]. Marine Environment Research, 1996, 42: 41-44
[44] Guinot D, Urea R, Pastor A, et al. Long-term effect of temperature on bioaccumulation of dietary metals and metallothionein induction inSparusaurata[J]. Chemosphere, 2012, 87(11): 1215-1221
[45] Andrews G K. Regulation of metallothionein gene expression by oxidative stress and metal ions [J]. Biochemical Pharmacology, 2000, 59: 95-104
[46] Saydam N, Steiner F, Georgiev O. Heat and heavy metal stress synergize to mediate transcriptional hyper-activation by metal-responsive transcription factor MTF-1 [J]. Journal of Biological Chemistry, 2003, 278: 31879-31883
[47] Tamai K T, Liu X, Silar P. Heat shock transcription factor activates yeast metallothionein gene expression in response to heat and glucose starvation via distinct signalling pathways [J]. Molecular and Cellular Biochemistry, 1994, 14: 8155-8165
[48] Liu X D, Thiele D J. Oxidative stress induced heat shock factor phosphorylation and HSF-dependent activation of yeast metallothionein gene transcription [J]. Genes and Development, 1996, 10: 592-603
[49] Abele D, Philipp E, Gonzalez P. Marine invertebrate mitochondria and oxidative stress [J]. Frontiers in Bioscience, 2007, 12: 933-946
[50] Abele D, Heise K, Pörtner H O. Temperature-dependence of mitochondrial function and production of reactive oxygen species in the inter-tidal mud clamMyaarenaria[J]. Journal of Experimental Biology, 2002, 205: 1831-1841

