CAR-T治疗急性B淋巴细胞白血病后出现靶抗原丢失及疾病复发1例
邓小娟,王 平,杨武晨,墙 星,张洪洋,彭贤贵
(第三军医大学新桥医院血液科,重庆 400037)
难治性和复发性急性B淋巴细胞白血病(B-ALL)经规范化治疗后仍有较高的复发率和病死率,这使得临床治疗需要新的方法或手段。大多数B-ALL 细胞表面没有CD20抗原,而有CD19抗原。针对B-ALL的CD19抗原,目前国内外通过输注CD19 嵌合抗原受体T细胞(chimeric antigen receptor T cell,CAR-T) 来进行免疫治疗的这种新手段文献报道不少。CD19 特异性CAR-T 细胞能够识别白血病的特异性CD19 靶点,通过释放多种细胞因子,攻击具有CD19抗原的B 细胞,促使机体清除恶性肿瘤细胞[1]。
1 临床资料
患者女,60岁,于2014年10月出现全身乏力,皮肤苍白,活动后心累,全身瘀点、瘀斑,右上肢和右下肢尤为明显,偶有低热,血常规:白细胞3.11×109/L,中性粒细胞1.26×109/L,血红蛋白88 g/L,红细胞2.91×1012/L,血小板15×109/L。骨髓穿刺提示“急性淋巴细胞白血病(ALL)”,流式白血病免疫分型结果为CD45dim、CD19+、CD10+、CD34-、CD20part+、CD22+、CD79a+、CD38+、HLA-DR++、MPO-、cCD3-;白血病相关基因PCR检测:BCR-ABL/MLL-AF4/SIL-TAL1/E2A-HLF/HOX12/CAML-AF10均为阴性;染色体核型:46XX(5)/CD48+4dic(7)(q11;34)+9 16q+(5)。予VTLP方案诱导化疗后细胞形态学完全缓解(流式残留病灶检测阳性);以CAM方案化疗结束后复查骨髓涂片,细胞学结果显示原幼淋巴细胞占9.00%,流式微小残留病灶(MRD)检测结果阳性,提示ALL复发。后采用CTOD+大剂量甲氨蝶呤(MTX)方案和CVELP方案化疗,骨髓细胞学示原幼淋巴细胞比例40.00%~60.00%,提示ALL未缓解。患者及家属同意行CAR-T治疗。治疗前复查骨髓白血病细胞占66.40%,白血病免疫表型为CD45-CD19+CD34-CD10+CD20p+。
CAR-T细胞输注后患者白细胞介素(IL)-2、IL-6、肿瘤坏死因子(TNF)等指标2周内明显增高,并出现发热、血压下降、谷氨酸氨基转移酶增高、白细胞下降,考虑炎症因子释放综合征,予以升血压、保肝、升白细胞等对症治疗后好转[2-3]。CAR-T细胞输注后第1周复查骨髓,白血病细胞下降至20.10%;第2周下降至8.60%;第3周,骨髓细胞形态学达到缓解,分类未见原始幼稚淋巴细胞;流式残留病检测阴性,且CD19阳性细胞仅占0.04%,为此确认高危难治复发ALL经CAR-T细胞输注治疗后达到完全缓解。2个月后复查骨髓涂片,细胞形态学提示ALL复发,且白血病细胞形态变化不显著;流式细胞术提示复发,免疫表型为CD45dim、CD19-、CD22+、CD79a+、CD38+、CD10++、CD34+、CD20-、HLA-DR++、MPO-、cCD3-。
CAR-T细胞输注治疗前后白血病免疫表型及MRD结果,见表1。初诊、CAR-T治疗前后及复发时的免疫表型结果比较,见表2。
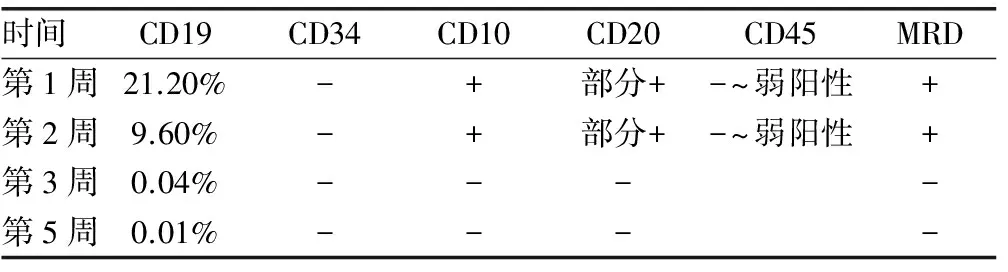
表1 CAR-T细胞输注治疗后MRD结果

表2 初诊、CAR-T治疗前、CAR-T治疗后及复发时的免疫表型结果比较
%:CD19阳性细胞占有核细胞百分比
2 讨 论
在ALL中约20%儿童和65%成人对化疗药物不敏感或缓解后复发[4]。CAR-T细胞输注是治疗难治复发性白血病的一种新的途径。对于B-ALL,CAR-T细胞是通过组织学特点识别白血病细胞的CD19特异性靶点[5],直接与细胞表面的CD19 结合,结合后的抗原可作为一种细胞信号传导区域,增强T细胞的活性,攻击肿瘤相关抗原。
虽然抗CD19 CAR-T细胞治疗存在着一定潜在风险,如免疫风暴等,但对于复发、难治或者原发耐药的B细胞恶性肿瘤,该方案仍不失为一个选择。但CD19 抗原的变异,以及具有干细胞样特征的B-ALL白血病起始细胞不表达CD19也同样会影响治疗的效果[6-7]。
本例患者采用CAR-T 细胞治疗技术取得了白血病的完全缓解。CAR-T细胞输注治疗后MRD监测结果表明CD19阳性细胞从第1周开始下降到第5周至最低值,说明CAR-T细胞的作用显著,呈一个循序渐进的过程。
BRENTJENS等[8]研究发现,1例B-ALL患者缓解2个月后再度复发,其体内出现的白血病细胞不表达CD19,推测是由于CAR-T细胞治疗后体内的白血病细胞发生了克隆演化,出现新的白血病细胞克隆。
本例患者2个月后出现复发,其白血病细胞同样不表达CD19,且出现CD34表达和CD10过度表达。其复发的机理可能是由于ALL的白血病干细胞分化模式多为分支模式,而不是单一的线性模式[9],机体内可能至少存在CD19阳性和CD19阴性的两种以上的白血病细胞克隆。CAR-T细胞治疗在大量杀灭CD19阳性优势克隆后,原不占优势的CD19阴性的白血病细胞克隆不受影响而优势克隆,其大量增殖导致白血病复发。另一种可能是CD19阳性的白血病细胞发生了免疫逃逸或免疫漂移,干细胞标志(CD34+)的出
现和祖细胞标志增加(CD10++)的情况说明白血病细胞向更加原始幼稚化发展,从而逃脱了免疫打击和监控而至的白血病复发。因此,CAR-T治疗后,MRD的监测不应该局限于CD19阳性细胞群,关注CD19阴性细胞群以及CD34和CD10阳性细胞群的免疫表型变化尤为重要。
[1]SCHOLLER J,BRADY T L,BINDER-SCHOLL G,et al.Decade-long safety and function of retroviral-modified chimeric antigen receptor T cells[J].Sci Transl Med,2012,4(132):132ra53.
[2]LEEN A M,CHRISTIN A,MYERS G D,et al.Cytotoxic T lymphocyte therapy with donor T cells prevents and treats adenovirus and Epstein-Barr virus infections after haploidentical and matched unrelated stem cell transplantation[J].Blood,2009,114(19):4283-4292.
[3]BRENTJENS R,YEH R,BERNAL Y,et al.Treatment of chronic lymphocytic leukemia with genetically targeted autologous T cells:case report of an unforeseen adverse event in a phase Ⅰ clinical trial[J].Mol Ther,2010,18(4):666-668.
[4]GADNER H,HAAS O A,MASERA G,et al.′Ponte di legno′ working group--report on the fifth international childhood acute lymphoblastic leukemia workshop:Vienna,Austria,29 April - 1 May 2002[J].Leukemia,2003,17(4):798-803.
[5]JUNE C H,BLAZAR B R,RILEY J L.Engineering lymphocyte subsets:tools,trials and tribulations[J].Nat Rev Immunol,2009,9(10):704-716.
[6] GRUPP S A,KALOS M,BARRETT D,et al.Chimeric antigen receptor-modified T cells for acute lymphoid leukemia[J].N Engl J Med,2013,368(16):1509-1518.
[7]LE VISEUR C,HOTFILDER M,BOMKEN S,et al.In childhood acute lymphoblastic leukemia,blasts at different stages of immunophenotypic maturation have stem cell properties[J].Cancer Cell,2008,14(1):47-58.
[8]BRENTJENS R J,RIVIERE I,PARK J H,et al.Safety and persistence of adoptively transferred autologous CD19-targeted T cells in patients with relapsed or chemotherapy refractory B-cell leukemias[J].Blood,2011,118(18):4817-4828.
[9]BOZIC I,ANTAL T,OHTSUKI H,et al.Accumulation of driver and passenger mutations during tumor progression[J].Proc Natl Acad Sci U S A,2010,107(43):18545-18550.

