野黍对烟嘧磺隆的抗性研究
马 红,马诚义,贾金蓉,乔禹欣,陈国峰
(1.东北农业大学农学院,哈尔滨 150030;2.黑龙江省农业科学院农产品质量安全研究所,哈尔滨 150010)
野黍[Eriochloa villosa(Thunb.)Kunth.]为早春性禾本科杂草,在大豆、玉米、小麦等作物田间均可发生[1]。野黍种子依靠风力传播,具有休眠特性,可抵御外界不良环境[2-4],植株叶片密生白色柔毛且分蘖能力强,可减弱除草剂吸收[5]。野黍防治方法主要有物理和化学方法,物理防治利用机械设备或人工方式除草,操作简单,但人力、物力消耗较大。化学防治利用除草剂除草,具有见效快、除草彻底等优点,但有杂草抗药性问题,增大防治和生产管理难度。烟嘧磺隆(Nicosulfuron)为日本石原产业公司研发的磺酰脲类内吸传导型除草剂,具有高效、低毒、广谱、低用量、低残留和强选择性等特点[6-8],常应用于玉米田防除禾本科杂草[9],在我国除草剂市场占主导地位[10]。近年来由于种植结构调整,玉米连作现象普遍,连年施用乙酰乳酸合成酶(ALS)抑制剂类除草剂烟嘧磺隆,野黍对烟嘧磺隆抗药性增强,由次要杂草上升为主要杂草[11-12]。在长期、大量使用单一除草剂情况下,杂草产生抗药性风险高,但机理及影响因素不同[13]。杂草抗药性机理主要包括靶标抗性和非靶标抗性机制[14]。靶标基因功能位点发生氨基酸水平突变会导致靶标酶活性改变,是杂草产生靶标抗性主因[15-17]。荠菜抗性种群ALS第197位脯氨酸(CCT)突变为丝氨酸(TCT)是抗性种群ALS对苯磺隆敏感性降低原因[15]。杂草ALS抑制剂被相关酶快速代谢解毒属于非靶标抗性机制[19]。朱宇耀等发现烟嘧磺隆对杂草ALS酶活性有显著抑制作用[20]。Ma等在抗性杂草生物型中,发现代谢解毒酶超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性增强[21-22]。Timmerman等发现GST活性和类型是植物抵抗除草剂能力重要指标[23-24]。
目前,针对黑龙江省玉米田野黍种群对烟嘧磺隆抗性研究较少。本研究通过测定喷施烟嘧磺隆后野黍叶片中叶绿素、靶标酶(ALS)、保护酶(SOD、POD)、解毒酶(GSH、GST)等含量和活性变化,为野黍防治提供理论基础。
1 材料与方法
1.1 材料
黑龙江省农田野黍发生严重地块采集成熟饱满野黍种子,布袋干燥避光保存,备用(见表1)。10%烟嘧磺隆悬浮剂,购自佛山市盈辉作物科学有限公司。
1.2 方法
1.2.1 不同抗性水平野黍种群对烟嘧磺隆敏感性测定
在直径为12 cm盆中装入3/4无用药史土壤,压实并保持土面平整。采用浸盆浇水法,向托盘中注水,使土壤由下至上充分吸水达饱和状态。每盆15粒野黍种子,覆1~2 cm细土轻压。野黍长至3~5叶期时,用背负式4喷头喷雾器喷施除草剂烟嘧磺隆,烟嘧磺隆用药量分别为27、54、108、162、216、270、324、378、432、540 a.i.g·hm-2(以有效成分计算)。清水处理为对照组,每处理5次重复。喷药后在自然条件下培养,观察野黍变化情况,于施药后14 d调查数据,计算烟嘧磺隆对野黍鲜重防效。鲜重防效计算公式如下:

根据鲜重防效计算不同抗性水平野黍种群对烟嘧磺隆抗性线性回归方程Y=bx+a、地上干重减少50%剂量GR50以及相关系数R2。设无用药史荒地野黍种群(M-3)抗性指数为1.00,以其GR50为标准,得出其他地区野黍种群抗性指数RI。RI值<2为敏感性野黍种群,RI值2~3为中抗性野黍种群,RI值>3为高抗性野黍种群。

1.2.2 不同抗性水平野黍种群对烟嘧磺隆抗药性测定
根据野黍对烟嘧磺隆敏感性反应试验结果,筛选敏感性(S)、中抗性(M)和高抗性(R)3种抗性水平野黍种群,探讨野黍对烟嘧磺隆抗药机制。于室外自然环境条件下种植敏感性、中抗性和高抗性3种抗性水平野黍种子,当野黍长至3~5叶期时,用背负式四喷头喷雾器喷施除草剂烟嘧磺隆,用药量为54 a.i.g·hm-2。设置空白对照组,每处理40次重复。于处理后2、3、5、7、12、14 d测定各项生理指标。
1.2.2.1 对叶绿素含量影响测定
施药后观察3种抗性水平野黍种群植株变化,叶绿素仪(CCM-300)测定其3~5叶期叶绿素含量。
1.2.2.2 对ALS活性影响测定
参照并改进文献[25]方法,取野黍叶片0.5 g,加液氮研磨,再加1.5 mL酶液,25 000×g 20 min离心,取上清液0.6 mL,提取液定容至1.5 mL后缓慢加入0.45 g(NH4)2SO4粉末,振荡,0 ℃沉降2 h后,25 000×g 20 min离心,沉降溶于1.2 mL酶溶解液中,即为酶提取液。
取0.4 mL酶提取液,加入缓冲液,再加0.5 mL酶反应液,35℃水浴黑暗条件下反应1 h后,加入0.1 mL 3 mol·L-1的H2SO4终止反应,60℃水浴脱羧15 min,依次加肌酸和甲萘酚,60℃水浴显色15 min,冷却后于525 nm波长下比色。
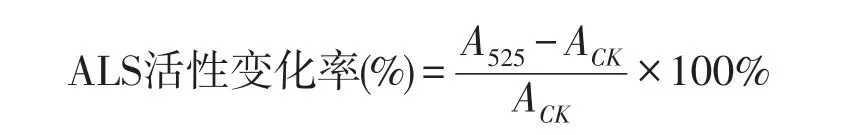
A525为对照管吸光值;ACK为照光管吸光度。
1.2.2.3 对SOD活性影响测定
参照并改进文献[26]方法,称取0.2 g野黍叶片放入研钵中,加入2 mL 10 mol·L-1磷酸缓冲液(pH 7),冰浴研磨后,倒入2 mL离心管中,10 000×g冷冻离心20 min,吸取上清液(即为待测酶液)放入试管中,0~4℃下保存待用。配制SOD反应液,以0.05 mol·L-1磷酸缓冲液(pH 7.8)130 mmol·L-1、Met 750 μmol·L-1、NBT 100 μmol·L-1、EDTA-Na220 μmol·L-1、FD H2O 按 15∶3∶3∶3∶3∶2.5 配制,依次加入试管中。取10 mL试管,每支试管中先加入5.9 mL SOD反应液,以蒸馏水0.1 mL代替酶提取液,混匀后,其中对照管用双层黑色硬纸套遮光,与其他试管同时置于26℃4 000 lx光照下反应15 min。反应结束后,以遮光对照管作为空白,在560 nm波长下测定各管吸光度。

ACK为照光对照管吸光值;At为照光管吸光度;V为酶液总体积;Vt为测定时酶液用量;0.5为将NBT还原抑制到对照一半时所需酶量。
1.2.2.4 对POD活性影响测定
参照并改进文献[27]方法,取5 mL试管,加0.05 mL酶液,每试管加入2 mL 10 mol·L-1磷酸缓冲液(pH 7),加入0.6 mL 1%愈创木酚,37℃水浴5 min,加入0.15 mL 0.1 mol·L-1H2O2后反应开始,对照管加磷酸缓冲液代替酶液,其他与测定管相同,用对照管调零。在470 nm波长下每隔1 min计数1次,记录3 min内变化值,以吸光度变化0.01为1个过氧化物酶活性单位(U)表示酶活力。

ΔA470为反应时间内吸光度变化;W为植物叶片鲜重(g);VT为提取酶液总体积(mL);Vs为测定时取用酶液体积(mL);t为反应时间(min)。
1.2.2.5 对GSH含量影响测定
参照并改进文献[28]方法。半胱氨酸可与二硫硝基苯甲酸(DTNB)试剂发生硫醇-2硫化物交换反应,反应中1分子的半胱氨酸引起1分子硫硝基苯甲基释放。pH为8时,在412 nm波长下,有强光吸收,比色法定量测定-SH基。GSH含量用μg·mg-1FW表示。
标准曲线制作:用缓冲液配制500 μg·mL-1GSH母液,分别取0、5、10、25、50、75、100、150、250、500、1 000 μL放入试管中,用0℃5%TCA溶液定容至5 mL,取11支洁净试管,分别加系列溶液0.2 mL,加0.02 mL DTNB显色液及2.78 mL磷酸缓冲液,412 nm波长下测OD值。以OD值为横坐标,GSH含量为纵坐标确定回归方程。
谷胱甘肽含量测定:取野黍叶片0.2 g,加1.2 mL 5%TCA,0~4℃下研磨,再用0.8 mL TCA润洗后倒入离心管中0~4℃下16 000×g离心15 min,取上清液备用。取0.2 mL提取物+2.78 mL缓冲液(pH 6.8)+0.02 mL DTNB比色。412 nm波长下测定OD值。根据标准曲线确定谷胱甘肽含量。
1.2.2.6 对GST活性影响测定
参照文献[29]方法,GST提取:取野黍叶片0.2 g,加入液氮并用研钵研碎,加入0.1 mol·L-1磷酸缓冲液(pH 6.8,内含质量分数为0.5%PVP和1 mmol·L-1PSMF)2 mL(0 ℃),快速研磨,搅拌均匀后,将混合液倒入2 mL离心管中0~4℃下20 000×g离心20 min。上清液即为待测酶液。
比色:1.99 mL缓冲液(pH 6.8)+0.9 mL 3.0 mmol·L-1GSH+10 μL上清液+0.1 mL 30 mol·L-1CDNB,自加入CDNB起开始计时,在340 nm波长下以分光光度计测90~120 s吸光值变化。以无酶提取液同样反应混合物作空白。

ΔA340为反应时间内吸光度变化;ε为产物在340 nm处摩尔吸光系数9.6×103mmol-1·cm-1;d 为比色皿直径(cm);VT为提取酶液总体积(mL);Vs为测定时取用酶液体积(mL);t为反应时间(min)。
1.2.3 数据处理方法
利用SPSS 17.0软件作显著性分析,Excel 2016处理数据得出不同抗性水平野黍种群对烟嘧磺隆抗性线性回归方程Y=bx+a、地上干重减少50%的剂量GR50及相关系数R2。设GR50最低地区野黍种群抗性指数为1.00,得出其他不同抗性水平野黍种群抗性指数RI。Origin 8绘制折线图。
2 结果与分析
2.1 不同抗性水平野黍种群对烟嘧磺隆敏感性测定结果
烟嘧磺隆施用后14 d,不同抗性水平野黍种群鲜重防效结果见表2。
以无药史荒地野黍种群(M-3)为标准,计算其他野黍种群抗性指数,结果表明,施用烟嘧磺隆后,M-3 GR50值最低,对烟嘧磺隆最敏感,验证野黍对烟嘧磺隆敏感性,以M-3GR50=10.8454为标准,设其抗性指数为1.00计算其他野黍种群抗性指数。M-3、M-9和M-5野黍种群抗性指数分别为1.00、1.19和1.57,为敏感性野黍种群;M-6、X-1和M-2野黍种群抗性指数分别为2.05、2.08和2.11,为中抗性野黍种群;M-16、M-1、X-3和X-2野黍种群抗性指数分别为3.23、4.51、6.48和8.30,为高抗性野黍种群。由此选定X-2野黍种群作为高抗性野黍种群(R),X-1野黍种群作为中抗性野黍种群(M),M-3野黍种群作为敏感性野黍种群(S)。以不同抗性群作为研究对象,进一步研究野黍对烟嘧磺隆抗药机制。

表2 不同抗性水平野黍种群对烟嘧磺隆抗性回归方程及抗性指数Table2 Regression equation and resistance index of Eriochloa villosa in different levels to nicosulfuron
2.2 野黍对烟嘧磺隆抗药性测定结果
2.2.1 对叶绿素含量影响结果
由图1可知,高、中抗性和敏感性野黍种群在喷施烟嘧磺隆后,叶绿素含量随施药天数增加呈先降后升趋势,表明烟嘧磺隆影响野黍叶片光合作用,叶绿素含量降低。
施药后第2天,3种抗性水平野黍种群叶绿素含量对照值分别为:235.14、204.23、165.36 mg·m-2,处理后值为:222.15、182.47、145.79 mg·m-2,均低于各自对照,差异显著(P<0.05)。施药后第5天,高、中抗性野黍种群叶绿素含量开始升高,敏感性野黍种群叶绿素含量无显著变化。施药后第14天,高抗性野黍种群叶绿素含量高于对照,中抗性野黍种群叶绿素含量接近对照,敏感性野黍种群叶绿素含量仍低于对照,且差异显著(P<0.05)。不同抗性水平野黍种群叶绿素含量变化不同,高抗性野黍种群(R)叶绿素含量受烟嘧磺隆胁迫前后均高于中抗性野黍种群(M)和敏感性野黍种群(S),叶绿素含量下降幅度较小,最终高于对照。

图1 烟嘧磺隆对不同抗性水平野黍种群叶绿素含量影响Fig.1 Effects of nicosulfuron on chlorophyll content of different resistance levels Eriochloa villosa
2.2.2 对ALS活性影响结果
由图2可知,高、中抗性野黍种群在喷施烟嘧磺隆后,ALS酶活性随施药天数增加呈先降后升趋势,敏感性野黍种群ALS酶活性随施药天数增加逐渐降低。
施药2 d后,3种抗性野黍种群ALS酶活性对照值为:87.57、80.26、69.93 nmol·mg-1·h-1,处理后值分别为:76.45、69.32、63.03 nmol·mg-1·h-1,均低于各自对照,差异性显著(P<0.05);施药后第5天,高、中抗性野黍种群ALS酶活性升高,敏感性野黍种群ALS酶活性降低;施药后第14天,3种抗性野黍种群ALS酶活性分别为86.15、70.48、52.73 nmol·mg-1·h-1,高抗性野黍种群 ALS 酶活性与对照(88.57 nmol·mg-1·h-1)接近,中抗性与敏感性野黍种群ALS酶活性均低于对照(80.82、70.49 nmol·mg-1·h-1)。施药后高抗性野黍种群ALS酶活性逐渐恢复,中抗性野黍种群ALS活性逐渐升高,但未达对照水平;敏感性野黍种群ALS活性呈下降趋势,低于对照。
2.2.3 对SOD活性影响结果
由图3可知,高、中抗性和敏感性野黍种群在喷施烟嘧磺隆后,SOD活性随施药天数增加呈先降后升趋势。施药后第2天,高、中抗性水平和敏感性野黍种群SOD活性分别为:160.72、158.35、156.91 U·mg-1FW,处理后为:155.26、150.37、144.74 U·mg-1FW,均低于各自对照,差异性显著(P<0.05)。施药后第5天,高、中抗性水平野黍种群SOD活性升高,敏感性野黍种群SOD活性降低;施药后第7天,3种抗性野黍种群SOD活性全部升高;施药后第14天,高、中抗性水平野黍种群SOD活性均高于各自对照,而敏感性野黍种群SOD活性虽然增高但低于对照。
2.2.4 对POD活性影响结果
由图4可知,高、中抗性和敏感性野黍种群在喷施烟嘧磺隆后,POD活性随喷药天数增加均呈先降后升趋势。施药后第2天,高、中抗性和敏感性野黍种群POD活性对照值为:232.26、201.57、180.18 U·g-1·min-1,处理后为:217.28、185.72、160.84 U·g-1·min-1,均低于对照且差异性显著(P<0.05);施药后第5天不同抗性水平野黍种群POD活性升高;施药后第14天,3种抗性野黍种群POD活性,对照为:228.24、201.62、178.04 U·g-1·min-1,处理后为235.38、198.63、170.18 U·g-1·min-1,其中高抗性野黍种群POD活性高于对照,中抗性野黍种群POD活性接近对照,敏感性野黍种群POD活性低于对照,差异显著(P<0.05)。
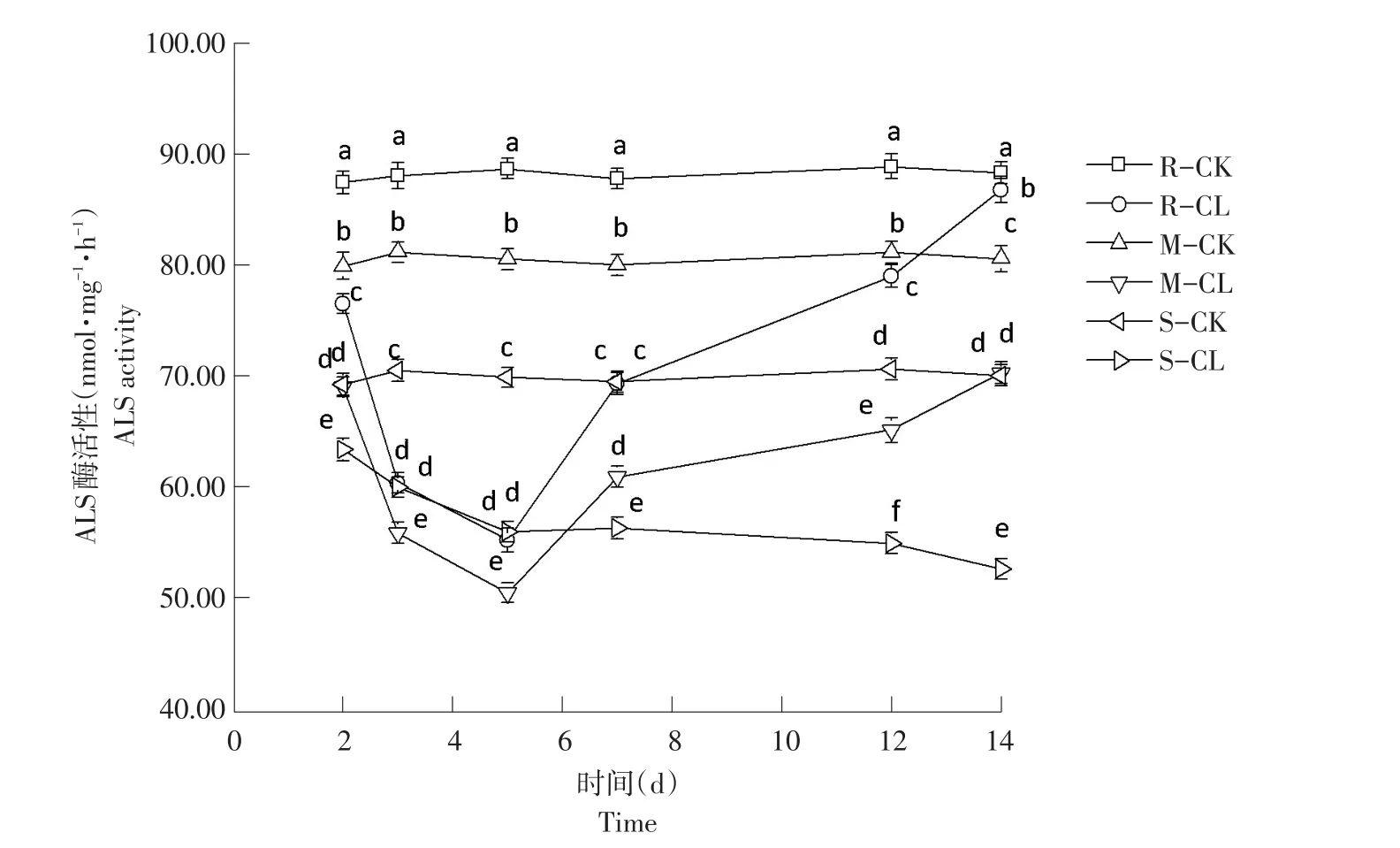
图2 烟嘧磺隆对不同抗性水平野黍种群ALS活性影响Fig.2 Effects of nicosulfuron on ALS activity of different resistance levels Eriochloa villosa
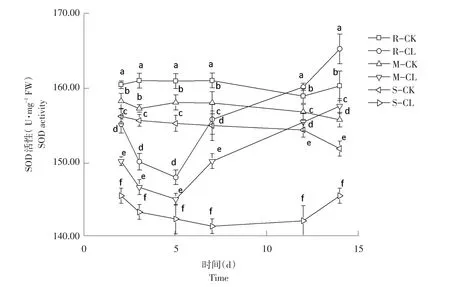
图3 烟嘧磺隆对不同抗性水平野黍种群SOD活性影响Fig.3 Effects of nicosulfuron on SOD activity of different resistance levels Eriochloa villosa

图4 烟嘧磺隆对不同抗性水平野黍种群POD活性影响Fig.4 Effects of nicosulfuron on POD activity of different resistance levels Eriochloa villosa
2.2.5 对GSH活性影响结果
由图5可知,高、中抗性和敏感性野黍种群在喷施烟嘧磺隆后,GSH含量随时间增加呈先降后升趋势。
施药后第2天,3种抗性野黍种群GSH含量对照为:23.15、20.26、16.17 μg·mg-1FW,处理后为:13.29、12.36、10.42 μg·mg-1FW,均低与各自对照,差异显著(P<0.05);施药后第5天,3种抗性水平野黍种群GSH含量开始增加,施药后第14天,3种抗性水平野黍种群分别为:对照23.42、19.41、16.72 μg·mg-1FW,处理后 25.24、15.36、9.06 μg·mg-1FW,差异显著(P<0.05)。高抗性野黍种群GSH含量高于对照,中抗性野黍种群接近对照,敏感性野黍种群低于对照。

图5 烟嘧磺隆对不同抗性水平野黍种群GSH含量影响Fig.5 Effects of nicosulfuron on GSH content of different resistance levels Eriochloa villosa
2.2.6 对GST活性影响结果
由图6可知,高、中抗性野黍种群在喷施烟嘧磺隆后,GST含量随施药天数增加呈先降后升趋势,敏感性野黍种群GST含量随施药天数增加而逐渐降低。施药后第2天,高、中抗性和敏感性野黍种群GST含量对照为:638.52、555.82、500.49 U·min-1·mg-1protein,处理后为:480.72、460.47、420.28 U·min-1·mg-1protein,均低于对照,差异显著(P<0.05)。施药后第5天,高、中抗性水平的野黍种群GST含量开始升高,而敏感性野黍种群GST含量持续降低;施药后第14天,3种抗性水平野黍种群GST含量分别为650.62、535.19、355.26 U·min-1·mg-1protein,高抗性野黍种群 GST含量高于对照(630.36 U·min-1·mg-1protein),中抗性与敏感性野黍种群GST含量均低于对照(558.28、470.25 U·min-1·mg-1protein)。
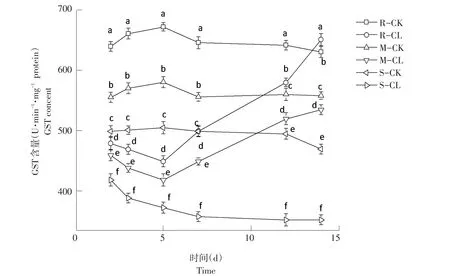
图6 烟嘧磺隆对不同抗性水平野黍种群GST活性影响Fig.6 Effects of nicosulfuron on GST activity of different resistance levels Eriochloa villosa
3 讨论与结论
多数除草剂直接或间接影响杂草光合作用。叶绿素捕获光能并开展光能转换,其含量与植物捕获光能能力呈正相关,可反映作物光合能力及同化产物积累能力[30]。张红刚等利用烟嘧磺隆处理黄芩叶片研究表明,烟嘧磺隆破坏黄芩叶片脂膜系统影响光合作用,叶绿素含量下降[31]。本研究结果表明,烟嘧磺隆使野黍叶片中叶绿素含量下降,高、中抗性水平野黍种群叶片中叶绿素含量随施药天数增加呈先降后升趋势,说明高、中抗性水平野黍种群受烟嘧磺隆作用后可恢复。敏感性野黍种群叶片中叶绿素含量随施药天数增加而降低,说明敏感性野黍种群受烟嘧磺隆作用后不可恢复。同时说明不同抗性野黍种群受烟嘧磺隆胁迫后,高抗性水平野黍种群叶绿素合成受抑制或破坏程度显著低于低抗性水平野黍种群。
烟嘧磺隆是一种高效磺酰脲类除草剂,其作用靶标为乙酰乳酸合成酶(ALS)[21],通过抑制ALS酶活力间接抑制支链氨基酸亮氨酸、异亮氨酸、缬氨酸生物合成,阻碍蛋白质生物合成抑制植物细胞分裂,导致植株黄化退绿死亡[32]。本试验研究结果表明,不同抗性野黍种群受到烟嘧磺隆胁迫后,高、中抗性野黍种群ALS酶活性随施药天数增加呈先降后升趋势,均接近对照,敏感性野黍种群ALS酶活性随施药天数增加降低,不同抗性野黍种群ALS酶活性均受烟嘧磺隆影响,说明烟嘧磺隆作用于野黍种群靶标位点导致野黍ALS酶活性受抑制。抗性程度越高ALS活性越高,与孙秀荣等用烟嘧磺隆防除玉米田一年生禾本科杂草结果一致[33]。但本研究仅分析不同抗性野黍种群ALS酶活性,缺乏分子生物学上抗性野黍种群ALS酶基因序列研究,后续研究应明确其是否存在靶标抗性。
本研究中野黍受到烟嘧磺隆胁迫后,不同抗性水平野黍种群超氧化物歧化酶(SOD)、过氧化物酶(POD)活性均受抑制,之后3种抗性水平野黍种群SOD、POD活性均逐渐恢复,与姜孝玉等植物受除草剂胁迫时SOD、POD活性迅速增强对活性氧抵御能力研究结果一致[34]。3种抗性水平野黍种群SOD、POD均呈先降后升趋势,高抗性野黍种群SOD、POD高于对照,中抗性野黍种群与对照接近,敏感性野黍种群低于对照,表明高、中抗药性野黍种群SOD、POD活性较高且增速较快、活性强,敏感性野黍种群SOD、POD活性恢复较慢、活性弱。
谷胱甘肽转移酶(GST)是一类胞质酶,可催化谷胱甘肽(GSH)经半胱氨酸硫原子与多种疏水性化合物亲电子基团连接作用,是生物体脱毒和排毒重要方式[35]。本试验中不同抗性野黍种群GSH、GST变化趋势一致,表明GSH与GST酶活性密切相关[36-37]。郭玉莲等研究表明,GST可促使植物GSH与氯乙酰胺类、三氮苯类、苯氧羧酸类、磺酰脲类及二苯醚类等除草剂产生轭合反应[38]。本文研究结果显示,抗性野黍种群在烟嘧磺隆胁迫时,通过提高GST活性和GSH含量代谢解毒烟嘧磺隆。但不同抗性野黍种群GST含量变化幅度不同,其中高抗性野黍种群GST含量升幅高于中抗性与敏感性野黍种群。
[1] 郭玉莲,黄春艳,黄元炬,等.15种除草剂对野黍的防治效果[J].杂草科学,2014,32(1):127-129.
[2] 于文.恶性杂草野黍防治技术[J].现代化农业,2007(6):7.
[3] 刘方明,梁文举,闻大中.耕作方法和除草剂对玉米田杂草群落的影响[J].应用生态学报,2005,16(10):1879-1882.
[4] 贾金蓉,马诚义,马红.野黍种子休眠特性及破除方法[J].江苏农业科学,2017,45(14):88-91.
[5] 何付丽,陈丽丽,郭晓慧,等.稀禾啶、烯草酮等6种除草剂对不同叶龄期野黍的防治效果比较[J].作物杂志,2013(1):112-116.
[6] 刘延,崔海兰,黄红娟,等.抗草甘膦杂草及其抗性机制研究进展[J].农药学学报,2008,10(1):10-14.
[7] 陶波,苏少泉,刘金宇.农作物对磺酰脲类除草剂耐性的研究[J].东北农业大学学报,1995,26(2):105-110.
[8] Williams B J,Harvey R G.Effect of nicosulfuron timing onwildproso millet(Panicum miliaceum)control in sweet corn(Zeamays)[J].Weed Technology,2000,14(2):377-382.
[9] Stall W M,Bewick T A.Sweet corn cultivars respond differentially to the herbicide nicosulfuron[J].Hort Science,1992,27(2):131-133.
[10] 吴翠霞,张宏军,张佳,等.玉米田主要杂草对烟嘧磺隆的抗性[J].植物保护,2016,42(3):198-203.
[11] 冯程程,马红.除草剂应用现状及挑战[J].江苏农业科学,2014,42(8):111-113.
[12] 黄春艳,陈铁保,王宇,等.高效盖草能加助剂对野黍防除效果的评价[J].杂草科学,2005(2):41-43.
[13] Acocer R M,Thill D C,Shafii B.Seed biology of sulfonylurearesistant and susceptible biotypes of prickly lettuce(Lactuca serriola)[J].Weed Technology,1992,6(4):858-864.
[14] 苏少泉.激素类除草剂的发展与杂草抗性[J].农药研究与应用,2011,15(6):1-6.
[15] Powles S,Qin Y.Evolution in action:Plants resistant to herbicides[J].Annu Rev Plant Biol,2010,61:317-347.
[16] Qin Y,Powles S.Metabolism-based herbicide resistance and cross resistance in crop weeds:A threat to herbicide sustainability and global crop production[J].Plant Physiol,2014,166:1106-1118.
[17] Patzoldt W L,Tranel P J.Multiple ALS mutations confer herbicide resistance in waterhemp(Amaranthus tuberculatus)[J].Weed Sci,2007,55:421-428
[18] 金涛.麦田杂草荠菜对苯磺隆抗性分子机制的研究[D].泰安:山东农业大学,2012.
[19] 李平生,魏松红,纪明山,等.野慈姑对ALS抑制剂的交互抗药性[J].农药,2015,54(5):366-368.
[20] 朱宇耀,朱宇航.烟嘧磺隆悬浮剂防除玉米田杂草试验[J].现代化农业,2014,414(1):7-8.
[21] Ma R,Kaundun S S,Tranel P J,et al.Distinct detoxification mechanisms confer resistance to mesotrione and atrazine in a population of waterhemp[J].Plant physiol,2013,163(1):363-377.
[22] 李健,李美,高兴祥.杂草抗药性及其机理研究进展[J].山东农业科学,2016,48(12):165-170.
[23] Timmerman K P.Molecular characterization of corn GST isozymes involved in herbicide detoxication[J].Physiol Planta,1989,77:465-471.
[24] 陈秀华,王臻昱,李先平,等.谷胱甘肽S-转移酶的研究进展[J].东北农业大学学报,2013,44(1):149-153.
[25] 陈以峰,李宜慰,汤日圣,等.乙酸乳酸合酶活性的简易测定方法建立[J].江西农业大学学报,1996,18(2):214-217.
[26] Giannopolitis C N,Ries S K.Superoxide dismutasesⅡ.Purification and quantitative relationship with water-soluble protein in seedlings[J].Plant Physiol,1977,59(2):315-318.
[27] 郝再彬,苍晶,徐仲.植物生理实验技术[M].哈尔滨:哈尔滨出版社,2002.
[28] Ellman G L.Tissue sulfhydryl groups[J].Arch Biochem Biophys,1959,82(1):70-77.
[29] Dean J V,Gronwald J W,Eberlein C V.Induction of glutathione S-transferase isozymes in sorghum by herbicide antidotes[J].Plant Physiology,1990,92(2):467-473.
[30] Eckhardt U,Grimm B,Hörtensteiner S.Recent advances inchlorophyll biosynthesis and break down in higher plants[J].Plant Mol biol,2004,56(1):1-14.
[31] 张红刚,郭平毅,原向阳,等.除草剂对黄芩叶片光合特性及叶绿素荧光参数的影响[J].山西农业大学学报:自然科学版,2011,31(6):522-528.
[32] 王健,钟雪梅,吕香玲,等.不同品种玉米对烟嘧磺隆的耐药性研究进展[J].农药学学报,2016,18(3):282-290.
[33] 孙秀荣,吴忠信,郭桂清.10%烟嘧磺隆防除春玉米田杂草试验[J].植物医生,2015,28(6):21-22.
[34] 姜孝玉,梅星元,袁均林,等.2,4-D对水稻幼苗过氧化物酶、超氧化物歧化酶活性及同工酶的影响[J].华中师范大学学报:自然科学版,1998,32(2):79-82.
[35] 刘伟,邱银清,侯任昭.谷胱甘肽转移酶与植物对除草剂的抗性[J].世界农业,1997(1):43-44.
[36] 裴冬丽.谷胱甘肽还原酶在植物防御中的研究进展[J].中国农学通报,2012,28(18):185-188.
[37] Gronwald J W,Parker W B,Somers D A,et al.Selection for tolerance to graminicide herbicides in corn tissue[C].Brighton Crop Protection Conference-Weeds,1989.
[38] 郭玉莲,陶波,郑铁军,等.植物谷胱甘肽S-转移酶(GSTs)及除草剂解毒剂的诱导作用[J].东北农业大学学报,2008,39(7):136-139.

