大豆TST基因的生物信息学及表达模式分析
李文滨,张永艳,王金阳,徐玲秀,宋 伟,赵 雪,韩英鹏
(东北农业大学大豆研究所,哈尔滨 150030)
糖(Sucrose)为光合作用主要产物,为植物生长发育提供碳架与能量[1],影响植物产量。大豆产量为多基因控制复杂性状,存在明显环境互作效应,传统生理与遗传学研究方法难以分析其遗传本质与调控机制,进一步明确复杂糖代谢和糖转运基因网络中决定大豆糖积累的关键基因,可为大豆品质改良提供理论指导,为探索作物光合产物积累与转运分子机制奠定基础,具有重要理论意义与实用价值。在大豆生长发育过程中,蔗糖为主要光合产物,其含量影响花、荚形成,决定全株籽粒重和籽粒饱满程度[2-3]。植物中糖运输主要由糖转运蛋白(Sugar transporter)介导,目前已在水稻、玉米等作物中发现多个糖转运蛋白[4]。糖转运蛋白可介导糖在韧皮部长距离运输,叶脉、根、种子、果实、胚及花粉中均有分布,对作物生物学和经济学产量影响较大[5-6]。其中液泡膜糖转运蛋白TST(Tonoplast sugar transporter)主要负责将糖从胞质中跨膜转运至液泡,定位于液泡膜上,TST基因具有单糖和二糖转运功能。在TST基因蛋白结构中,第6和7跨膜区中间有1个长亲水环位于胞质,该环为糖感应器[7]。目前其功能和特性研究主要集中于拟南芥、甜菜西瓜和苹果等作物。拟南芥中存在3个同源基因,其中AtTST1和AtTST2表达量较高,在糖高度积累花粉中表达量最高[8]。AtTST1、AtTST2敲除突变显著降低液泡中Glu、Fru、Suc积累[8-9]及拟南芥生物产量;AtTST1过量表达,可提高生物量,增加种子产量[9]。甜菜中TST2是蔗糖特定转运因子[10],质子转运体,耦合蔗糖在液泡中大量积累,可提高产量。在其他作物中,TST基因表达量与含糖量正相关,TST基因表达丰度可调控其产量或品质[11-12]。结果表明,TST为液泡膜上负责糖转运关键蛋白并对作物产量具有重要影响。
目前在基因组水平上大豆GmTST基因家族的生物信息学分析及功能研究尚未见报道。本文从调控源到库关系角度,利用已公布大豆基因组序列信息,采用生物信息学方法,在基因组水平上预测GmTST基因,通过序列分析、进化分析、组织表达特异性分析及表达模式分析等,为进一步研究GmTST基因功能提供参考及理论依据。
1 材料与方法
1.1 材料
1.1.1 试验材料
植物材料为大豆willimas82,由东北农业大学大豆生物学重点实验室提供。
1.1.2 生物信息来源
其他信息来源为美国生物国立信息中心(http://www.ncbi.nlm.nih.gov/)(NCBI)核酸数据库中注册拟南芥(Arabidopsis thaliana)、甜菜(Beta vulgaris)TST氨基酸序列、其GenBank Accession分别为:拟南芥TST1(NM_101937);拟南芥TST2(NM_001342 340);甜菜(XM_010680330)。
1.1.3 引物
利用Primer Exprexx软件设计引物,由哈尔滨博士生物工程公司合成,克隆引物为:正向5'-CCATGGGATTACGAAACTAACTGAAACG-3',反向5'-GGTTACCGAATTTATCATGTCCTTGGG-3',对应酶切位点分别为CCATGG,GGTTAC。实时定量基因、内参基因所用引物序列见表1。
1.1.4 主要试剂
植物RNA提取试剂盒购自Omega公司;反转录试剂盒购自上海捷瑞生物工程有限公司;Taq DNA聚合酶、DNA marker、Trizol reagent、T4 DNA连接酶、pGEM-T Easy Vector T克隆试剂盒均购自Thermo Fisher Scientific公司;DNA纯化回收试剂盒购自omega公司。

表1 基因及PCR引物序列信息Table1 Information of genes and Primer sequence
1.1.5 质粒与菌种
大肠杆菌trans-t1感受态购自全式金公司,pGEM-T Easy购自TaKaRa公司。
1.1.6 测序
基因测序由哈尔滨博士生物工程公司完成。
1.2 方法
1.2.1 大豆TST及其同源基因系统发育分析
在Phytozome网站(Version 12.0)使用BLAST工具,分别在NCBI网站检索拟南芥TST1、TST2和甜菜TST2蛋白序列,BLASTp查找大豆TST基因,同时将检索蛋白序列后续分析。应用MEGA[13]构建双子叶模式植物拟南芥(Arabidopsis thaliana)、大豆(Glycine max(L.)Merr)、甜菜(Beta vulgaris)进化树,检验Bootstrap(参数设为1 000)系统发生树。
1.2.2 大豆TST基因组织特异性表达
分别取william82真叶期与三出期各部位、花及R4-R8期果,液氮研磨后按照试剂盒方法提取各处理样品总RNA,采用1.5%琼脂糖凝胶电泳检测和NanoDrop®Lite紫外分光光度计联合检测RNA浓度,纯度合格后按说明书将RNA反转录成cDNA,通过正向引物F(5'GTGTCAGCCATACTGTCCCC ATT 3')和反向引物 R(5'GTTTCAAGCTCT TGCT CGTAATCA 3')扩增大豆Actin基因检验cDNA质量。设计大豆TST基因荧光定量引物并检测引物特异性。
荧光定量PCR检测法反应体系参考试剂盒使用说明书。本试验采用三步法PCR扩增程序,PCR程序包括:预变性95℃15 min,95℃10 s,60℃20 s,72℃20 s,40个循环。被测基因PCR产物相对丰度采用内参基因法,对于相对定量ΔΔCT方法,CT值由3次试验重复取平均数,相对拷贝数由 2-ΔΔCT计算得到(ΔΔCT=CT目的基因-CT内参Actin基因)。
1.2.3 GmTST2.1基因克隆
根据定量结果挑选主拷贝基因序列设计一对包括起始密码和终止密码的5'端及3'端引物,引入合适酶切位点。克隆PCR反应体系参考试剂盒说明书。PCR反应条件为94℃预变性10 min,94℃变性30 s,58℃复性30 s,72℃延伸30 s,扩增适当次数;72℃延伸10 min,置于4℃保存。回收PCR产物,参照试剂盒说明书将回收产物与pGEM-T easy载体连接过夜,连接体系10 μL:1 μL pGEM-T easyVector,1 μL T4 DNA Ligase,1 μL 10×T4 DNA Ligase buffer,5 μL PCR 产物,2 μL 去离子水。连接产物转化大肠杆菌trans-t1,在LB固体培养基上筛选,LB固体培养基含Kan抗性。选取阳性菌株用于基因测序。
1.2.4 GmTST2.1生物信息分析及功能预测
应用 ProtParam(http://web.expasy.org/protparam/)在线工具分析氨基酸序列理化性质[14-16]。利用ProtScale(http://web.expasy.org/protscale/)工 具 中Hphob./Kyte&Doolittle算法分析氨基酸序列亲水性与疏水性。蛋白质跨膜结构预测:http://www.cbs.dtu.dk/services/TMHMM/;蛋白质的信号肽预测:http://www.cbs.dtu.dk/ser-vices/SignalP/;蛋白质二级结构预测:SOPM(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html);使用 http://swissmodel.expasy.org/在线工具[17-18],以willimas82的TST2.1蛋白氨基酸序列为模板,预测TST2.1基因编码蛋白质三级结构。
2 结果与分析
2.1 大豆TST基因分子进化分析
根据拟南芥、甜菜TST蛋白氨基酸序列在大豆数据库中BLAST检索、筛选,共得到10个大豆同源TST基因,在数据库(Phytozome Version12.0)中上述基因被注释为主要转录产物转录本并作后续分析[19-20],构建大豆、拟南芥、甜菜3个物种进化树(见图1)。大豆基因TST与拟南芥亲缘较近。Glyma 06G015000和Glyma04G015000两个基因高度同源,Glyma01G015730和Glyma11G087700两个基因高度同源,Glyma02G311700和Glyma14G000900两个基因高度同源。
2.2 大豆TST基因组织特异性表达分析
大豆品种willimas82作为试验材料,actin作内参基因荧光定量PCR扩增,根据进化树分析结果,本试验在与拟南芥、甜菜同源性较近基因中同源性为100%的Glyma06G015000和Glyma04G0 15000、Glyma02G311700和Glyma14G000900、Glyma 01G157300和Glyma11G087700及同源性为99%的两个基因中各选1个基因和Glyma16G112500作表达量模式分析。各基因分别为GmTST2.1(Glyma 04G000300)、GmTST2.2(Glyma02G311700)、GmTST2.3(Glyma06G015000)、GmTST3.1(Glyma16G1125 00)、GmTST3.2(Glyma01G157300)。

图1 拟南芥、甜菜和大豆3个物种的TST蛋白系统进化树Fig.1 TST protein phylogenetic tree of Arabidopsis thaliana,beet and soybean three species
2.2.1 大豆TST基因在大豆生育期时期相对表达
5个GmTST基因在大豆不同生育期时期相对表达量变化情况见图2。
结果表明,在大豆生长发育不同时期GmTST基因表达量差异显著,普遍表现为花中表达量最高,下胚轴/茎中表达量最低。大豆生长发育过程中GmTST2.1基因在大豆不同组织器官中表达量依次为:花>子叶>叶>叶柄>根>种子>顶芽>茎>下胚轴,其中花中表达量为下胚轴中表达量67倍(见图2A)。GmTST2.2基因在大豆不同生长发育时期表达量在子叶中表达量最高,茎表达量最低,子叶中表达量为茎表达量242倍;GmTST2.2基因在大豆不同组织器官中均有表达,表达量依次为:子叶>花>叶>根>叶柄>种子>顶芽>下胚轴>茎;大豆生长发育过程中相同组织器官在真叶期和三出期茎、下胚轴和顶芽表达量无显著差异,子叶、花与其他组织表达量差异显著(见图2B)。GmTST2.3基因在大豆不同组织器官中表达量依次为:花>叶柄>根>子叶>叶>顶芽>茎>种子>下胚轴,其花中表达量最高,表达量最低为下胚轴,花中表达量为下胚轴中表达量121倍;大豆TST2.3基因在大豆生长发育过程中,相同组织器官在真叶期和三出期下胚轴无显著差异,花与其他组织中表达量差异显著(见图2C)。图2D为GmTST3.1基因在大豆不同生育期时期相对表达量变化情况。在大豆生长发育不同时期,GmTST3.1基因在除花以外其他组织中表达量普遍较低,茎中表达量最低,花中表达量为茎484倍;TST3.1基因在大豆不同组织器官中均有表达,表达量依次为:花>子叶>根>叶柄≥叶>种子>顶芽>下胚轴>茎;大豆生长发育过程中,相同组织器官在真叶期和三出期无显著差异,花与其他组织表达量差异显著。图2E为GmTST3.2基因在大豆生育期时期相对表达量变化情况,在大豆生长发育不同时期GmTST3.2基因表达量不同,具体表现为叶中表达量最高,茎中表达量最低,叶中表达量为茎118倍;TST3.2基因在大豆不同组织器官中均有表达,其表达量依次为:叶>花>种>叶柄>顶芽>子叶≥根>下胚轴>茎;大豆生长发育过程中,TST3.2基因在真叶期和三出期叶组织器官差异显著,花、叶中表达量较其他组织差异显著。
2.2.2 TST基因在大豆生殖期表达量变化
GmTST基因在大豆生育期时期相对表达量变化情况见图3。
由图3可知,大豆生殖生长发育过程中,基因表达量呈先降再升最后急剧下降趋势;在大豆生殖生长发育不同时期TST基因表达量不同,R4期基因表达量开始下降,R5~R6期表达水平较低且稳定,R6~R7期表达量开始上升,可能为糖在大豆种子中大量积累时期,R7~R8期基因表达量急剧下降,主要将大豆中糖转换为蛋白质、脂肪及其他物质;整体水平为TST2.1表达量相对较高。

图2 5个GmTST基因在大豆生育期时期相对表达量变化情况Fig.2 Change of relative expression of five GmTST gene during soybean growth period
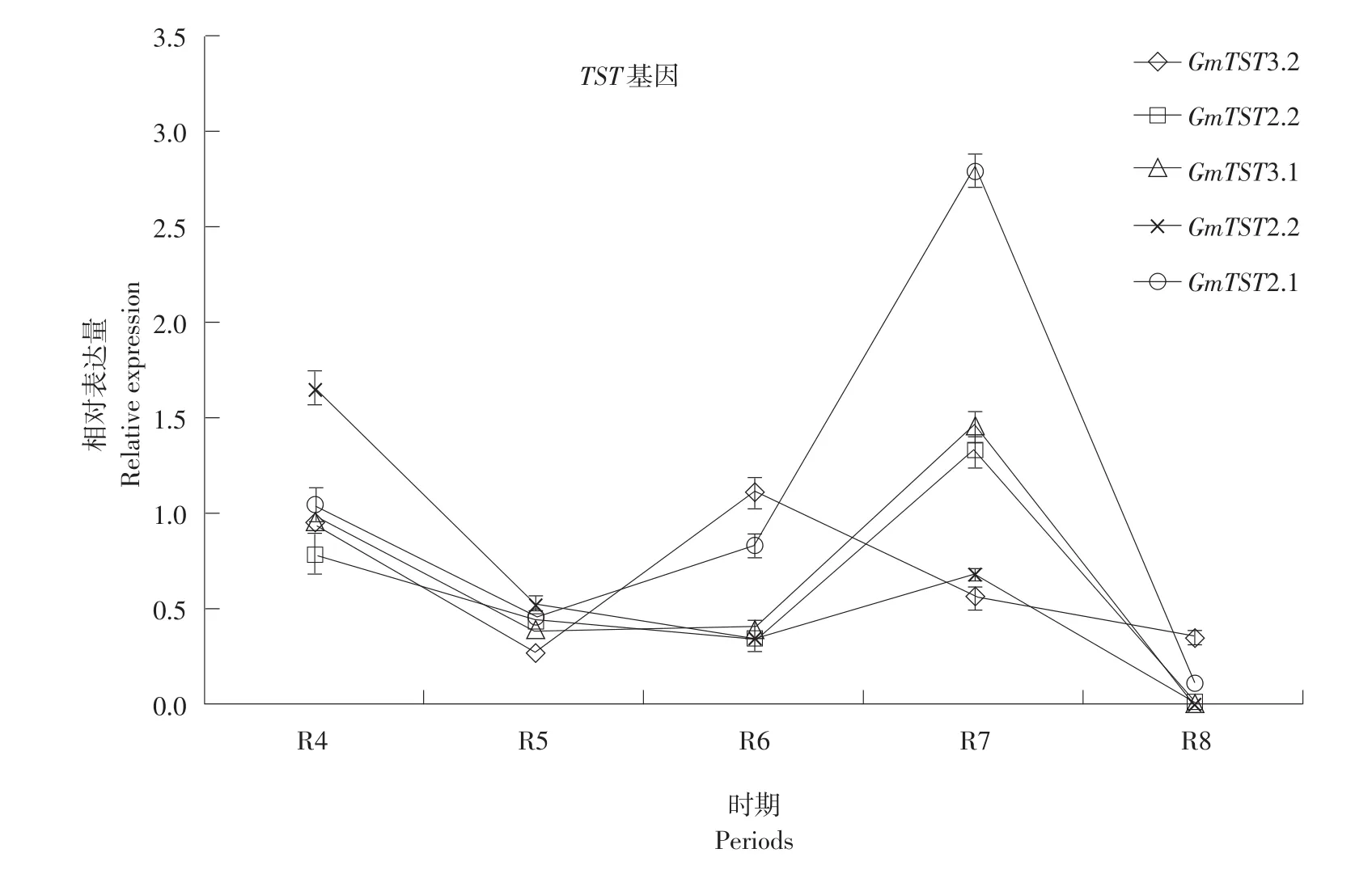
图3 5个GmTST基因在大豆生殖时期相对表达量变化情况Fig.3 Relative expression of five GmTST genes in soybean reproductive period
2.3 GmTST2.1基因的克隆、生物信息分析及功能预测
2.3.1 GmTST2.1基因克隆
以Trisol方法提取RNA,去除杂质[21]。willimas82叶片提取总RNA,反转录后PCR扩增,经1%琼脂糖凝胶电泳检测,得到长度为2 260 bp大豆TST2.1基因cDNA全长序列(见图4)。将目的基因回收转化后,挑取正确克隆测序,测序结果与NCBI数据库中目的序列比对,测序基因与目的序列相似度均为100%。

图4 RNA和PCR产物电泳结果Fig.4 Electrophoresis of RNA and production of PCR
2.3.2 GmTST2.1基因生物信息分析及功能预测
为进一步确定大豆TST2.1蛋白质理化性质,分析预测编码氨基酸组成及理化性质。表明willimas 82TST2.1基因CDS区共编码734个氨基酸,氨基酸相对分子质量为78 721.36,理论等电点为5.1,总原子数为11 167,分子式为C3559H5634N912O1029S33。TST基因编码肽链含有20种氨基酸,其中Leu含量最多为94个,占该基因编码氨基酸总数12.80%;Cys和His酸含量最少,各9个,各占该基因编码氨基酸总数1.20%。该蛋白质不稳定系数为41.53,说明此蛋白质为不稳定蛋白[22];脂溶指数为107.04,GRAVY值为0.346,说明此蛋白为疏水性蛋白质。用Hphob./Kyte&Doolittle算法分析氨基酸序列亲水性与疏水性(见图5),负分值氨基酸少于正分值氨基酸,即亲水性小于疏水性,表明该蛋白为疏水性蛋白。利用TMHMM Server v.预测该基因编码蛋白质跨膜结构,结果如图6所示,GmTST2.1蛋白结构特点为两端各含有一1个疏水区和1个中间亲水区,疏水区由6个跨膜折叠组成。GmTST2.1编码蛋白有典型N端跨膜结构域-中间胞质区-C端跨膜区结构域特征,中间胞质区长度约为250个氨基酸。

图5 肽链中疏水性与亲水性氨基酸位置分布Fig.5 Hydrophobic and hydrophilic amino acids in peptide chains

图6 GmTST2.1基因编码蛋白质的跨膜结构特征预测Fig.6 Prediction of transmembrane structural characterization of GmTST2.1 gene encoding proteins
使用SOPMA与PSIPRED V3.3工具分析蛋白质二级结构(见图7),结果表明,willimas82 TST2.1蛋白质主要由α-螺旋、无规则卷曲和片层结构组成,其中α-螺旋占比约为34.47%,片层结构约占22.62%,β-转角约占10.08%,无规则卷曲约占32.83%。通过SWISS-MODEL在线软件,预测其三级结构,结果与二级结构预测结果基本一致,进一步验证该蛋白结构(见图8)。
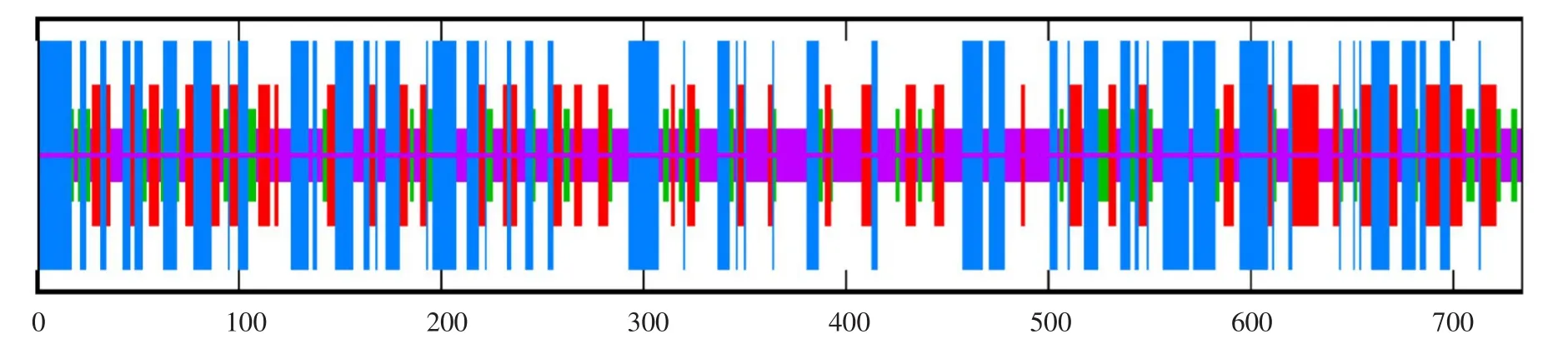
图7 GmTST2.1蛋白质二级结构Fig.7 Secondary structure of GmTST2.1 protein

图8 GmTST2.1蛋白质三级结构预测Fig.8 Three-dimensional structure prediction of GmTST2.1 protein
3 讨论与结论
生物信息学是全基因组数据分析有效工具,广泛应用于多个基因家族鉴定、基因结构分析与功能预测。本研究在大豆基因组相关网站中鉴定10个大豆同源TST基因。通过进化树分析大豆、拟南芥和甜菜3个物种蛋白,结果显示8个TST基因与拟南芥、甜菜TST基因同源性较近,其中大部分大豆TST和拟南芥TST基因亲缘关系更近,与同为双子叶植物亲缘关系相符[23]。
GmTST基因分析大豆不同生育期不同组织表达模式结果表明,TST基因在各时期各部位表达量均不同且差异显著,普遍表现为花器官中表达量较高,茎和下胚轴中表达量较低,与Wormit等[8]、李冬霞[11]研究结果一致。在大豆生殖生长时期,随着大豆籽粒发育,其糖含量呈先升后降趋势,与侯金锋[24]研究结果一致。各基因表达量在R6~R7期达最大值,推测此时为大豆储存糖最多且决定产量时期[2]。在TST基因整体表达水平上,GmTST2.1表达量高于其他4个基因,说明GmTST2.1在大豆TST基因中发挥重要作用。通过基因克隆获得大豆TST2.1基因并测序确定其核昔酸序列。生物信息学工具分析GmTST2.1基因理化性质、氨基酸亲疏水性、蛋白结构等,发现GmTST2.1基因编码734个氨基酸,为等电点5.1不稳定蛋白,其蛋白结构特点为两端各含一个疏水区和一个中间亲水区,疏水区由6个跨膜折叠组成,有典型N端跨膜结构域-中间胞质区-C端跨膜区结构域特征,与拟南芥[8]、苹果[25]和葡萄[26]等植物预测TST蛋白跨膜区为11,氨基酸长度大于700一致,推测该蛋白与拟南芥、甜菜等中TST蛋白功能类似,在调节控制产量方面具有重要作用。本研究结果为大豆高产基因工程研究提供重要基因资源,为深入研究TST基因参与糖转运分子机理提供依据。克隆获得GmTST2.1基因,对开展大豆新品种分子育种研究具有参考价值。
[1] 戚继艳,阳江华,唐朝荣.植物蔗糖转运蛋白的基因与功能[J].植物学通报,2007,24(4):532-543.
[2] 苗以农.大豆产量的形成和光合作用[J].植物生理学通讯,1997,(6):468.
[3] 刘长锴,李彦生,涂冰洁,等.钾肥施用对菜用大豆生殖生长期可溶性糖含量及产量的影响[J].大豆科学,2016,35(2):270-274.
[4] Mamun E A,Alfred S,Cantrill L C,et al.Effects of chilling on male gametophyte development in rice[J].Cell Biology International,2006,30(7):583-591.
[5] Riesmeier J W,Willmitzer L,Frommer W B.Evidence for an essential role of the sucrose transporter in phloem loading and assimilate partitioning[J].The EMBO Journal,1994,13(1):1-7.
[6] Gottwald J R,Krysan P J,Young J C,et al.Genetic evidence for the in planta role of phloem-specific plasma membrane sucrose transporters[J].Proceedings of the National Academy of Sciences of the United States of America,2000,97(25):13979-13984.
[7] Linka N,Weber A P M.Intracellular metabolite transporters in plants[J].Molecular Plant,2010,31:21-53.
[8] Wormit A,Trentmann O,Feifer I,et al.Molecular identification and physiologicl characterization of a novel monosaccharide transporter from Arabidopsis involved in vacuolar sugar transport[J].Plant Cell,2006,18(12):3476-3490.
[9] Wingenter K,Schulz A,Wormit A,et al.Increased activity of the vacuolar monosaccharide transporter TMT1 alters cellular sugar partitioning,sugar signaling,and seed yield in Arabidopsis[J].Plant Physiol,2010,15:665-677.
[10] Jung B,Ludewig F,Schulz A,et al.Identification of the transporter responsible for sucrose accumulation in sugar beet taproots[J].Nature Plants,2015,1(1):14001.
[11] 李冬霞.苹果果糖积累相关基因MdTSTl和MdFK2启动子功能鉴定及其转录因子筛选[D].杨凌:西北农林科技大学,2016.
[12] 任毅.西瓜果实含糖量QTL定位及糖转运蛋白基因功能初析[D].北京:中国农业科学院,2016.
[13] 朱延明,朱毅,端木慧子,等.大豆GmUGD基因家族生物信息学分析[J].东北农业大学学报,2015,46(9):23-29.
[14] Gasteiger E,Hoogland C,Gattiker A,et al.Protein identification and analysis tools on the ExPASy server[M].Clifton:Humana Press,2005:571-607.
[15] 赵艳,翟莹,宫国强,等.大豆PM34基因生物信息学预测及表达分析[J].广西植物,2016,36(10):1220-1224.
[16] 于以成,潘校成,徐梦洁,等.大豆再生相关基因GmRUB1的克隆及表达分析[J].基因组学与应用生物学,2016,35(12):3465-3473.
[17] 武小霞,王敏,陈庆山,等.大豆再生相关基因GmLEC的克隆及生物信息学分析[J].东北农业大学学报,2015,46(4):1-9.
[18] Kushwaha H,Gupta S,Singh V K,et al.In silico characterization and prediction of three dimensional structure of SbDofl,SbDof19,SbDof23 and SbDof24 proteins from Sorghum[Sorghum bicolor(L)Moench][J].Molecular Biotechnol,2013,54(1):1-12
[19] Paterson A H,Wang X,Tang H,et al Synteny and genomic rearrangements[J].Plant Genome Diversity,2012,1:95~207.
[20] 李朋朋,叶嘉,付伟,等.梨PbChiⅡ基因的克隆及荧光定量表达分析[J].北方园艺,2017,(17):52-60.
[21] 王勇,韦贺远,刘彬昕,等.洋葱成花素同源基因AcLFT3的克隆与表达分析[J].东北农业大学学报,2014,45(9):40-46.
[22] Guruprasad K,Reddy B V B,Pandit M W.Correlation between stability of a protein and its dipeptide composition:A novel approach for predicting in vivo stability of a protein from its primary sequence[J].Protein Eng,1990,4(2):155-161.
[23] 王茂,石永春,刘全军,等.不同烟草中谷氨酰胺合成酶2基因的生物信息学分析[J].生物技术通讯,2009,20(2):199-201.
[24] 侯金锋.大豆鲜籽粒蔗糖含量的研究及糖代谢相关基因的克隆与功能分析[D].南京:南京农业大学,2012.
[25] 马新立.苹果MdTMTs基因的表达分析、克隆及其功能的初步鉴定[D].杨凌:西北农林科技大学,2014.
[26] Afoufa-Bastien D,Medici A,Jeauffre J,et al.The Vitis vinifera sugar transporter gene family:Phylogenetic overview and macroarray expression profiling[J].BMC Plant Biology,2010(10):22.

