基于环介导等温扩增技术快速检测茶白星病菌的方法研究
周凌云,刘红艳,李 维,向 芬,曾 振,王振中
(1.湖南省农业科学院 茶叶研究所,湖南 长沙410125;2.华南农业大学 农学院,广东 广州 510642)
茶白星病(Tea white scab)是全球高海拔茶园最严重的真菌病害之一。生产上通常采用多菌灵等化学农药对该病进行防控,因发病期常为多雨季节,不但防效不佳,杀菌剂的过量使用往往导致茶叶农残超标。茶白星病在日本、韩国等地分别报道其病原为痂囊腔菌E.leucospila(无性阶段为黑盘孢菌Sphaceloma.theae)[1-3]。2000年,Notomi等建立了一种非常实用而又有效的核酸扩增技术——环介导等温扩增(loop-mediated isothermal amplification,简称LAMP)[4]。LAMP通过针对靶基因的6个特异部位设定4种引物,利用具有链置换活性的Bst DNA 聚合酶在恒温条件下催化新链合成,从而使靶基因高效扩增,产生副产物焦磷酸镁形成乳白色沉淀,加入染色剂即可通过颜色变化观察判定结果。本文以痂囊腔菌基因为靶基因,利用LAMP技术扩增靶基因,设计引物,优化反应条件,建立了一个茶白星病菌快速LAMP检测方法。
1 材料与方法
1.1 试验菌株
痂囊腔菌分离自湖南省石门县白云山林场茶园的茶白星病叶,由本实验室分离并保存。
1.2 试 剂
Loopamp®“朗报®”脱氧核糖核酸扩增试剂盒与Loopamp®“朗报®”荧光目视检测试剂盒均购自北京蓝谱生物科技有限公司,真菌DNA抽提试剂盒购自天根生化科技(北京)有限公司。
1.3 LAMP 法的建立
采用真菌试剂盒抽提痂囊腔菌,将LAMP反应体系(引物、模板DNA、Bst DNA聚合酶、dNTP和缓冲液) 在95℃加热5 min后冷却,再加入 8 U Bst DNA 聚酶,在 60℃保温 60 min,然后在高于80℃的温度下10 min使Bst DNA聚酶失活终止反应。反应液混合后观察离心管中反应液颜色,如发生特异性扩增,直接目视或在紫外灯下观察,溶液均变为绿色,否则保持SYBR Green 橙色不变。
1.3.1 LAMP引物的筛选
参照GenBank中E.leucospila(无性阶段为S.theae)基因序列,应用Clustal W进行多重比对,分析序列的保守区,利用在线设计软件Primer Explorer V 4.0,设计 4 套 LA MP 引物,每套引物均包括2条外引物与2 条内引物,引物由华大基因科技有限公司合成,根据颜色变化及其重复性对引物进行筛选。
1.3.2 LAMP法反应优化
反应温度选取60℃、61℃、62℃、63℃、64℃这5个温度条件进行LAMP反应,实时观察反应颜色。进一步对引物浓度比例、模板浓度和反应时间进行优化。
1.4 LAMP 法结果鉴定
核酸染色法反应结束后,在反应体系中加入荧光染料,于自然光及紫外灯下观察反应结果。
1.4.1 LAMP的敏感性试验
将抽提E.leucospilaDNA模板分别配置成1x10-2~10-54个稀释度,用所建立的LAMP和PCR方法进行灵敏性比对试验。PCR的反应体系:配置成25 μL的反应体系,引物F1(5’-TCCGTAGGTGAACCTGCGG-3’),R1(5’-TCCTCCGCTTATTGATATGC-3’),56℃变性30 s循环35次。
1.4.2 LAMP特异性实验
应用真菌试剂盒抽提痂囊腔菌属和茶炭疽病菌DNA,按照所建立痂囊腔菌LAMP检测方法,进行特异性实验。
2 结果与分析
2.1 引物的筛选
根据S.theae的ITS1序列与E.leucospil的rDNA序列分别设计了4组引物,最后实验明确有效的引物对来自Elsinoe属核糖体DNA的1组特异性引物,分别为外引物1:F3(5’-GGGGACCGAACCAACTCT-3’);外引物2:B3(5’-TGCCCCTCGGAATACCAAG-3’);内引物 1:FIP(5’-GCCAGAACCAAG AGATC CGTTGT-TCTTGTGAAACCTTTGCA GTC-3’);内引物2:BIP(5’-TGAA GAACGCAGC GAAATGCG-GCGCAATGTGCG TTCAA-3’)。
2.2 反应条件的优化结果
反应体系:反应缓冲液12.5 μL,其中FIP:30 pmol,BIP:30 pmol,F3:10 pmol,B3:10 pmol,BstDNA 聚合酶 1 μL,加去离子水 ddH2O成23 μL。其中反应缓冲液组成:Tris-HCl(pH8.8):40 mM,KCl:20 mM,MgSO4:16 mM,(NH4)2SO4:20 mM,Tween20:0.2%,Betaine:1.6 M,dNTPs:2.8 mM。
反应条件:63℃反应l h后立即于80℃金属水浴锅10 min使酶灭活。荧光目视检测时,向预混溶液中添加Loopamp®“朗报®”荧光目视检测试剂,以便肉眼观察是否检出E.leucospil。
2.3 特异性实验
利用已建立的LAMP检测方法,以痂囊腔菌与茶炭疽病菌(Gloeosporium theae sinensis Miyake)为模板进行特异性试验。荧光目视与紫外灯检测结果均表明,与阳性对照呈色一致的为痂囊腔菌,茶炭疽病菌呈色与阴性对照相同,初步确定本方法设计的引物对痂囊腔菌具有专一性(图1)。
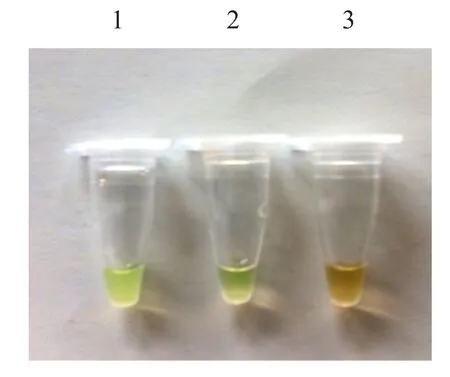
图1-A 特异性实验的荧光目视检测结果(1为阳性对照,2为痂囊腔菌,3为阴性对照)Fig.1-A specificity of the experimental result of the fluorescence visual detection

图1-B 特异性实验的紫外检测结果(1为阳性对照,2为茶炭疽病,3为阴性对照)Fig.1-B specificity of the experimental results of the ultraviolet detection
2.4 灵敏度实验
利用已建立的LAMP检测方法,以稀释成 10-2、10-3、10-4、10-5的痂囊腔菌 DNA 为模板,以PCR作为对照,结果发现,1-4号管反应液颜色为绿色,LAMP能扩增出10-5痂囊腔菌DNA模板,而PCR的扩增浓度限于10-4痂囊腔菌DNA,从而明确LAMP法在灵敏度上高于PCR10倍(图2)。

图2-A 灵敏度实验的显色法检测结果Fig.2-A sensitivity test results of the color detection method
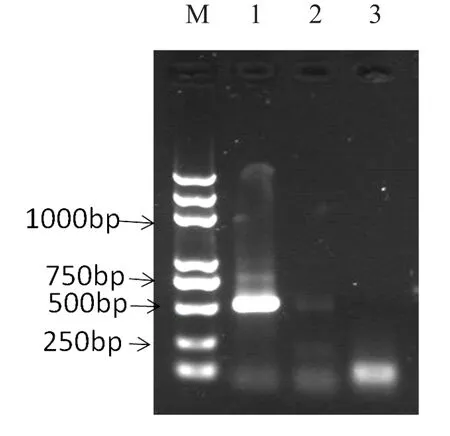
图2-B 灵敏度实验的电泳法检测结果Fig.2-B Sensitivity test results of electrophoresis detection method
3 结 论
本文通过设计、筛选引物与优化反应建立了痂囊腔菌的LAMP检测方法,为茶树病菌快速检测构建了一个技术平台。植物病害如灰葡萄孢菌、镰刀菌等病菌的鉴定上逐渐采用LAMP方法替代[5-9]。LAMP法较PCR法更加简便快速,从DNA提取、LAMP反应到结果观察只需2 h即可完成,比目前普遍采用的PCR检测方法缩短一倍的时间,而且灵敏度提高10倍,特异性强,仪器要求简单,一个水浴锅即可完成,观察简单易行,加入了荧光染色剂,在日光下即可清晰直观反应结果,具有对低浓度菌致病早期鉴定的价值,适宜实验室与基层田间使用。
但本研究通过LAMP快速检测的痂囊腔菌属,仅限于分离菌抽提DNA为模板,尚需要优化病叶直接抽提DNA,进行LAMP技术需进一步优化以适合于各种现场应用场合。其次,由于LAMP只需少量模板,即可获得大量特异性扩增产物,应避免局域环境被这些产物污染,除了提高操作的速度与严密性,需进一步优化反应材料,加强茶白星病快速检测和鉴定水平。
[1]高屋茂雄,福田德治,大池康子.病斑における茶白星病Elsinoe leucospila の分生孢子形成れ[J].茶技研,1975(49):71-77.
[2]陈宗懋,陈雪芬 .茶树病害的诊断与防治[M].上海 :上海科技出版社,1989.
[3]박서지 .차나무의병해 II.phaceloma theae 에의한차흰별무늬병 .식물병리학회지,1995,11(4): 383-385.
[4]Notomi T,Okayama H,Masubuehi H,et a1.Loop-mediated isothermal amplification of DNA[J].Nucleic Acids Res,2000,28 (12): 63.
[5]Duan Y B,Ge C Y,Zhang X K,et a1.Development and evaluation of a novel and rapid detection assay for Botrytis cinerea based on loop-mediated isotheral amplification[J].PLoS ONE,2014(9): el11094.
[6]Liu S M,Duan Y B,Ge C Y,et a1.Functional analysis of the 132-tubulin gee of Fusarium graminearum and the 3-tubulin gene of Botrytis cinerea by homologous replacement[J].Pest Management Science,2013(69): 582-588.
[7]Niessen L,Vogel R F.Detection of Fusarium graminearum DNA using a loop-mediated isothermal amplification(LAMP)assay[J].International Journa l of Food Microbiology,2010(140): 183-191.
[8]Niu J H,Jia n H,Gun Q x,et a1.Evaluation of loop-mediated isothermal amplification(LAMP) assays based on 5S rDNA.IGS2 regions for detecting Meloidogyne enterolobii[J].Plant Pathology,2012(61): 809-819.
[9]Hara-Kudo Y,Yoshino M,Kojima T,et a1.Loop-mediated isothermal amplification for the rapid detection of Salmonella[J].FEMS microbiology letters,2005,253(1): 155-161.

