茶炭疽病拮抗放线菌的分离筛选与鉴定
刘红艳,李 维,向 芬,周 琳,丁 玎,曾 振,周凌云
(湖南省农业科学院 茶叶研究所,湖南 长沙 410125)
茶炭疽病(Gloeosporium theae sinesisMiyake)是我国茶园一种重要真菌病害,该病在全国各茶区普遍发生,主要危害茶树的叶部,一般从幼龄叶片背部的毛孔侵入,经8~15 d潜伏期后开始形成病斑,遇到温暖湿润时易造成该病大面积的爆发流行,茶叶产量和品质下降,造成严重的经济损失,严重阻碍茶产业的发展[1-2]。目前茶炭疽病的防治除农业防治外,主要依靠化学药剂,造成环境污染和农残一系列的问题,这些问题已经引起国内外有关专家的高度关注[3-4]。因此加快新型农药研制与采用拮抗微生物来防治茶树炭疽病非常必要。
放线菌是具有巨大实用价值的一类微生物,是抗生素的主要生产菌,是新农药和生物防治活菌剂研制的主要源头[5]。利用放线菌的次生代谢产物——抗生素制备的生物农药,由于其具有无污染、无残留、可再生、难以使有害生物产生抗药性、易于产业化、成本低等特点,目前已成为无公害农药的主体和未来农药的发展方向[6]。通过分离筛选与利用拮抗放线菌达到环保、高效的生物防治目的已经成为当前农业科学研究热点之一[7]。本试验从湖南茶园采集的土样中分离筛选的放线菌F2菌株,具有拮抗茶炭疽病的活性,能显著抑制炭疽病菌的生长。结合形态、培养特征、16S rDNA等对其进行了分类鉴定,旨在为进一步防治茶炭疽病提供生防材料。
1 材料与方法
1.1 材料
1.1.1 土壤样品
采自湖南省茶叶研究所长沙高桥试验基地、湘阴县兰岭茶场、长沙县金井茶场有机茶园与常规茶园不同肥力茶园。根据采样地点的地形,采用对角线法5点取土样,每个点取土样量大体一致,取样深度为0~20 cm,均匀混合后将其装入灭菌封口聚乙烯袋,4℃低温保存,待分离。
1.1.2 供试菌株
供试病原菌茶炭疽病菌(Gloeosporium theae sinesisMiyake)由本所植保实验室分离、鉴定和保存。
1.1.3 供试培养基
分离与保存用培养基:高氏合成一号培养基;拮抗试验用培养基:PDA(马铃薯葡萄糖琼脂培养基)。
1.2 方法
1.2.1 土壤放线菌的分离、培养
采用稀释涂布平板法[8]进行放线菌的分离。称取采集的土壤样品10 g,放入装有90 mL无菌水的300 mL玻璃三角瓶中振荡,制得10-1的稀释液,静置1 min后用无菌移液管吸取1 mL的上清液,加入已装有9 mL无菌水的试管中混匀,制得10-2的稀释液,依次制备10-3~10-6稀释液。用无菌移液管吸取稀释液0.1 mL,分别滴加到含有3‰抑菌剂(K2Cr2O7)的高氏合成一号培养基平板上,用无菌玻璃刮刀涂匀,静置30 min后,置于28℃恒温培养箱内倒置培养5~7 d,观察放线菌的出现情况,并将其中的放线菌单菌落挑出,纯化培养,纯化好的菌种转入斜面,4℃条件下冰箱保存备用。采用平板对峙法[5]判断菌株对病原真菌的作用。
1.2.2 茶炭疽病拮抗菌的筛选
采用平板对峙法进行抑菌试验。将病原真菌茶炭疽病菌在PDA培养基上培养5 d,将分离纯化好的各种放线菌在高氏合成一号培养基上涂皿繁殖7 d,用灭菌打孔器(d=5 mm)将放线菌打成圆形的菌饼,并将放线菌菌饼接种于PDA平板的边缘,呈对等的三角形,置28℃下恒温培养,待其定殖后将在PDA平板上培养繁殖5 d的1块直径为5 mm的茶炭疽病菌菌饼,接种于PDA平板的中央,并设空白对照。静置1 h后再放入28℃恒温培养箱中培养,每处理重复3皿,适时检查其菌落周围有无抑菌圈,待对照菌落长满整个培养皿后,测量抑菌圈的直径。
1.2.3 拮抗菌株F2的分类鉴定
形态培养特征观察[8]:肉眼观察划线接种在高氏合成一号琼脂培养基、PDA、酵母精麦芽糖精琼脂培养基(ISP4)平板上,于28℃培养的培养特征;使用高氏合成一号培养基和插片法接种,28 ℃下培养,分别于 7 d、15 d、30 d 将盖玻片取出,在显微镜下观察其菌丝、孢子的形态特征,即分别在 7 d、15 d、30 d 观察记录其菌丝、孢子和可溶性色素的颜色变化,以成熟期的颜色作为其定种依据,显微观察并照相。
16S rDNA的PCR扩增:参照Nikodinovic等[9]和Kauffmann等[10]的方法提取放线菌基因组DNA,采用细菌通用引物:27F 5’-GAGTTTGATCCTGGCTCAG-3,1492R 5’-ACGGCTACCTTGTTACGACTT-3’,以基因组DNA为模板,PCR的扩增:25 μL 反应体系94℃预变性 10 min,94℃变性 1 min,55℃复性 1 min,72℃延伸 1 min,32 个循环,72 ℃延伸 10 min。采用 1.0%的琼脂糖对PCR 扩增产物进行电泳检测。
2 结果与分析
2.1 放线菌的分离筛选及拮抗活性测定
以茶炭疽病菌(Gloeosporium theae sinesisMiyake)为供试病原菌,从湖南茶园土壤中筛选得到了258个放线菌菌落,筛选出6株具有较好拮抗作用的菌株并编号,其中以F2菌株的抑菌效果最好,通过拮抗性初步测定,对茶炭疽病菌的抑菌圈直径达44 mm。
2.2 放线菌F2菌株的分类鉴定
2.2.1 F2菌株的形态培养特征
F2菌株在高氏一号培养基上培养观察,菌落在该培养基表面生长紧密,菌落颜色随着时间的推移逐渐变深 ,即由白色最终变为灰黑色菌落(图1);在PDA上培养观察,可见其产生明显的黄色色素(图2);在ISP4上生长良好,菌落表面由白色变为黑色(图3)。F2菌株在显微镜下观察,气生菌丝和基内菌丝均很丰富,气生菌丝体形成孢子链(图4)。
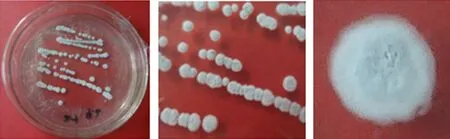
图1 F2菌株的菌落形态特征(高氏合成一号培养基)Fig.1 Colony morphology of strain F2(Gause’s Synthetic Agar Mediu)
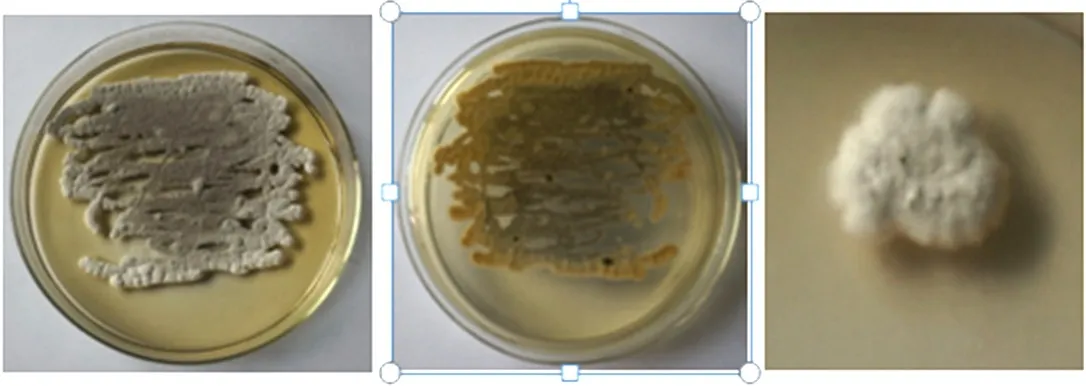
图2 F2菌株的菌落形态特征(PDA)Fig.2 Colony morphology of strain F2(PDA)

图3 F2菌株的菌落形态特征(ISP4)Fig.3 Colony morphology of strain F2(ISP4)
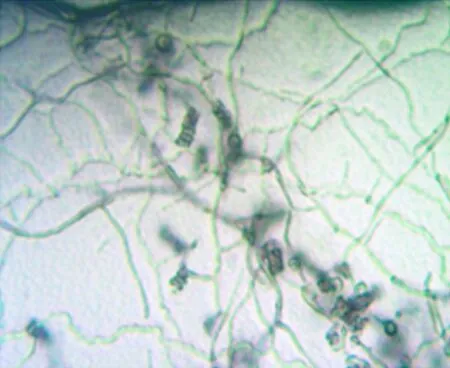
图4 F2菌株显微镜(400X)观察照片Fig.4 Strain F2 microscope(400X) observation photograph
2.2.2 16S rDNA PCR扩增
PCR 扩增结果显示,放线菌株 F2 16S rDNA扩增产物大小在 1500 bp 左右 (图 5)。
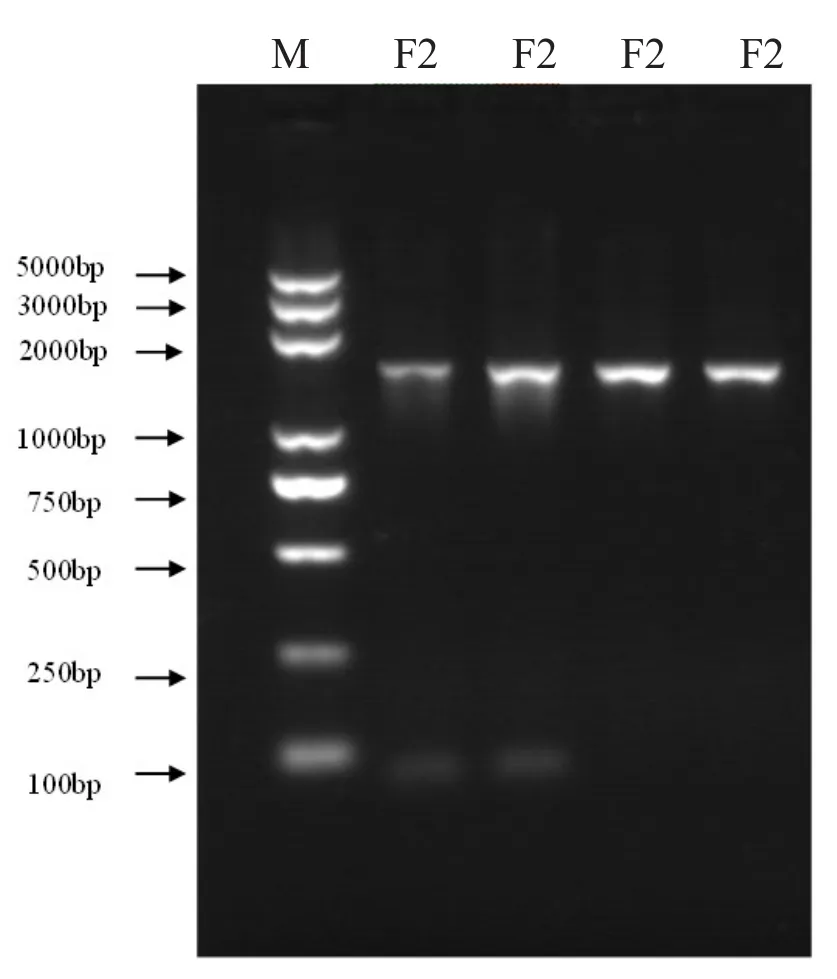
图5 F2 16S rDNA PCR 产物电泳图Fig.5 16S rDNA PCR product electrophoresis images of F2
结合形态学特征、培养特征和分子生物学鉴定特征分析,并参照《链霉菌鉴定手册》[11],F2菌株具有典型的链霉菌属的特征,气生菌丝和基内菌丝均很丰富,气生菌丝体形成孢子链,因此将其初步鉴定为链霉菌属。
3 讨论
分离筛选生防菌、研制生防制剂等是当前防治植物病虫害的一种安全、有效的途径。近年来,分离筛选拮抗放线菌的研究较多,但尚未发现从茶园土壤这一特定的生态环境中筛选拮抗放线菌的报道。作者前期从茶园中分离并筛选到拮抗放线菌,且对茶白星病等病原菌进行了拮抗性筛选试验,具有较好的效果。本研究进一步对茶炭疽病进行筛选试验,其拮抗效果明显。并对具有显著拮抗效果放线菌株F2进行了初步鉴定。这些研究结果为该菌株抗菌活性物质的分离纯化、结构鉴定和拮抗机理的研究奠定了坚实的基础。该菌株的抗菌效果好,具有较强开发潜力,在植病生防方面具有良好的应用前景。因此,有必要进一步扩大对其抗菌谱研究,增强其生防应用价值;对其发酵液中抗菌活性物质进行分离纯化、结构鉴定,并通过盆钵小区试验、田间试验检验其生防效果;对其抗菌机理及最佳发酵条件进行深入研究,进一步开发为生物农药。
[1]谢宝林.茶炭疽病的识别与防治[J].农技服务,2007,24(2):63-63.
[2]刘威.茶树炭疽病的病原鉴定及其遗传多样性分析[D].福建农林大学,2013.
[3]Hyakumachi,M.,Takahashi,H.,Matsubara,Y.,et al.Recent studies on biological control of plant diseases in Japan.Journal of General Plant Pathology[J].2014,80(4): 287-302.
[4]Evangelista-Martinez,Zahaed.Isolation and characterization of soil Streptomyces species as potential biological control agents against fungal plant pathogens.World Journal of Microbiology& Biotechnology[J].2014,30(5): 1639-1647.
[5]安德荣,慕小倩,刘翠娟,等.土壤拮抗放线菌的分离和筛选[J].微生物学杂志,2002,22(5): 1-3.
[6]蒋细良,谢德龄.农用抗生素的作用机理[J].生物防治通报,1994,10(2):76-81.
[7]邱德文.生物农药研究进展与未来展望[J].植物保护,2013,39(5): 81-89.
[8]方中达.植病研究方法.第 3版[M].北京:中国农业出版社,1998.
[9]Nikodinovic J,Barrow E D,Chuck A.High yields preparation of genomic DNA fromStreptomyces[J].BioTechiniques,2003,38(11): 932-936.
[10]Kauffmann I M,Schmitt J,Schmid R D.DNA isolation from soil samples for cloning in different hosts[J].ApplMicrobiol Biotechnol,2004(64): 665-670.
[11]中国科学院微生物研究所放线菌分类组编著.链霉菌鉴定手册.北京:科学出版社,1975.

