IMP3在高龄葡萄胎及侵蚀性葡萄胎孕妇中的表达研究
曹雪霞 张丽娟* 张梅娜 常海丽 杨 敏 赵敏英 董 静 张 娜 宋 洁 刘玉娜 刘 莉 谢祯芳
滋养细胞来源于胚胎的胚外层细胞,早期胎盘的滋养细胞具有许多类似恶性肿瘤的特性,表现为迅速增生并侵蚀子宫内膜。常见的妊娠滋养细胞疾病(gestational trophoblastic diseases,GTD)包括葡萄胎(hydatidiform mole,HM)、侵蚀性葡萄胎(invasive hydatidiform mole,IHM)和绒毛膜癌(choriocarcinoma,CCA),其病理特征为滋养细胞的异常增生[1]。其中HM是妊娠后胎盘绒毛滋养细胞异常增生间质水肿所形成,良性HM主要局限在宫腔,大多数可经清宫治愈;而IHM多继发于HM之后,具有局部浸润和(或)远处转移的能力,是常见的一种妇科滋养细胞肿瘤。
胰岛素样生长因子ⅡmRNA结合蛋白3(insulinlike growth factor ⅡmRNA-binding protein 3,IMP3)是一种癌胚抗原(carcinoembryonic antigen,CEA),是ⅡmRNA结合蛋白家族中的一员[2]。近年来,因其在各种恶性肿瘤的细胞侵袭和粘附中起到重要作用而备受关注。本研究通过分析其在40岁以上HM和IHM患者经联合化疗行子宫切除术术后的表达,了解其在HM恶化进展中的作用和对IHM病情的评估,为其预后判断提供新的方法和依据。
1 资料与方法
1.1 一般资料
(1)选取1990年9月至2010年9月河北医科大学第二医院的103例40岁以上HM患者清宫术后病理存档石蜡组织标本,对病例进行回顾性研究。其中年龄40~56岁;按照检测患者组织标本中血清β-人绒毛膜促性腺激素(β-human chorionic gonadotropin,β-hCG)水平的不同,将其分为观察组(β-hCG>2×105mIU/ml,67例)和对照组(β-hCG<2×105mIU/ml,36例)。观察组平均年龄(47.06±0.61)岁;对照组平均年龄(46.78±0.41)岁。
(2)选取88例40岁以上IHM患者经化疗行子宫切除术石蜡包埋组织标本,年龄40~57岁,按照β-hCG水平的不同,将其分为观察2组(β-hCG>2×105mIU/ml,52例)和对照2组(β-hCG<2×105mIU/ml,36例)。均为临床Ⅰ期,术前均行双枪化疗,平均(3.55±1.83)个疗程。观察2组平均年龄(46.89±0.50)岁,预后评分≥7分;对照2组平均年龄(46.72±0.54)岁,预后评分≤6分。所有病例为临床明确诊断,由病理证实。本研究经医院伦理委员会批准。
1.2 仪器与试剂
(1)主要仪器。LEICA RM2135型石蜡切片机(德国Leica公司);OLYMPUS CX21型光学照相显微镜(日本OLYMPUS公司);ZPJ-1型展片机(天津天利公司);隔水式电热恒温培养箱(上海医用恒温设备厂);XMT-H型数显温控仪(上海沪南科学仪器联营厂)。
(2)主要试剂。兔抗人IMP3多克隆抗体(英国Abcam公司);免疫组化试剂盒[链霉亲和素-过氧化物酶(streptavidin-perosidase,SP),北京鼎国生物技术有限公司];DAB显色试剂盒(北京中杉金桥生物技术有限公司);氨丙基三乙氧硅烷(3-amino propyltri ethoxy silane,APES)防脱片试剂(北京中杉金桥生物技术有限公司)。
1.3 试验方法
所有蜡块标本以5 μm厚度切片制片,每张切片经苏木精-伊红(hematoxylin eosin,HE)染色、常规病理形态学观察证实后纳入,采用SP法进行染色,与已知阳性对照切片进行阳性对照,用磷酸盐缓冲液(phosphate buffer solution,PBS)代替一抗作为阴性对照。
1.4 观察与评价指标
(1)观察比较103例40岁以上HM患者IMP3基因在HM中的表达情况;观察比较88例40岁以上IHM患者IMP3基因在IHM中的表达情况。
(2)IMP3基因位于细胞浆,以细胞浆内出现棕黄色或棕褐色的染色定为阳性。参照免疫组织化学反应结果的评定标准,采用显色强度结合阳性细胞百分比法判读结果,细胞浆内出现深棕色颗粒(强阳性)为3分,出现淡黄色颗粒(弱阳性)为1分,介于两者之间(中度阳性)为2分[3]。在高倍镜视野下计算滋养细胞的阳性细胞数的百分率,阳性细胞数分为4级:≤5%为0分,6%~25%为1分,26%~50%为2分,≥51%为3分。根据显色程度判定阳性程度分为4级:基本不着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。将染色强度分值与阳性细胞百分率分值相乘之积为每个视野得分,共5个高倍视野,每个视野平均值为最后得分:0~1分为阴性(-),2~3分为弱阳性(+),4~6分为中等阳性(++),>6分为强阳性(+++)。

表2 IMP3在观察2组和对照2组IHM患者中治疗前后的表达
1.5 统计学方法
采用SPSS 16.0统计软件对数据进行统计分析,组内进行卡方检验,组间用秩和检验,以P<0.05为差异有统计学意义。
2 结果
2.1 IMP3基因在HM中的表达
(1)观察组中IMP3阳性表达24例,其中强阳性表达7例,一般阳性表达11例,弱阳性表达6例,IMP3阳性表达率为35.82%(24/67);恶变为IHM的16例,恶变率为66.67%(16/24)。IMP3阴性表达43例,恶变为IHM的8例,恶变率为18.60%(8/43)。IMP3阳性表达与阴性表达的恶变率比较,其差异有统计学意义(x2=15.477,P<0.05)。观察组HM的IMP3阳性表达如图1所示。

图1 β-hCG>2×105 mIU/ml时HM的IMP3阳性表达病理图(×200)
(2)对照组中IMP3的阳性表达3例,其中强阳性表达0例,阳性表达1例,弱阳性表达2例,阳性表达率为8.33%(3/36);恶变为IHM的3例,恶变率为100%(3/3);IMP3阴性表达33例,恶变为IHM的7例,恶变率为21.21%(7/33)。IMP3阳性表达与阴性表达的恶变率比较,差异有统计学意义(x2=1.61,P<0.05)。对照组HM的IMP3阴性表达如图2所示。
(3)观察组IMP3阳性表达率(35.82%)与对照组IMP3阳性表达率(8.33%)比较,其差异有统计学意义(x2=9.148,P<0.05),见表1。

图2 β-hCG<2×105 mIU/ml时HM的IMP3阴性表达病理图(×200)
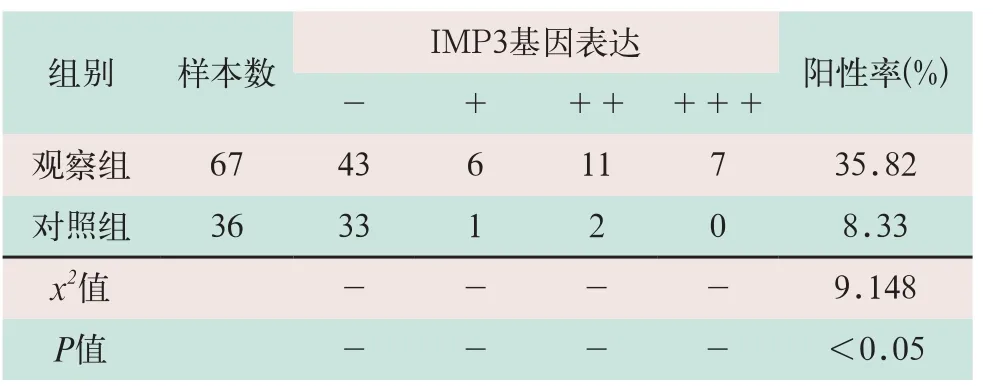
表1 两组IMP3在HM患者中的阳性表达率比较
2.2 IMP3在IHM中的表达
IMP3蛋白于两组患者IHM滋养细胞的胞浆中均有表达,观察2组化疗前IMP3的阳性表达率为94.23%(49/52),化疗后IMP3的阳性表达率为82.69%(43/52)。对照2组化疗前IMP3的阳性表达率为77.78%(28/36),化疗后IMP3的阳性表达率为58.33%(21/36)。两组化疗前和化疗后IMP3的阳性表达率比较差异具有统计学意义(x2=3.868,x2=6.364;P<0.05),见表2。
3 讨论
目前,滋养细胞肿瘤临床治疗评估和预后观察主要依据血清β-hCG,随着分子生物学和生物医学的不断发展,肿瘤相关基因在滋养细胞肿瘤中的研究日益进展。IMP3是一种新识别的癌胚核糖核酸(ribonucleic acid,RNA)结合蛋白。IMP3基因是人胰岛素样生长因子ⅡmRNA结合蛋白家族(IMP1,IMP2,IMP3)的成员之一,该家族成员在胚胎形成早期的RNA运输、稳定、细胞生长和迁移中起着重要作用[4-5]。近年来研究发现,IMP3可能参与多种肿瘤的发生,发展而受到广泛关注,有可能成为一种新的肿瘤标记物。
研究表明,IMP3基因在大鼠和人类早期胚胎发育时期在胎盘组织中有表达,而在正常成人组织中几乎无表达。妊娠滋养细胞疾病是一组来源于胎盘滋养细胞的疾病,滋养细胞来源于胚胎的胚外层细胞。HCG是滋养细胞疾病特异及敏感的肿瘤标记物,是诊断与治疗监测的主要参照指标,HCG>10万和年龄>40岁认为是与HM发生局部转移和(或)远处转移和滋养细胞肿瘤预后有关的高危因素。
本研究结果显示,IMP3基因在40岁以上HM患者组织中高表达,且在血清β-hCG>2×105mIU/ml时表达率较血清β-hCG<2×105mIU/ml时明显升高,提示IMP3可能参与了HM的发生发展,故其在HM发生局部侵蚀和远处转移方面具有一定的预测作用。在40岁以上IHM患者组织中,IMP3亦有表达,在血清β-hCG>2×105mIU/ml时IMP3的阳性表达率高于血清β-hCG<2×105mIU/ml,两者比较差异有统计学意义,提示IMP3对于滋养细胞肿瘤的病情评估预后观察可能有指导意义。HM是滋养细胞的异常增殖所形成,可对子宫肌层和血管发生侵袭,甚至远处转移。滋养细胞具有取代血管内皮细胞形成血管内壁的亲血管性特点,因此该类肿瘤极易侵蚀子宫肌层血管,并在疾病早期即可发生血行转移至身体其他脏器。IMP3与胰岛素样生长因子(insulin-like growth factors,IGFs)结合可以调节IGFs与IGF2型受体间的相互作用,改变其促有丝分裂效应、凋亡抑制效应和促细胞运动的作用[6-7]。Bae等[8]研究发现,IGF-2可以促进肿瘤血管和淋巴管的生长,降低IGF-2信使RNA结合蛋白IGF-2的分泌,可以减少体外肿瘤细胞的增殖和活体肿瘤的生长。因此,IGF2 BP3/IGF-2途径在HM发生侵蚀和转移方面可能起到一定的作用。
IHM继发于HM之后,是一种妊娠滋养细胞肿瘤,临床表现为恶性病变且多伴有局部侵袭和远处转移,需要化疗,绝大部分病例均可通过大剂量化疗达到治愈,是少数可以治愈的实体肿瘤之一,但部分病例需要化疗联合手术或放射治疗等辅助治疗手段。滋养细胞疾病的原发灶在子宫,主要通过血行转移,宫旁血管常异常充盈怒张,血管内常有瘤栓存在,甚至可见到水泡状组织。有学者报道,对无生育要求的耐药患者采用化疗联合手术治疗的方案,既可缩短治疗时间,还可减少复发的风险。对经过多疗程化疗后血清β-hCG值下降不明显,而其他部位转移灶明显吸收的患者,如怀疑子宫病灶耐药亦可在更改化疗方案的同时进行子宫切除术,以改善治疗效果,提高肿瘤缓解率。妊娠滋养细胞肿瘤盆腔血供丰富,易出血及发生癌细胞扩散,并有肺血管栓塞可能,除急诊情况为抢救患者生命外,对有手术切除子宫指征的患者,术前应先进行数个疗程的化疗。大量资料证实,预防性化疗可以使IHM的发生率下降近一半,应对有恶变高危因素的HM患者给予预防性化疗[9]。
妊娠滋养细胞肿瘤患者行子宫切除手术的适应证为:①年龄大,不希望再生育者,在短期化疗后行子宫切除术;②尽量使病灶局限,以减少术中出血,并彻底清除病灶;③子宫病灶已耐药者行子宫切除术;④子宫破裂者行子宫切除术,对无生育要求的患者采用化疗联合手术治疗的方案,既可缩短治疗时间,还可减少复发的风险。
对有手术切除子宫指征的患者术前应先进行数个疗程化疗,待病变基本控制稳定后再行手术,这样不仅能保证手术过程顺利,术中出血少,而且手术也能更为彻底[10]。对于年龄>40岁的妇女,由于生理机能的特点,妊娠后发生IHM及恶变率的概率较年轻育龄妇女明显增加,对其的身心健康和生命危害极大,亦极易引起误诊,使患者不能得到及时治疗而影响其预后[11-12]。研究发现,IMP3可以介导激活IGF-2的翻译而促进人类白血病细胞的增殖,IMP3还可以通过和靶信使RNA结合来调整信使RNA的转移、粘附和运输,化学药物抑制了滋养细胞的增殖,从而使IMP3的表达下降,通过与靶信使RNA结合的IMP3蛋白减少来抑制肿瘤信使RNA的转移、粘附和运输,从而使滋养细胞的数量减少和活性降低[13]。
有文献报道,恶性滋养细胞疾病患者的血清HCG分泌量与癌细胞总数以及病情严重程度呈正相关[14]。因此,在对实施手术后的滋养细胞肿瘤患者应继续化疗数个疗程,以进一步杀死和灭活潜藏于病灶内的滋养细胞,以达到治愈和防止肿瘤复发的目的。滋养细胞疾病患者多数可治愈,病死率明显降低,但其可发生局部侵袭和远处转移,具有降低细胞粘连、对细胞外基质的降解等多数肿瘤的分子生物学特征。Findeis-Hosey等[15]研究报道,IMP3可调节细胞外基质和细胞粘连蛋白,稳定粘附因子CD44及信使RNA从而促进神经癌细胞的形成。
妊娠滋养细胞疾病具有极强的亲血管性,在其发生与转移过程中,必须多次溶解血管内皮基底膜及细胞外基质,来促进细胞恶变及转移的发生。在妊娠早期,即胚泡和胎盘形成时期,滋养细胞表达和分泌较多的基质金属蛋白酶(matrix metalloproteinases,MMPs),分解细胞外基质(extracellular matrix,ECM),启动滋养层粘附、迁移和分化,使滋养层穿透基底膜到达母体循环,促进胚胎种植[16]。而滋养细胞肿瘤的滋养细胞则失去控制,不断浸润溶解子宫内膜基质,从而进一步恶化及转移。因此,在后续研究中可通过检测血液中IMP3的表达情况进一步研究IMP3在滋养细胞肿瘤及其他妇科肿瘤中的情况,使其成为简便实用的肿瘤标志物,有利于了解肿瘤的发生、发展及疾病的诊疗和预后观察。
[1]曹雪霞.IMP3在40岁以上葡萄胎及侵蚀性葡萄胎患者中的表达研究[D].石家庄:河北医科大学,2011.
[2]张梅娜,张丽娟,李英惠,等.IMP3基因在葡萄胎中的表达及其意义[J].中国医学装备,2017,14(9):81-84.
[3]许良中,杨文涛,免疫组织化学反应结果的判定标准[J].中国癌症杂志,1996,6(4):229-231.
[4]Wang T,Fan L,Watanabe Y,et al.L523S,an RNAbinding protein as a potential therapeutic target for lung cancer[J].Br J Cancer,2003,88(6):887-894.
[5]Yantiss RK,Woda BA,Fanger GR,et al.KOC(K homology domain containing protein overexpressed in cancer):a novel molecular marker that distinguishes between benign and malignant lesions of the pancreas[J].Am J Surg Pathol,2005,29(2):188-195.
[6]Lamharzi N,Schally AV,Koppán M,et al.Growth hormone-releasing hormone antagonist MZ-5-156 inhibits growth of DU-145 human androgen-independent prostate carcinoma in nude mice and suppresses the levels and mRNA expression of insulin-like growth factor II in tumors[J].Proc Natl Acad Sci USA,1998,95(15):8864-8868.
[7]Jungwirth A,Schally AV,Pinski J,et al.Growth hormone-releasing hormone antagonist MZ-4-71 inhibits in vivo proliferation of Caki-I renal adenocarcinoma[J].Proc Natl Acad Sci USA,1997,94(11):5810-5813.
[8]Kim KW,Bae SK,Lee OH,et al.Insulin-like growth factor II induced by hypoxia may contribute to angiogenesis of human hepatocellular carcinoma[J].Cancer Res[J].1998,58(2):348-351.
[9]Björndahl M,Cao R,Nissen LJ,et al.Insulinlike growth factors 1 and 2 induce lymphangiogenesis in vivo[J].Proc Natl Acad Sci USA,2005,102:15593-15598.
[10]Csernus VJ,Schally AV,Kiaris H,et al.Inhibition of growth, production of insulin-like growth factor-II (IGF-II),and expression of IGFII mRNA of human cancer cell lines by antagonistic analogs of growth hormonereleasing hormone in vitro[J].Proc Natl Acad Sci USA,1999,96(6):3098-3103.
[11]宋鸿钊,杨秀玉,向阳.滋养细胞肿瘤的诊断和治疗[M].2版.北京:人民卫生出版社,2004.
[12]路虹,王雁.40岁以上滋养细胞疾病86例临床分析[J].中国妇幼保健,2004,19(24):53-54.
[13]Liao B,Hu Y,Herrick DJ,et al.The RNA2binding p rotein IMP-3 is a translational activator of insulin-like growth factor Ⅱ leader-3 mRNA during p roliferation of human K562 leukemia cells[J].J Biol Chem,2005,280(18):18517-18524.
[14]程绍钧,余裕民.检验核医学[M].3版.重庆:重庆大学出版社,1999:133.
[15]Findeis-Hosey JJ,Yang Q,Spaulding BO,et al.IMP3 expression is correlated with histologic grade of lung adenocarcinoma[J].Hum Pathol,2010,41(4):477-484.
[16]Niu R,Okamoto T,Iwase K,et al.Quantitative analysis of matrix metalloproteinases-2 and -9,and their tissue inhibitors-1 and -2 in human placenta throughoout gestation[J].Life Sci,2000,66(12):1127-1137.

