桔梗总皂苷对PM2.5致肺损伤大鼠表面活性物质相关蛋白A表达的影响
姚琳,张俊威,孟庆杰,董坤,王伟明
(黑龙江省中医药科学院,黑龙江哈尔滨150036)
PM2.5是大气污染的主要来源,已成为影响人类生存环境和身体健康的主要因素。其粒径小,可随气流进入呼吸道深部,沉积在终末细支气管和肺泡,其中的超细颗粒物甚至可通过肺泡进入体循环,对机体造成损伤。越来越多的流行病学和毒理学研究资料表明,PM2.5与人类呼吸道疾病、肺癌和慢性心肺疾病的发病率密切相关[1-3]。肺泡Ⅱ型上皮细胞(AEC-Ⅱ)是肺泡上皮的干细胞,是合成和分泌肺泡表面活性物质及其相关蛋白的主要细胞[4]。AEC-Ⅱ损伤后,可诱导上皮通透性增加,降低表面活性物质相关蛋白(SP-A)的合成和分泌[5]。SP-A是由AEC-Ⅱ合成并分泌到肺泡腔中的胶原糖蛋白,能降低肺泡的液-气界面表面张力,防止肺泡在低肺容量时塌陷,对于维持肺的正常功能至关重要[6-7]。已有研究报道,PM2.5可降低大鼠肺组织中SP-A的表达水平,提示AEC-Ⅱ受损[8]。桔梗为桔梗科植物桔梗Platycodon grandiflorum(Jacq.)A.DC.的干燥根,具有宣肺利咽、祛痰排脓的功效,是治疗呼吸系统疾病的常用中药,其主要活性成分为桔梗总皂苷。本研究中通过对PM2.5模型的复制,探讨桔梗总皂苷对PM2.5致肺损伤大鼠SP-A表达的影响,以及对AEC-Ⅱ的修复作用。现报道如下。
1 材料与方法
1.1 仪器、试药与动物
仪器:SorvaⅡST16型低温离心机(Thermo公司);KD-TS3A型自动组织脱水机(浙江金华科迪仪器设备有限公司);KD-BM型生物组织包埋机(浙江金华科迪仪器设备有限公司);RM2235型组织切片机(德国徕卡公司);BX4-1型生物显微镜,DP-72型组织生物信号采集分析系统(Olympus公司);Infinite M200 Pro型酶标仪(Tecan公司);9600型定量PCR检测仪(杭州博日科技有限公司);VersaDoc 400mp型凝胶成像系统,PowerPac Universal型电泳仪,半干转膜仪(BIO-RAD公司);DYCZ-24DN型电泳槽(北京六一仪器厂)。
试药:TRIzol试剂(美国Invitrogen公司,批号为66211);Transcriptor first strand cDNA Synthesis Kit(Roche公司,批号为1485422);FastStart Universal SYBR Green Master(ROX,Roche公司,批号为10277200);SP-A、β-actin引物(哈尔滨博仕生物技术有限公司);SP-A多克隆抗体(SANTA公司);高效RIPA组织/细胞裂解液(北京索莱宝科技有限公司);PMSF(Calbiochem公司);BCA蛋白浓度测定试剂盒(碧云天公司);SDSPAGE凝胶配制试剂盒(碧云天公司);PVDF膜(Millipore公司);SP-A检测试剂盒(酶联免疫吸附试验法,SEA890Ra 96T,L140724594,Uscn)。桔梗(安国市奉义中药饮片有限公司,批号为20141020),经黑龙江省中医药科学院王伟明研究员鉴定为正品,桔梗总皂苷纯度为84.62%;试药在给药前研磨成粉,溶解,涡旋混匀。
动物:180~220 g Wistar大鼠50只,雌雄各半,由长春亿斯实验动物技术有限公司提供,SPF级,实验动物许可证号为SCXK(吉)2011-0004。
PM2.5:PM2.5滤膜由哈尔滨市环境监测站提供。滤膜经超声洗脱处理后,收集PM2.5溶液,真空冷冻干燥后-20℃保存。临用前,用生理盐水配成质量浓度为10 g/L的PM2.5混悬液。
1.2 方法
动物分组、造模及给药:将50只Wistar大鼠随机分为5组,即空白对照组(A组),模型对照组(B组),PGS高、中、低剂量(C1,C2,C3)组,各10只,雌雄各半。大鼠适应性饲养1周后,除A组外,其余各组采用气管滴注法进行染毒,染毒剂量为10 mg/kg,每日1次,连续5 d。染毒第6天开始灌胃给药,每日1次,A组和B组灌胃等量生理盐水;C1,C2,C3组给药剂量56,28,14mg/kg,每日1次,连续给药14d。第14天给药后1h,予1%戊巴比妥钠麻醉,腹主动脉取血,分离血清-80℃冻存,用于检验血清中SP-A含量;收集肺泡灌洗液(BALF),于-80℃冻存备用,用于检验BALF中SP-A含量;剪取左肺组织,4%甲醛固定,用于HE染色;取右肺组织中叶,用于提取RNA和蛋白质。
HE染色试验:取甲醛固定的肺组织,用乙醇梯度脱水,二甲苯中透明2次,放入石蜡内进行包埋。蜡块修好后固定于石蜡切片机上,切片,将完全展开的蜡片贴附于清洁载玻片上,常规HE染色,在显微镜下进行病理组织学检查。
大鼠肺组织SP-A mRNA检测:以实时荧光定量PCR法检测SP-A mRNA的表达。提取RNA,用酶标仪对RNA纯度及浓度进行测定,根据RNA浓度调整总RNA的体积,使各样品逆转录体系所含的RNA量相同,将RNA逆转录为cDNA,以逆转录合成的cDNA为模板,进行聚合酶链反应。引物序列[9]:SP-A上游5′-TAA GTG CTG CCC TCT GAC CT-3′,下游5′-AGG AGC CAT ACA TGC CAA AC-3′;β-actin上游5′-CGT TGA CAT CCG TAA AGA C-3′,下游5′-TGG AAG GTG GAC AGT GAG-3′。
大鼠肺组织SP-A蛋白检测:按试剂盒操作步骤提取,检测蛋白浓度,相同蛋白浓度加入12%SDS PAGE凝胶,分离,转印到PVDF膜上。PVDF膜用5%脱脂奶粉封闭3 h,加入一抗稀释液4℃孵育,过夜,然后将膜与二抗稀释液在室温下摇床孵育1 h。最后用化学发光试剂显色,在凝胶成像仪中拍照。
大鼠血清及BALF中SP-A测定:采用酶联免疫吸附(ELISA)法检测,根据预试验,血清和BALF样品分别稀释100,1 000倍后测定,操作程序按ELISA试剂盒要求进行。
1.3 统计学处理
采用SPSS 18.0统计学软件分析,计量数据用X±s表示,两组间均数比较采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 大鼠肺组织病理变化
剖检时可见,B组大鼠肺部病变明显,外观充血、水肿,严重者肺叶分布散在大小不等的坏死灶,病变程度以模型组最重;病理学检查显示,病变主要在肺内,病变性质为间质性肺炎和细支气管肺炎,肺纤维增生,肺间质炎性细胞浸润,支气管及血管周围有明显的淋巴细胞浸润,肺泡结构不完整,排列不规则,肺泡上皮细胞脱落。A组大鼠肺组织基本正常。C1,C2,C3组大鼠的肺组织相对于B组,上述病变明显减轻,且间质性肺炎的程度随着剂量的增加而逐渐减轻,C1组与A组相近。结果见图1。可见,PGS具有改善PM2.5致肺损伤的作用,使肺组织病变程度明显减轻。

图1 各组大鼠肺组织病理检测结果(HE×10)
2.2 大鼠肺组织SP-A mRNA和蛋白的表达
与A组比较,B组SP-A mRNA和蛋白的表达显著下调(P<0.01);与B组比较,C1,C2,C3组增加SP-A mRNA和蛋白的表达,尤其以C1,C2组差异显著(P<0.01,P<0.05),且C1组上调明显。详见表1和图2。
表1 各组大鼠肺组织中SP-A mRNA和蛋白表达比较(s,n=10)

表1 各组大鼠肺组织中SP-A mRNA和蛋白表达比较(s,n=10)
注:与A组比较, P<0.01;与B组比较, P<0.05, P<0.01。表2同。
蛋白(SP-A/ -actin)0.86±0.09 0.28±0.10 0.71±0.08 0.52±0.12 0.36±0.10组别A组B组C1组C2组C3组剂量[mg/(kg·d)]56 28 14 mRNA(SP-A/ -actin)0.978±0.023 0.261±0.006 0.783±0.018 0.516±0.036 0.331±0.043
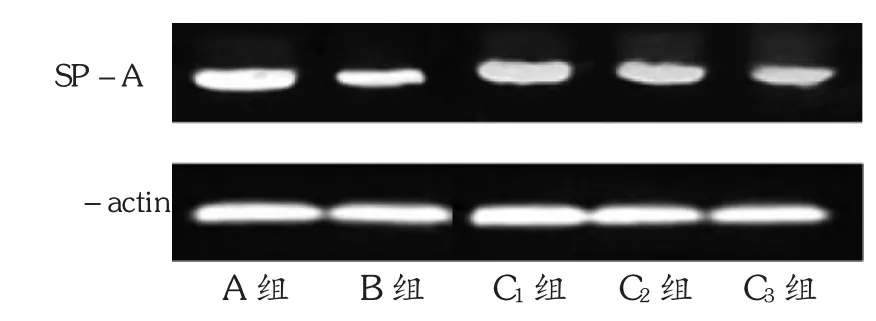
图2 各组大鼠肺组织SP-A蛋白表达
2.3 大鼠血清及BALF中SP-A的含量测定
与A组比较,B组大鼠血清中SP-A含量明显上调(P<0.05),而BALF中SP-A含量下降(P<0.05);与B组大鼠相比,C1,C2,C3组大鼠血清中SP-A含量下调,其中C1,C2组下调显著(P<0.05),BALF中SP-A含量均显著增加(P<0.05,P<0.01)。详见表2。
表2 各组大鼠血清及BALF中SP-A含量比较(s,n=10)

表2 各组大鼠血清及BALF中SP-A含量比较(s,n=10)
组别A组B组C1组C2组C3组剂量[mg/(kg·d)]56 28 14血清(ng/mL)9.638±0.926 12.332±0.759 9.105±1.639 9.427±1.934 11.309±2.118 BALF(ng/mL)565.32±63.55 453.76±57.41 629.25±54.73 587.92±58.36 561.33±60.97
3 讨论
PM2.5对肺组织的影响[10-12],其病理学变化主要表现为炎性改变,肺间质有大量的炎性细胞浸润,肺间隔增厚,毛细血管受损,细支气管和毛细血管周围亦有大量的炎性细胞浸润。本试验中PM2.5致肺损伤的模型复制再次验证,其对肺损伤的作用,同时也证实,桔梗总皂苷可明显减轻PM2.5致大鼠肺组织的炎症表现,肺组织形态结构趋向于正常,损伤得到修复。
大量炎性细胞的产生,一方面可抑制SP-A的基因表达[13],另一方面可使AEC-Ⅱ凋亡、裂解、坏死,AEC-Ⅱ数目减少,且不能及时得到更新,进一步导致SP-A表达下调。随着SP-A mRNA下调效应的积累、叠加与放大,其蛋白表达也逐渐下降。给药后,药物使炎性细胞数量下降,炎性细胞对SP-A mRNA的抑制作用减弱,且AEC-Ⅱ得到修复、增生,使SP-A mRNA表达增强,同时随着SP-A基因表达的增多,被翻译蛋白量增加,其蛋白表达提高。
SP-A的合成和分泌具有一定的肺特异性,主要由AEC-Ⅱ表达。正常情况下,SP-A在血液中是不表达或表达很微量的,但当肺泡上皮细胞和周围毛细血管受到炎性细胞的浸润而造成不同程度的损伤时,肺泡毛细血管通透性增加,SP-A渗漏到肺泡毛细血管中并随血液流入血循环[14],导致SP-A水平在体循环血液中上升,故血清中SP-A的水平可反应肺损伤的严重程度。
本试验结果表明,PM2.5可使大鼠BALF中SP-A含量下降,而使血清中SP-A含量增加,提示PM2.5可导致AEC-Ⅱ及毛细血管受损。而PGS各剂量均能增加BALF中SP-A含量,并降低血清中SP-A含量,提示PGS对受损的AEC-Ⅱ及毛细血管具有一定的修复作用,且能恢复AEC-Ⅱ的正常合成和分泌SP-A的功能。
[1]Nel A,Xia T,Madler L,et al.Toxic potential of materials at the Nanolevel[J].Science,2006,311(5761):622-627.
[2]Samoli E,Analitis A,Touloumi G,et al.Estimating the exposureresponse relationships between particulate matter and mortality within the APHEA Multicity Project[J].Environmental Health Perspectives,2005,113(1):88-95.
[3]Ostro B,Broadwin R,Green S,et al.Fine particulate air pollution and mortality innine California counties:Results from CALFINE[J].Environmental Health Perspectives,2006,114(1):29-33.
[4]杨青,王桂芳.肺泡Ⅱ型上皮细胞功能的研究进展[J].复旦学报(医学版),2012,39(6):658-662.
[5]Ahmad IM,Britigan BE,Abdaila MY.Oxidation of Thiols and Modification of Redox-Sensitive Signaling in Human Lung Epithelial Cells Exposed to Pseudomonas pyocyanin[J].J Toxicol Environ Health A,2011,74(1):43-51.
[6]Janssen WJ,McPhillips KA,Dickinson MG,et al.Surfactant proteins A and D suppress alveolar macrophage phagocytosis via interaction with SIRP alpha[J].Am J Respir Crit Care Med,2008,178(2):158-167.
[7]Whitsett JA,Wert SE,Weaver TE.Alveolar surfactant homeostasis and the pathogenesis of pulmonary disease[J].Annu Rev Med,2010,61(1):105-119.
[8]肖纯凌,李舒音,尚德志,等.模拟大气混合物污染对大鼠肺表面蛋白A的影响[J].中国公共卫生,2012,28(1):46-48.
[9]Xu GP,Xu D,Li HX,et al.Epithelial-mesenchymal transition of type II alveolar epithelial cells induced by TGF- 1[J].Fudan Univ J Med Sci,2007,34(2):223-227.
[10]闫庆倩,赵学彬,杨莉,等.不同地区大气PM2.5致肺损伤的比较实验研究[J].环境与健康杂志,2012,29(1):7-11.
[11]曲红梅,牛静萍,魁发瑞,等.大气中PM 2.5致大鼠呼吸道急性损伤作用[J].中国公共卫生,2006,22(5):598-599.
[12]晓开提·依不拉音,可丽别娜·吐尔逊,范妙莉,等.某地大气细颗粒物对大鼠肺损害与维生素E的拮抗作用[J].毒理学杂志,2013,27(4):287-290.
[13]Xing Z,Jordana M,Kirpalani H,et al.Cytokine expression by neutrophils and macrophages in vivo:endotoxin induces tumor necrosis factor-alpha,macrophage inflammatory protein-2,interleukin-1 beta,and interleukin-6 but not RANTES or transforming growth factor-beta 1 mRNA expression in acute lung inflammation[J].Am J Respir Cell Mol Biol,1994,10(2):148-153.
[14]Todd DA,Marsh MJ,George A,et al.Surfactant phospholipids,surfactant proteins,and inflammatory markers during acute lung injury in children[J].Pediatr Crit Care Med,2010,11(1):82-91.
——辨别味之苦甜

