大豆浓缩蛋白替代鱼粉对黄颡鱼生长、饲料利用、消化酶和抗氧化酶活性的影响
李晨晨 黄文文 金 敏 朱婷婷 罗嘉翔 马红娜 袁 野 周歧存
(宁波大学海洋学院鱼类营养研究室,宁波 315211)
黄颡鱼(Pelteobagrusfulvidraco)是我国内陆的一种小型淡水经济鱼类[1],其隶属鲇形目(Siluriformes),鲿科(Bagridae),黄颡鱼属(Pelteobagrus),在我国俗称嘎牙子、黄腊丁、嘎鱼等。属于温水性底层鱼类,喜栖息于缓流或者静水中,其肉质细腻、口感鲜美、营养价值高、无肌间刺等优点[2],深受人们的喜爱,具有很大的市场潜力。近年来,黄颡鱼的养殖规模迅速扩大[3],成了内陆淡水地区一种重要的养殖品种。
鱼粉是一种优质的蛋白质来源,可以广泛的应用于水产饲料中。随着水产养殖行业的不断发展,对水产饲料的需求越来越大,对鱼粉的需求量也不断增加。但由于资源的减少以及过度捕捞,使得鱼粉供应不足,市场价格高昂。为有效降低水产饲料的成本,寻求其他可靠的蛋白质源部分或全部替代鱼粉,成为一个必然的趋势。豆粕的蛋白质含量高,氨基酸相对较为平衡。菜籽粕也是广泛用于淡水鱼类的植物蛋白质源,但在实际生产中,菜籽粕经常与大豆蛋白质混合使用以达到最适的氨基酸平衡[4];在日本鲈鱼[5]等鱼类的研究中表明,菜籽粕可以替代一定比例的鱼粉。棉籽粕是继豆粕、菜籽粕之后的第三大植物蛋白质源。在中国,每年棉籽粕的产量都在600万t以上[6]。现有的研究表明,棉籽粕可以替代一定比例的鱼粉[7-8]。限制棉籽粕使用的主要因素是其内较高含量的棉酚,棉酚通常以多酚二醛的形式存在。近年来研究发现,以豆粕为代表的植物蛋白质源替代鱼粉会破坏鱼类消化和代谢系统的组织结构,抑制鱼类消化和代谢能力,鱼类对含有豆粕的饲料,表现出摄食率、消化率降低[9]。
大豆浓缩蛋白(SPC)是由大豆制作而成的,品质稳定、氨基酸消化率高、抗营养因子含量极低[10-11]。SPC除去豆腥味物质及大豆的胀气因子,粗蛋白质含量一般为65%~70%[12-13]。由于去除豆粕中大部分的可溶性碳水化合物、粗纤维、抗营养因子等影响水生动物对植物蛋白质源吸收利用的物质,SPC在水产饲料行业中具有很好的应用前景[12]。SPC虽然氨基酸含量丰富,但氨基酸平衡远不如鱼粉,某些必需氨基酸含量仍然不足,尤其是蛋氨酸含量不到优质鱼粉含量的一半[14-15]。在多种鱼类的研究中发现,SPC虽可以替代25%~100%的鱼粉[16-18],但SPC部分或全部替代鱼粉时结果差异较大[12,16,19]。在瓦式黄颡鱼的研究中发现SPC替代鱼粉对幼鱼存活率的影响不显著,但对生长以及摄食产生了显著影响[13]。本试验在前述研究的基础上,通过在饲料中添加赖氨酸和蛋氨酸,保证必需氨基酸供给充足的前提下,探讨SPC替代鱼粉水平对黄颡鱼生长、饲料利用、消化酶和抗氧化酶活性的影响,从而为研制高效环保黄颡鱼配合饲料提供科学的依据。
1 材料与方法
1.1 试验饲料
以鱼粉、豆粕和鱿鱼粉为蛋白质源,鱼油和大豆卵磷脂为脂肪源,面粉为糖源,配制成6组等氮等脂的饲料(粗蛋白质45%,粗脂肪10%)。以饲料鱼粉含量为50%的组为对照组,替代组饲料中SPC替代鱼粉水平分别为10.0%、20.0%、30.0%、40.0%和60.0%,同时在替代组饲料中添加蛋氨酸和赖氨酸,使其蛋氨酸和赖氨酸含量与对照组饲料一致。试验饲料组成及营养成分见表1,试验饲料的氨基酸组成见表2。饲料原料粉碎后过60目筛,按照配方表1称取各种饲料原料,微量添加成分采取逐级扩大法混合均匀,添加35%左右的水混匀后,压制成粒径为2~3 mm的颗粒饲料。自然风干至含水量约10%,分组置于封口袋中并放于-20 ℃冰柜冷冻保存备用。

表1 试验饲料组成及营养水平(干物质基础)
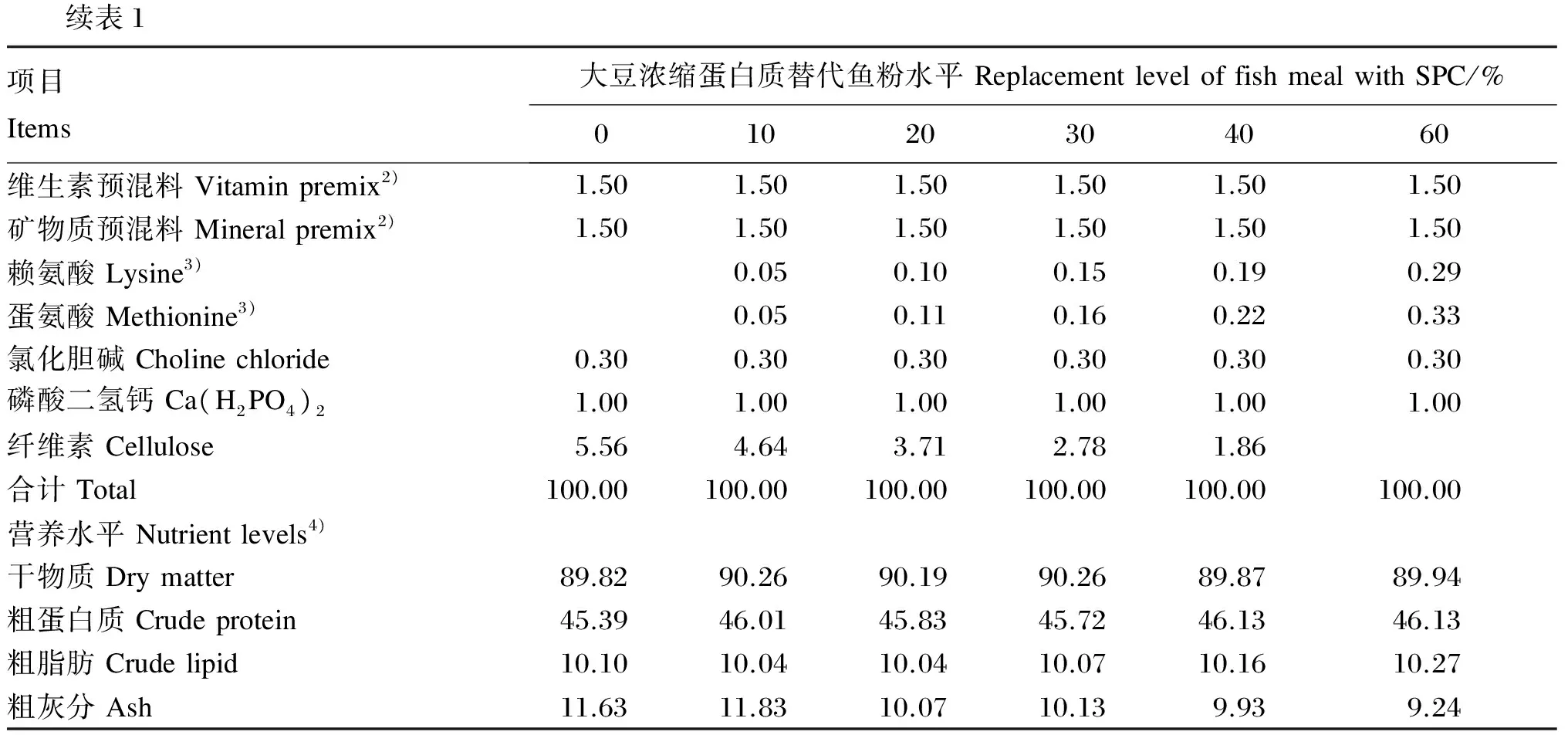
续表1项目Items大豆浓缩蛋白质替代鱼粉水平ReplacementleveloffishmealwithSPC/%01020304060维生素预混料Vitaminpremix2)1.501.501.501.501.501.50矿物质预混料Mineralpremix2)1.501.501.501.501.501.50赖氨酸Lysine3)0.050.100.150.190.29蛋氨酸Methionine3)0.050.110.160.220.33氯化胆碱Cholinechloride0.300.300.300.300.300.30磷酸二氢钙Ca(H2PO4)21.001.001.001.001.001.00纤维素Cellulose5.564.643.712.781.86合计Total100.00100.00100.00100.00100.00100.00营养水平Nutrientlevels4)干物质Drymatter89.8290.2690.1990.2689.8789.94粗蛋白质Crudeprotein45.3946.0145.8345.7246.1346.13粗脂肪Crudelipid10.1010.0410.0410.0710.1610.27粗灰分Ash11.6311.8310.0710.139.939.24
1)大豆浓缩蛋白采购于益海(泰州)粮油工业有限公司。SPC was purchased fromYihai(Taizhou) grain and oil industry Co., Ltd.
2)维生素预混料和矿物质预混料组成参考黄文文等[20]。Vitamin premix and mineral premix composition referred to Huang, et al[20].
3)赖氨酸和蛋氨酸为L晶体形式,纯度≥99%。Lysine and methionine wereL-crystal style, and purity≥99%.
4)营养水平均为实测值。 Nutrient levels were all measured values.
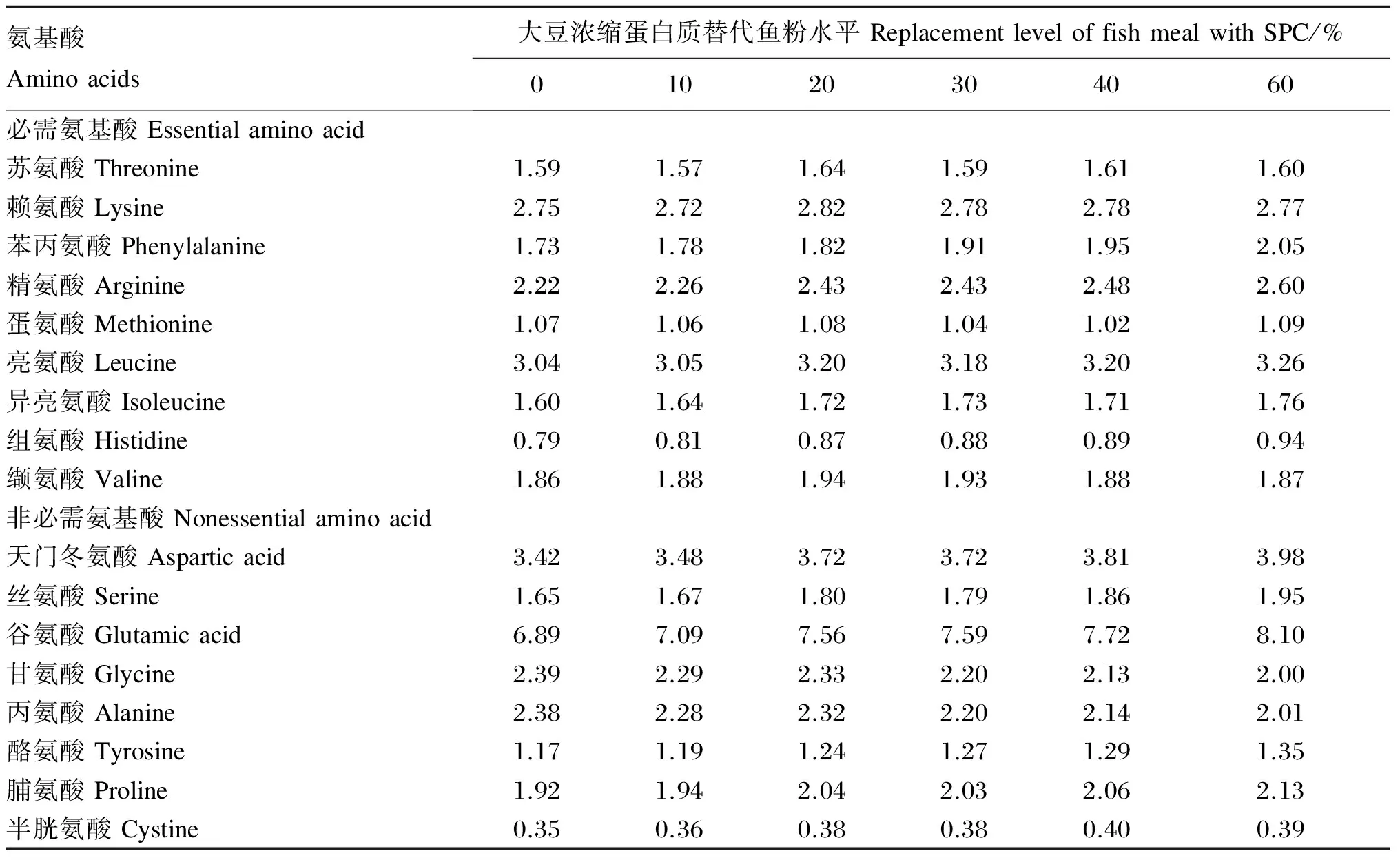
表2 试验饲料的氨基酸组成(干物质基础)
1.2 饲养管理
试验所用黄颡鱼鱼苗购自浙江省嘉兴市,于宁波大学鱼类营养研究室淡水养殖基地养殖车间进行投喂试验。试验前黄颡鱼苗用商品饲料(宁波天邦股份有限公司,粗蛋白质含量45%,粗脂肪含量10%)暂养2周,分组前停食24 h,挑选体格健壮、规格基本一致的个体540尾[初始体重约为(2.17±0.02) g],每个300 L玻璃钢养殖桶中随机放养30尾,每组饲料随机投喂3个养殖桶里的试验鱼,即每组的3个重复。每天投喂2次,日投喂量为其体重的4%~6%,投喂时间分别为07:30和17:00,投喂后1 h内观察其摄食情况,养殖前期每隔1 d换水50%左右,养殖中后期每天换水量50%~100%。养殖期间每天检查充气和水温情况,及时记录死鱼数量及重量,投喂周期为8周。每2周称重、计数并以此次调整随后2周饲料投喂量。试验期间,不间断充氧以保证水体中含有足够的溶解氧(>6.0 mg/L),水温为23.0~29.5 ℃,pH为7.5~8.0。
1.3 样品采集与分析方法
投喂试验结束后,鱼停食24 h,取样前每桶单独称重并计数,计算增重率、特定生长率、存活率、饲料效率及蛋白质效率。每个试验桶随机取3尾鱼分别测出其体长和体重,剥离内脏团和肠系膜脂肪称重,用于计算脏体比、肠脂比和肥满度;剥离肌肉(无皮肤的背部肌肉)置于封口袋,用于肌肉常规营养成分的分析。每桶随机取4尾鱼置于封口袋中,用于全鱼常规营养成分的分析。每个试验桶另随机取3尾鱼,分别剥离肝脏、胃、前肠于1.5 mL离心管中,用于抗氧化酶及消化酶活性的检测。用注射器抽取5~8尾鱼的血液注入1.5 mL离心管中,于4 ℃下静置过夜后5 000 r/min离心10 min,取上清液保存于-80 ℃备用,用于血清中生化指标的分析。
饲料、肌肉及全鱼常规营养成分分析:水分含量测定采用105 ℃常压干燥法;粗蛋白质含量测定采用蛋白质分析仪(FP-528,美国LECO公司);粗脂肪含量测定采用索氏抽提法;粗灰分含量测定采用550 ℃马福炉灼烧法。饲料样品中氨基酸含量采用高速氨基酸自动分析仪(L-8900,日本HITACHI公司)进行测定。
血清中生化指标分析:总蛋白、白蛋白、球蛋白、总胆固醇和甘油三酯含量均由宁波大学附属医院使用全自动生化分析仪(7600-110,日本HITACHI公司)测定。谷丙转氨酶、谷草转氨酶活性均采用南京建成生物工程研究所生产的相关试剂盒测定,相应操作均参照说明书进行。
肝脏抗氧化指标分析:超氧化物歧化酶、过氧化氢酶活性及丙二醛含量均采用南京建成生物工程研究所生产的相关试剂盒测定,相应操作均参照说明书进行。
消化酶活性分析:胃蛋白酶以及胃、前肠和肝脏淀粉酶活性均采用南京建成生物工程研究所生产的相关试剂盒测定,相应操作均参照说明书进行。
1.4 计算公式
摄食率[feed intake,g/(g BW·d)]=摄入的
干物质含量/[饲养天数×(终末体重+
初始体重)/2];增重率(weight gain rate,WGR,%)=100×
(终末均重-初始均重)/初始均重;特定生长率(specific growth rate,SGR,%/d)=
100×(ln终末体重-ln初始体重)/
饲养天数;蛋白质效率(protein efficiency ratio,PER)=
(终末体重-初始体重)/蛋白质摄入量;饲料效率(feed efficiency,FE)=(终末总重+
死亡总重-初始总重)/(投饲总量×
饲料干物质含量);肥满度(condition factor,CF,g/cm3)=
100×体重/体长3;肠脂比(intraperitoneal fat ratio,IPF,%)=
100×肠系膜脂肪重/体重;脏体比(viserosomatic index,VSI,%)=
100×内脏团重/体重;
1.5 数据统计分析
采用SPSS 17.0软件对所有数据进行单因素方差分析(one-way ANOVA),当处理之间有差异显著时,进行Duncan多重比较。以P<0.05作为差异显著判断标准。结果以平均值±标准差(mean±SD)表示。
2 结 果
2.1 SPC替代鱼粉对黄颡鱼生长性能、饲料利用以及形态学指标的影响
各组黄颡鱼成活率均为100%。表3的结果表明,随着饲料中SPC替代鱼粉水平增加,摄食率、饲料效率和蛋白质效率各组间无显著差异(P>0.05)。增重率和特定生长率随SPC替代鱼粉水平升高而降低,当SPC替代鱼粉水平不超过20%时,增重率和特定生长率无显著变化(P>0.05),而当饲料中SPC替代鱼粉水平提高到30%以上时,这2个指标显著降低(P<0.05),提高到60%时,增重率较其他替代水平显著降低(P<0.05)。黄颡鱼肥满度、脏体比与肠脂比在各试验组间无显著差异(P>0.05),但均有随SPC替代鱼粉水平升高而下降的趋势。
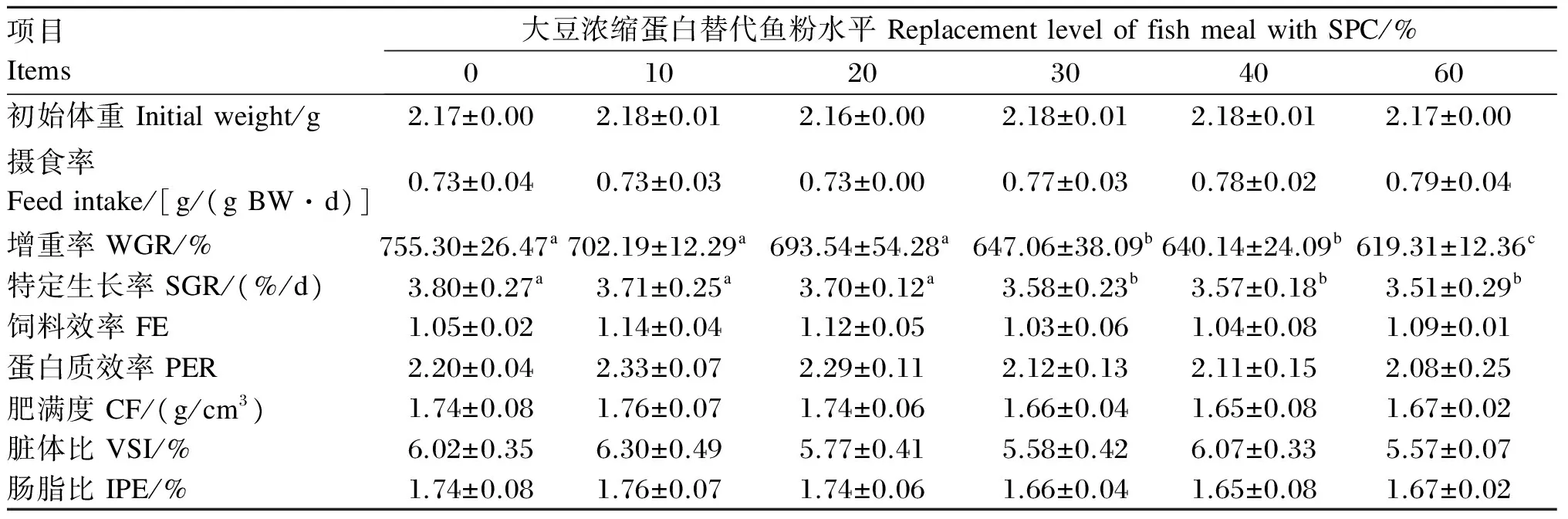
表3 大豆浓缩蛋白替代鱼粉对黄颡鱼生长性能、饲料利用以及形态学指标的影响
同行数据肩标无字母或相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。下表同。
In the same row, values with no letter or the same letter superscripts mean no significant difference (P>0.05), while with different small letter superscripts mean significant difference (P<0.05). The same as below.
2.2 SPC替代鱼粉对黄颡鱼全鱼和肌肉常规营养成分的影响
表4的结果表明,SPC替代鱼粉水平对全鱼干物质、粗蛋白质及灰分含量无显著影响(P>0.05),但对全鱼粗脂肪含量有显著影响(P<0.05)。SPC替代鱼粉水平为10%时,全鱼粗脂肪含量与对照组无显著性差异(P>0.05),当SPC替代鱼粉水平从10%升高到20%和30%时,全鱼粗脂肪含量显著降低(P<0.05)。SPC替代鱼粉水平对黄颡鱼肌肉干物质、粗蛋白质与粗脂肪含量影响不显著(P>0.05),但对肌肉灰分含量有显著影响(P<0.05)。当SPC替代鱼粉水平为10%时,肌肉灰分含量与对照组无显著差异(P>0.05),当SPC替代鱼粉的水平由10%提高到20%以上时,肌肉粗灰分含量显著下降(P<0.05)。
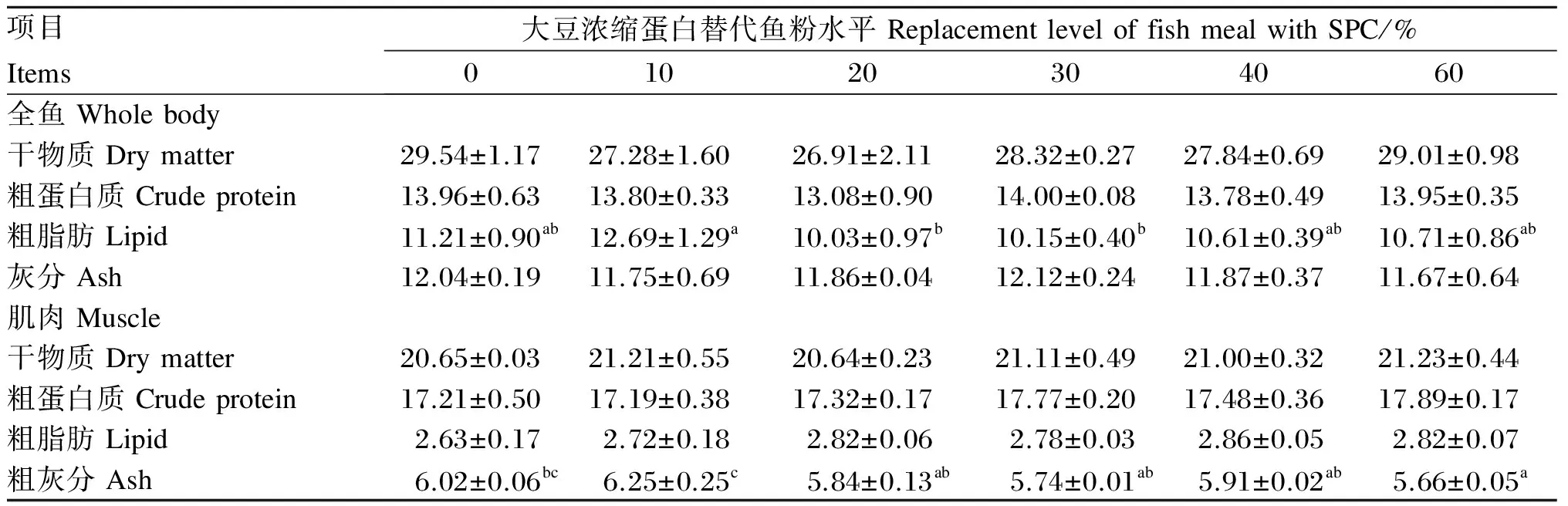
表4 大豆浓缩蛋白替代鱼粉对黄颡鱼全鱼和肌肉常规营养成分的影响
2.3 SPC替代鱼粉对黄颡鱼血清生化指标的影响
表5的结果表明,血清中总蛋白、白蛋白、球蛋白和甘油三酯含量及谷草转氨酶活性在各组间无显著差异(P>0.05)。SPC替代鱼粉水平对血清中葡萄糖、总胆固醇含量及谷丙转氨酶活性有显著影响(P<0.05)。血清葡萄糖含量随SPC替代鱼粉水平的升高呈先升高后下降的趋势,当SPC替代鱼粉水平由10%提高到30%时,血清葡萄糖含量显著升高(P<0.05),随SPC替代鱼粉水平由30%提高到40%以上时,血清葡萄糖含量显著下降(P<0.05),在SPC替代水平为30%时为最大值。随SPC替代鱼粉水平升高,血清谷丙转氨酶活性总体呈上升的趋势,血清总胆固醇含量总体呈下降趋势。
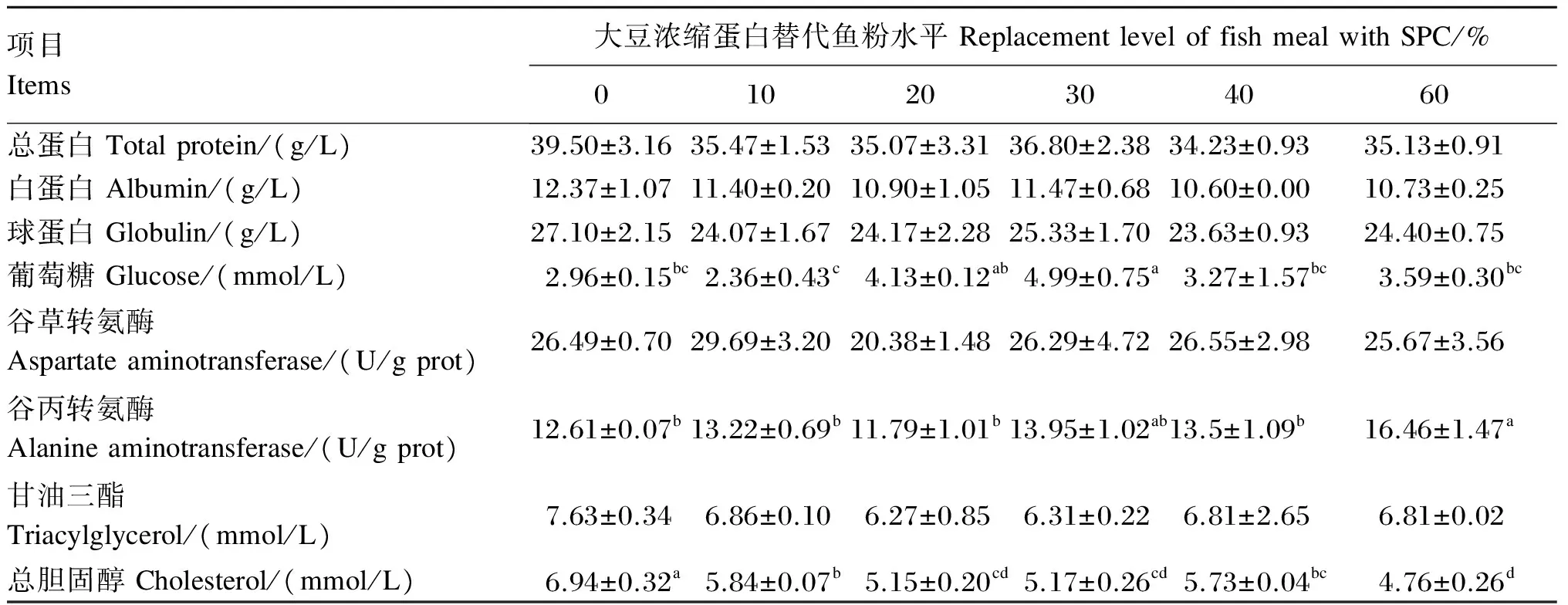
表5 大豆浓缩蛋白替代鱼粉对黄颡鱼血清生化指标的影响
2.4 SPC替代鱼粉对黄颡鱼肝脏抗氧化酶活性的影响
表6的结果表明,随SPC替代鱼粉水平升高,肝脏超氧化物歧化酶、过氧化氢酶活性及丙二醛含量有显著变化(P<0.05)。在SPC替代鱼粉水平为30%时,肝脏超氧化物歧化酶和过氧化氢酶活性达到最大值,肝脏丙二醛含量达到最小值。当SPC替代鱼粉水平不低于20%时,肝脏超氧化物歧化酶活性升高,且显著高于对照组(P<0.05),当SPC替代鱼粉水平在10%以上时,肝脏丙二醛含量显著降低(P<0.05)。
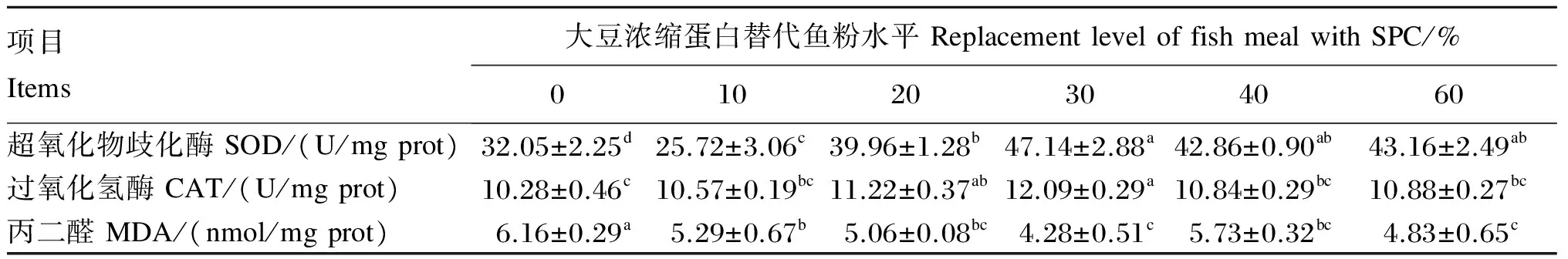
表6 大豆浓缩蛋白替代鱼粉对黄颡鱼肝脏抗氧化酶活性的影响
2.5 SPC替代鱼粉对黄颡鱼消化酶活性的影响
表7的结果表明,胃蛋白酶活性在各组间无显著差异(P>0.05),当SPC替代鱼粉水平为30%以下时,胃蛋白酶活性基本保持恒定,当SPC替代鱼粉水平在40%以上时,胃蛋白酶活性有下降趋势。SPC替代鱼粉水平对胃淀粉酶、前肠淀粉酶和肝脏淀粉酶活性有显著影响(P<0.05),当SPC替代鱼粉水平为10%和30%时,胃淀粉酶活性显著高于其他替代水平(P<0.05);前肠淀粉酶活性最小的SPC替代鱼粉水平为10%;肝脏淀粉酶活性在SPC替代鱼粉水平为40%时为到最小值,且显著低于对照组和SPC替代鱼粉水平为10%、20%时(P<0.05)。
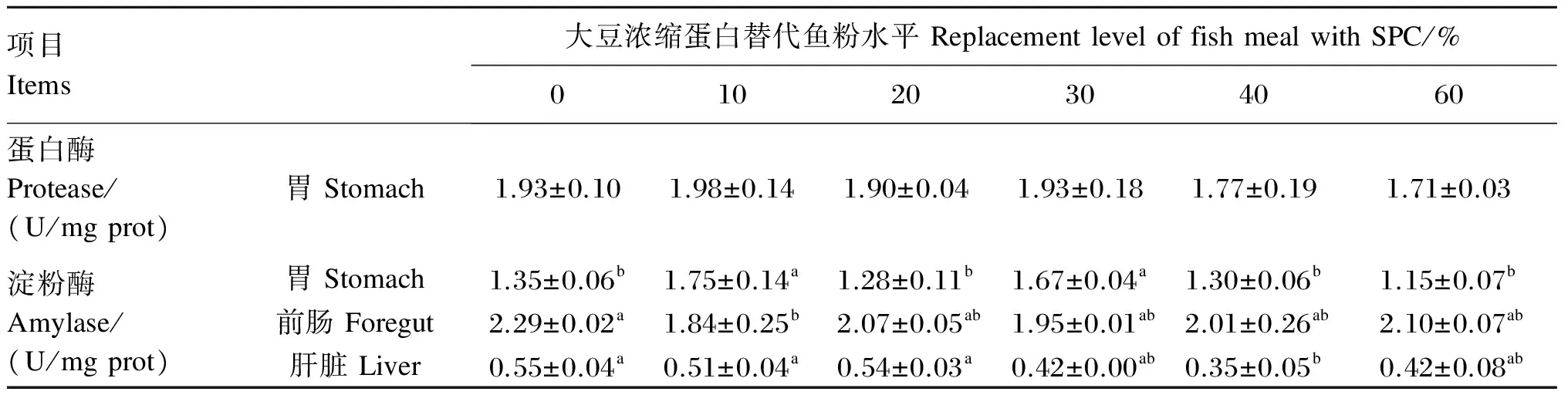
表7 大豆浓缩蛋白替代鱼粉对黄颡鱼消化酶活性的影响
3 讨 论
3.1 SPC替代鱼粉对黄颡鱼生长性能、饲料利用以及形态学指标的影响

有研究发现,摄食以豆粕为主要蛋白质源的饲料时,大西洋鲑(SalmosalarL.)[28]和虹鳟(Onchorynchusmykiss)[29]出现了肠炎等健康问题,Storebakken[30]在研究中发现大豆类蛋白质源中非淀粉多糖会引起肠炎从而使脂肪吸收率下降。本试验中,当SPC替代鱼粉水平为10%~60%时,全鱼粗脂肪含量随SPC替代鱼粉水平的增加而下降,黄颡鱼肥满度、脏体比和肠脂比的变化趋势与其基本一致,可能是由于植物蛋白质源对脂肪代谢的影响所致,此结果与刘兴旺等[12]在大菱鲆和Nahashon等[31]在黑鲷(Acanthopagrusschlegelii)中的研究结果相似。
3.2 SPC替代鱼粉对黄颡鱼全鱼及肌肉常规营养成分的影响
本试验结果表明,SPC替代鱼粉水平为10%~60%时,黄颡鱼全鱼粗脂肪含量随着SPC替代鱼粉水平升高呈下降的趋势。这与Elangovan等[32]关于饲料中添加豆粕蛋白质对全鱼常规营养成分以及Wang等[33]对于饲料中不同蛋白质水平对黄颡鱼中全鱼常规营养成分所得到的研究结果相似。推测出现本试验结果的原因可能是SPC中含有较多的非淀粉多糖,它会引起肠炎,导致脂肪吸收率下降,从而间接影响机体粗脂肪的含量[30]。肌肉灰分含量在SPC替代鱼粉水平为10%~60%时,随替代水平的增加呈下降趋势,其他鱼体和肌肉常规营养成分无显著变化,这与López等[34]的研究发现相似。
3.3 SPC替代鱼粉对黄颡鱼血清生化指标的影响
动物血液中的总蛋白与总胆固醇的含量会受到蛋白质代谢、脂质代谢和碳水化合物代谢的影响[35],总胆固醇作为脂质代谢的重要组成部分,与肝脏细胞发挥正常功能、机体脂质正常代谢息息相关,总胆固醇含量的高低变化可以反映肝脏细胞功能状态。本试验中总胆固醇含量随SPC替代鱼粉水平升高而下降,这与刘伟等[19]在中华鲟(Acipensersinensis)和Dias等[36]在欧洲海鲈(Barbodesaltus)发现血清中甘油三酯和总胆固醇含量随SPC替代鱼粉水平升高逐渐下降的结果一致。一般来讲,动物蛋白质原料中含有较高的胆固醇,而植物蛋白质原料中胆固醇含量很低[37],饲料中胆固醇含量会影响养殖动物血液胆固醇含量[23,38]。有研究报道,在狼鲈饲料中使用植物蛋白质源替代鱼粉,导致血清的总胆固醇含量降低。这可能是因为胆汁盐排泄量增加,也有可能是由于胆固醇胃肠道吸收受到限制,或者是植物蛋白质源替代使得饲料中胆固醇的含量不足[39],大部分学者认为植物蛋白质源中含有的抗营养因子等非蛋白质组分使得其具有降血液胆固醇含量的作用[40-41]。但有关植物蛋白质源中抗营养因子是否会干扰鱼类胆固醇代谢,目前还没有定论。葡萄糖是鱼体营养指标之一,也是反映动物糖代谢和全身组织细胞功能状态以及内分泌机能的一个重要指标。在一定的阈值内,血液葡萄糖含量越高,表明鱼类摄食越积极,健康状况良好。但当葡萄糖含量超过一定阈值时,会造成机体的营养生理胁迫,损害鱼体健康[42]。在本试验中,当SPC替代鱼粉水平为20%和30%时血清葡萄糖含量显著高于对照组,而在SPC替代鱼粉水平超过30%时,增重率和特定生长率也显著低于对照组,说明SPC替代鱼粉水平超过30%时,SPC会通过影响鱼体的糖脂代谢进而影响鱼的生长。
谷草转氨酶和谷丙转氨酶是参与体内氨基酸、蛋白质、脂质、糖类代谢的重要酶,谷草转氨酶主要与草酰乙酸与谷氨酸间的转氨反应有关,谷丙转氨酶则主要参与丙酮酸和谷氨酸之间的转氨作用[43]。谷丙转氨酶正常情况下主要存在于肝细胞中,而谷草转氨酶主要存在于肝细胞线粒体,它们在血清中的活性很低,只有在肝功能发生障碍时才会大量进入血液,使血清酶活性增加[44]。血清谷丙转氨酶和谷草转氨酶的活性可作为反映肝功能的重要指标。在本试验中,当SPC替代鱼粉水平不超过40%时,血清谷丙转氨酶和谷草转氨酶活性与对照组间差异不显著,但当SPC替代鱼粉水平为60%时,血清谷丙转氨酶活性显著高于对照组。这一结果表明当SPC替代鱼粉水平不超过40%时,未造成鱼体肝脏损伤,这可能是由于SPC中含有的抗营养因子含量极低,从而减小了对肝功能的影响。有研究发现,添加过多的豆粕会导致军曹鱼肝脏受损,引发功能性障碍[45]。植物蛋白质源中的抗营养因子可能是造成免疫指标变化的主要原因[46]。当SPC替代鱼粉水平为60%时可能是因为高水平的SPC替代鱼粉使得氨基酸代谢增强,产生更多的代谢废物,造成肝脏的负担,从而导致血清谷丙转氨酶活性的上升。关于这方面的原因还有待进一步的探究。
3.4 SPC替代鱼粉对黄颡鱼抗氧化酶活性的影响
超氧化物歧化酶和过氧化氢酶是生物防御体系中的关键酶,分别可以清除生物体内的超氧阴离子、过氧化氢,减少自由基对机体的危害,从而反映了鱼体的抗应激能力,丙二醛是机体内自由基作用于脂肪发生过氧化反应的氧化终产物,具有细胞毒性[47],其含量可反映机体中脂质过氧化程度以及细胞的损伤程度[48]。本试验中,SPC替代鱼粉水平对肝脏超氧化物歧化酶和过氧化氢酶活性以及丙二醛含量均有显著影响。当SPC替代鱼粉水平不低于20%时,肝脏超氧化物歧化酶活性显著高于对照组,肝脏过氧化氢酶活性在SPC替代鱼粉水平为20%和30%时显著高于对照组,当SPC替代鱼粉水平在10%以上时,肝脏丙二醛含量显著降低。以上结果说明,SPC替代鱼粉水平为20%和30%时显著提高了鱼体抗氧化能力。这可能与SPC中含有大豆异黄酮有关,大豆异黄酮具有抗氧化活性以及较强的超氧阴离子自由基清除作用[49]。
3.5 SPC替代鱼粉对黄颡鱼消化酶活性的影响
消化酶是检测鱼类的消化能力及饲料利用的关键酶,同种鱼类中不同部位的消化酶活性不同,其活性与食性有关[50]。淀粉酶的作用是催化淀粉水解,使得碳水化合物降解为糖,提高鱼类对碳水化合物的利用率[51]。本试验中,肠道淀粉酶活性明显高于肝脏淀粉酶活性,这与吴婷婷[52]与Hidalgo等[53]在其他鱼类中的研究结果一致。黄颡鱼属于肉食性鱼类,其淀粉酶生成的主要部位不是肝脏[54]。当SPC替代鱼粉水平为30%~60%时,肝脏淀粉酶活性低于对照组。杨英豪[9]通过组织切片观察发现,随着SPC替代鱼粉水平的提高,伴随有肠炎的发生,饲料中SPC对瓦氏黄颡鱼肝脏组织结构的破坏程度逐渐加大。所以推测在本试验中这可能是由于饲料中SPC替代鱼粉水平的提高,导致鱼体肝脏组织结构受到一定程度的破坏。试验组前肠淀粉酶活性均低于对照组,且在SPC替代鱼粉水平为10%时出现显著差异,这可能是因为饲料中SPC损害了后肠结构的稳定性,抑制了酶活性。当SPC替代鱼粉水平低于30%时,胃蛋白酶活性基本保持不变,在30%~60%时,胃蛋白酶活性下降,Lin等[55]在罗非鱼和Xu等[56]在史氏鲟中的研究显示,随豆粕替代鱼粉水平的升高蛋白酶活性降低,与本试验中的结果相似。这说明黄颡鱼的胃对SPC比较敏感,当SPC替代鱼粉水平低于30%时,黄颡鱼胃消化吸收能力受到的影响较小。今后评估植物蛋白质源替代鱼粉时,要考虑其对鱼体肝脏胃肠道等的影响机制。
4 结 论
SPC是优质的植物蛋白质源,SPC替代鱼粉水平不超过20%(对应饲料中SPC的添加量为10.72%)时,黄颡鱼生长性能、饲料利用、形态学指标、体成分、消化酶活性、总胆固醇含量变化不显著,抗氧化能力和健康状况良好,推荐在实际生产中采用该水平替代鱼粉。
[1] 白东清,吴旋,郭永军,等.长期投喂黄芪多糖对黄颡鱼抗氧化及非特异性免疫指标的影响[J].动物营养学报,2011,23(9):1622-1630.
[2] 文远红,曹俊明,黄燕华,等.黄颡鱼营养需求研究进展[J].广东农业科学,2011,38(18):108-111.
[3] ZHENG K K,ZHU X M,DONG H,et al.Effects of dietary lipid levels on growth,survival and lipid metabolism during early ontogeny ofPelteobagrusvachellilarvae.[J].Aquaculture,2010,299(1/2/3/4):121-127.
[4] DAVIS D A,ARNOLD C R,MCCALLUM I.Nutritional value of feed peas (Pisum sativum) in practical diet formulations forLitopenaeusvannamei[J].Aquaculture Nutrition,2015,8(2):87-94.
[5] CHENG Z Y,AI Q H,MAI K S,et al.Effects of dietary canola meal on growth performance,digestion and metabolism of Japanese seabass,Lateolabraxjaponicus[J].Aquaculture,2010,305(1/2/3/4):102-108.
[6] LUO L,XUE M,WU X,et al.Partial or total replacement of fishmeal by solvent-extracted cottonseed meal in diets for juvenile rainbow trout (Oncorhynchusmykiss)[J].Aquaculture Nutrition,2010,12(6):418-424.
[7] ROBINSON E H,TIERSCH T R.Effects of long-term feeding of cottonseed meal on growth,testis development,and sperm motility of male channel catfishIctaluruspunctatusbroodfish[J].Journal of the World Aquaculture Society,1995,26(4):426-431.
[8] CHENG Z J,HARDY R W.Apparent digestibility coefficients and nutritional value of cottonseed meal for rainbow trout (Oncorhynchusmykiss)[J].Aquaculture,2002,212(1/2/3/4):361-372.
[9] 杨英豪.大豆浓缩蛋白对瓦氏黄颡鱼幼鱼摄食、生长、消化和蛋白质代谢的影响[D].硕士学位论文.青岛:中国海洋大学,2011.
[10] 李二超,陈立侨,彭士明,等.大豆浓缩蛋白作为水产饲料蛋白源的评价[J].水产养殖,2005,26(1):18-20.
[11] LUSAS E W,RIAZ M N.Soy protein products:processing and use[J].The Journal of Nutrition,1995,125(3 S):573S-580S.
[12] 刘兴旺,艾庆辉,麦康森,等.大豆浓缩蛋白替代鱼粉对大菱鲆摄食、生长及体组成的影响[J].水产学报,2014,38(1):91-98.
[13] 杨英豪.大豆浓缩蛋白调控瓦氏黄颡鱼幼鱼摄食和蛋白质代谢的研究[D].博士学位论文.青岛:中国海洋大学,2014.
[14] STOREBAKKEN T,REFSTIE S,RUYTER B.Soy products as fat and protein sources in fish feeds for intensive aquaculture[J].Soy in Animal Nutrition,2000:127-170.
[15] 李林桂,肖伟伟,葛梦兰.大豆浓缩蛋白的生产工艺、营养组成及在动物日粮中的应用[J].饲料工业,2015,36(S1):29-32.
[16] DENG J M,MAI K S,AI Q H,et al.Effects of replacing fish meal with soy protein concentrate on feed intake and growth of juvenile Japanese flounder,Paralichthysolivaceus[J].Aquaculture,2006,258(1/2/3/4):503-513.
[17] USTAOGLU S,RENNERT B.The apparent nutrient digestibility of diets containing fish meal or isolated soy protein in sterlet (Acipenserruthenus)[J].International Review of Hydrobiology,2002,87(5/6):577-584.
[18] ROMARHEIM O H,SKREDE A,GAO Y L,et al.Comparison of white flakes and toasted soybean meal partly replacing fish meal as protein source in extruded feed for rainbow trout (Oncorhynchusmykiss)[J].Aquaculture,2006,256(1/2/3/4):354-364.
[19] 刘伟,文华,蒋明,等.大豆浓缩蛋白对中华鲟幼鱼生长、血脂和体成分的影响研究[J].淡水渔业,2010,40(4):27-32.
[20] 黄文文,李弋,周歧存.不同品质鱼粉对黄颡鱼幼鱼生长性能、饲料利用及肝脏抗氧化能力的影响[J].动物营养学报,2015,27(12):3744-3753.
[21] ARAGAO C,LEC C,DIAS J,et al.Soy protein concentrate as a protein source for Senegalese sole (SoleasenegalensisKaup 1858) diets:effects on growth and amino acid metabolism of postlarvae.[J].Aquaculture Research,2004,34(15):1443-1452.
[22] SALZE G,MCLEAN E,BATTLE P R,et al.Use of soy protein concentrate and novel ingredients in the total elimination of fish meal and fish oil in diets for juvenile cobia,Rachycentroncanadum[J].Aquaculture,2010,298(3/4):294-299.
[23] KAUSHIK S J,CRAVEDI J P,LALLES J P,et al.Partial or total replacement of fish meal by soybean protein on growth,protein utilization,potential estrogenic or antigenic effects,cholesterolemia and flesh quality in rainbow trout,Oncorhynchusmykiss[J].Aquaculture,1995,133(3/4):257-274.
[24] KISSINGER K R,GARCA-ORTEGA A,TRUSHENSKI J T.Partial fish meal replacement by soy protein concentrate,squid and algal meals in low fish-oil diets containingSchizochytriumlimacinum,for longfin yellowtailSeriolarivoliana[J].Aquaculture,2016,452:37-44.
[25] KISSIL G W,LUPATSCH I,HIGGS D A,et al.Dietary substitution of soy and rapeseed protein concentrates for fish meal,and their effects on growth and nutrient utilization in gilthead seabreamSparusaurataL[J].Aquaculture Research,2000,31(7):595-601.
[26] AI Q H,XIE X J.Effects of replacement of fish meal by soybean meal and supplementation of methionine in fish meal/soybean meal-based diets on growth performance of the southern catfishSilurusmeridionalis[J].Journal of the World Aquaculture Society,2010,36(4):498-507.
[28] BAEVERFJORD G,KROGDAHL A.Development and regression of soybean meal induced enteritis in Atlantic salmon,SalmosalarL.,distal intestine:a comparison with the intestines of fasted fish[J].Journal of Fish Diseases,2010,19(5):375-387.
[29] BUREAU D P,HARRIS A M,CHO C Y.The effects of purified alcohol extracts from soy products on feed intake and growth of chinook salmon (Oncorhynchustshawytscha) and rainbow trout (Oncorhynchusmykiss)[J].Aquaculture,1998,161(1/2/3/4):27-43.
[30] STOREBAKKEN T,SHEARER K D,ROEM A J.Availability of protein,phosphorus and other elements in fish meal,soy-protein concentrate and phytase-treated soy-protein-concentrate-based diets to Atlantic salmon,Salmosalar[J].Aquaculture,1998,161(1/2/3/4):365-379.
[31] NAHASHON S N,KILONZO-NTHENGE A K.Advances in soybean and soybean by-products in monogastric nutrition and health[M]//EL-SHEMY H.Soybean and nutrition.[S.l.]:InTech.,2011.
[32] ELANGOVAN A,SHIM K F.The influence of replacing fish meal partially in the diet with soybean meal on growth and body composition of juvenile tin foil barb (Barbodesaltus)[J].Aquaculture,2000,189(1/2):133-144.
[33] WANG C F,XIE S Q,ZHU X M,et al.Effects of age and dietary protein level on digestive enzyme activity and gene expression ofPelteobagrusfulvidracolarvae[J].Aquaculture,2006,254(1/2/3/4):554-562.
[35] ANDERSEN D E,REID S D,MOON T W,et al.Metabolic effects associated with chronically elevated cortisol in rainbow trout (Oncorhynchusmykiss)[J].Canadian Journal of Fisheries & Aquatic Sciences,1993,48(9):1811-1817.
[36] DIAS J,ALVAREZ M J,ARZEL J,et al.Dietary protein source affects lipid metabolism in the European seabass (Dicentrarchuslabrax)[J].Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology,2005,142(1):19-31.
[37] CHENG Z J,HARDY R W.Protein and lipid sources affect cholesterol concentrations of juvenile Pacific white shrimp,Litopenaeusvannamei(Boone)[J].Journal of Animal Science,2004,82(4):1136-1145.
[38] GOULDING N J,GIBNEY M J,TAYLOR T G,et al.Reversible hypercholesterolaemia produced by cholesterol-free fish meal protein diets[J].Atherosclerosis,1983,49(2):127-137.
[39] KAUSHIK S J,COVS D,DUTTO G,et al.Almost total replacement of fish meal by plant protein sources in the diet of a marine teleost,the European seabass,Dicentrarchuslabrax[J].Aquaculture,2004,230(1/2/3/4):391-404.
[40] HOSSAIN M A,FOCKEN U,BECKER K.Antinutritive effects of galactomannan-rich endosperm of Sesbania (Sesbaniaaculeata) seeds on growth and feed utilization in tilapia,Oreochromisniloticus[J].Aquaculture Research,2015,34(13):1171-1179.
[41] HANSEN A C,ROSENLUND G,KARLSEN Ø,et al.Total replacement of fish meal with plant proteins in diets for Atlantic cod (GadusmorhuaL.) Ⅰ-Effects on growth and protein retention[J].Aquaculture,2007,272(1/2/3/4):599-611.
[42] 林小植,罗毅平,谢小军.饲料碳水化合物水平对南方鲇幼鱼餐后糖酵解酶活性及血糖浓度的影响[J].水生生物学报,2006,30(3):304-310.
[43] 成艳波,张月星,董智勇,等.小麦蛋白替代鱼粉及大豆蛋白对日本黄姑鱼(Nibeajaponica)和黑鲷(Sparusmacrocephalus)血清生化指标及肝脏抗氧化指标的影响[J].渔业科学进展,2017,38(3):106-114.
[44] 冯建,王萍,何娇娇,等.大豆浓缩蛋白替代鱼粉对大黄鱼幼鱼生长、体成分、血清生化指标及肝组织学的影响[J].中国水产科学,2017,24(2):268-277.
[45] 王广军,吴锐全,谢骏,等.军曹鱼饲料中用豆粕代替鱼粉的研究[J].大连海洋大学学报,2005,20(4):304-307.
[46] 于晓彤.不同蛋白源对草鱼摄食反应、免疫应答及肉质的影响研究[D].硕士学位论文.北京:中国农业科学院,2016.
[47] 付晶晶,黄燕华,曹俊明,等.五种植物蛋白源替代鱼粉对花鲈血清生化指标、转氨酶活性及抗氧化应激参数的影响[J].湖北农业科学,2015,54(20):5087-5091,5095.
[48] 周显青,梁洪蒙.拥挤胁迫下小鼠肝脏脂质过氧化物含量和抗氧化物酶活性的变化[J].动物学研究,2003,24(3):238-240.
[49] 石冬冬.大豆异黄酮的提取纯化工艺及其抗氧化性的研究[D].硕士学位论文.哈尔滨:东北农业大学,2002.
[50] 钱曦,王桂芹,周洪琪,等.饲料蛋白水平及豆粕替代鱼粉比例对翘嘴红鲌消化酶活性的影响[J].动物营养学报,2007,19(2):182-187.
[51] 吴莉芳,秦贵信,赵元,等.饲料中去皮豆粕替代鱼粉比例对草鱼消化酶活力的影响[J].中国畜牧杂志,2010,46(1):23-27.
[52] 吴婷婷,朱晓鸣.鳜鱼、青鱼、草鱼、鲤、鲫、鲢消化酶活性的研究[J].中国水产科学,1994,1(2):10-17.
[53] HIDALGO M C,UREA E,SANZ A.Comparative study of digestive enzymes in fish with different nutritional habits.Proteolytic and amylase activities[J].Aquaculture,1999,170(3/4):267-283.
[54] AGRAWAL V P,SASTRY K V,KAUSHAB S K.Digestive enzymes of three teleost fishes[J].Acta Physiologica Academiae Scientiarum Hungaricae,1975,46(2):93-98.
[55] LIN S M,LUO L.Effects of different levels of soybean meal inclusion in replacement for fish meal on growth,digestive enzymes and transaminase activities in practical diets for juvenile tilapia,Oreochromisniloticus×O.aureus[J].Animal Feed Science and Technology,2011,168(1/2):80-87.
[56] XU Q Y,WANG C A,ZHAO Z G,et al.Effects of replacement of fish meal by soy protein isolate on the growth,digestive enzyme activity and serum biochemical parameters for juvenile Amur sturgeon (Acipenserschrenckii)[J].Asian-Australasian Journal of Animal Sciences,2012,25(11):1588-1594.
*Corresponding author, professor, E-mail: zhouqicun@nbu.edu.cn

