复合益生菌制剂对肉鸡生长性能、屠宰性能和免疫指标的影响
谢文惠 姜 宁 张爱忠
(黑龙江八一农垦大学动物科技学院,大庆 163319)
随着人们生活质量的持续提高,畜牧业的发展也逐渐提升,畜禽产品的安全问题也受到了普遍重视。由于我国畜禽养殖生产中抗生素、化学药物、激素等大量且不合理的使用,使畜禽产品的安全生产受到严重破坏[1]。益生菌制剂是一种由活体微生物制成的新式生物活性制剂,主要包括乳酸菌类、芽孢杆菌类、酵母类和肠球菌类。其中枯草芽孢杆菌能分泌多种肽类及由肽类衍生的抗菌活性物质[2],枯草芽孢杆菌抗菌肽是采用蝇蛆抗菌肽的基因片段,通过重叠延伸聚合酶链式反应(SOEing PCR)法融合到枯草芽孢杆菌工程菌中表达出的新型抗菌肽[3]。李渤南等[4]在饲粮中添加不同剂量由短小芽孢杆菌、植物乳酸杆菌、酵母菌等组成的复合益生菌制剂,发现肉鸡的料重比、死亡率和淘汰率显著降低,肉鸡的屠宰性能无显著变化。吕英等[5]研究发现,雏鸡饲喂益生素后法氏囊和脾脏免疫球蛋白G(IgG)、免疫球蛋白M(IgM)和免疫球蛋白A(IgA)生成细胞数量均比未饲喂益生素有不同程度的增加,表明益生素能够增强雏鸡免疫器官的体液免疫功能。关静姝等[6]研究发现,饲粮中添加益生菌和抗菌肽复合物能显著增加肉鸡的生长性能、免疫性能,降低禽舍氨气和硫化氢浓度,降低肉鸡的死淘率。目前有关单独使用益生菌或抗菌肽的研究较多,但未见益生菌与含有抗菌肽的基因工程菌联合使用于肉鸡生产的报道。因此,本试验以益生菌和含有抗菌肽的基因工程菌为试验材料,将前期人工模拟胃肠道消化液耐受性试验所确定的3种不同配比复合益生菌制剂分别加入到爱拨益加(AA)肉鸡饲粮中,观察其对肉鸡生长性能、屠宰性能和免疫指标的影响,探寻最佳复合益生菌制剂配比,为复合益生菌制剂在肉鸡产业链中的现实推广应用提供数据参考。
1 材料与方法
1.1 试验设计与试验材料
本试验采用单因素完全随机设计,选用320只1日龄健康雄性AA肉仔鸡(购自吉林省德惠市某孵化场),随机分为4组,每组4个重复,每个重复20只鸡。各组试验鸡初始体重无显著差异(P>0.05)。对照组(Ⅰ组)饲喂基础饲粮,Ⅱ、Ⅲ和Ⅳ组饲粮分别在基础饲粮中添加1 000 mg/kg配比为2∶1∶1∶1、1∶2∶1∶1和1∶1∶1.5∶1.5(枯草芽孢杆菌∶酿酒酵母∶嗜酸乳杆菌∶乳双歧杆菌)的复合益生菌制剂。试验期42 d。
本试验所用复合益生菌制剂均为固体粉末,主要由枯草芽孢杆菌、酿酒酵母、嗜酸乳杆菌和乳双歧杆菌混合组成,总活菌数为枯草芽孢杆菌9.00×108CFU/g、酿酒酵母4.00×108CFU/g、嗜酸乳杆菌1.00×1010CFU/g、乳双歧杆菌1.00×1010CFU/g。枯草芽孢杆菌、酿酒酵母和嗜酸乳杆菌均为本实验室制备,其中枯草芽孢杆菌为本实验室所研发的含有抗菌肽CC34的基因工程菌;乳双歧杆菌由陕西森弗生物技术有限公司提供。
1.2 试验饲粮
基础饲粮依照NRC(1994)肉鸡饲养标准,并结合我国《鸡饲养标准》(NY/T 33—2004)配制,饲料原料购于大庆禾丰八一农大动物科技有限公司,饲粮形态为粉状,由本实验室粉碎及搅拌混合而成,基础饲粮组成及营养水平见表1。
1.3 饲养管理
进雏鸡前对鸡舍进行无死角冲洗、消毒。由于是在春季进行饲养试验,鸡舍进雏前2 d开始预热升温。进雏鸡后2 h内,采用低浓度葡萄糖水溶液(5%)进行开饮,水温适中。采用笼养方式,1~21日龄饲养密度为20只/m2,22~42日龄饲养密度为10只/m2,自由饮水和自由采食。舍内温度、湿度和光照时间按照常规饲养管理要求进行严格控制,保证良好通风。每天换水前对水槽进行清洗和杀菌消毒,试验期间饮用凉开水。按常规免疫程序对雏鸡进行新城疫及法氏囊免疫。
1.4 测定指标与方法
1.4.1 生长性能
试验期间每周按重复记录饲粮用量,于1、7、14、21、28、35和42日龄早08:00对空腹12 h(自由饮水)后的肉鸡称重,记录每周每重复肉鸡的体重和采食量,计算各阶段肉鸡的平均日采食量(ADFI,g)、平均日增重(ADG,g)和料重比(F/G)。

表1 基础饲粮组成及营养水平(风干基础)
1)每千克矿物质预混料含 One kg of mineral premix provided the following: Cu (CuSO4·5H2O) 8 mg,Fe (FeSO4·7H2O) 50 mg,Zn (ZnSO4·7H2O) 45 mg,Mn (MnSO4·H2O) 65 mg,Se (Na2SeO3) 1 mg,Ca(IO3)21 mg,Ca3(PO4)20.2 mg。
2)每千克多维含 One kg of multi-vitamin provided the following: VA 40 000 000 IU,VD311 000 000 IU,VE 80 000 IU,VK312 g,VB110 g,VB222 g,VB615 g,VB12100 mg,叶酸 folic acid 4 g,生物素 biotin 300 mg,烟酰胺 niacinamide 100 g,泛酸钙 pantothenic acid 50 g,抗氧化剂 antioxidant 500 mg。
3)营养水平为计算值。Nutrition levels were calculated values.
1.4.2 屠宰性能
于42日龄时从每重复中随机选取3只体重相近的健康肉鸡,屠宰前12 h停饲,自由饮水,空腹称重,按常规方法屠宰。计算各组肉鸡的屠宰性能指标,公式如下:
屠宰率(%)=(屠体重/活体重)×100;半净膛率(%)=(半净膛重/活体重)×100;全净膛率(%)=(全净膛重/活体重)×100;胸肌率(%)=(两侧胸肌重/全净膛重)×100;腿肌率(%)=(两侧腿肌重/全净膛重)×100。
1.4.3 免疫指标
分别于21和42日龄时从每个重复中随机选取3只肉鸡,心脏采集血样5 mL,经3 000 r/min离心10 min,分离血清于1.5 mL离心管中,-20 ℃冷冻保存备测。采血结束后将肉鸡宰杀,分别摘取脾脏、胸腺和法氏囊称重,用免疫器官重量占体重的相对重量表示免疫器官指数(g/kg BW)。采用酶联免疫吸附试验(ELISA)法测定血清中IgG和IgA含量,试剂盒购自苏州卡尔文生物科技有限公司。
1.5 数据统计与分析
本试验生长性能指标以重复为单位,每组共4个平均值进行统计分析;屠宰性能指标和免疫指标以每组12个样本进行统计分析。数据经Excel 2007初步统计与整理,运用SAS 8.0软件进行单因素方差分析(one-way ANOVA),差异显著者运用Duncan氏法进行多重比较,结果均以“平均值±标准差”表示。P<0.05为差异显著。
2 结果与分析
2.1 复合益生菌制剂对肉鸡生长性能的影响
复合益生菌制剂对肉鸡平均日采食量的影响见表2。1~14日龄和36~42日龄时,各组的平均日采食量无显著差异(P>0.05);15~21日龄时,Ⅲ组的平均日采食量显著高于其他各组(P<0.05);22~28日龄时,Ⅲ和Ⅳ组的平均日采食量显著高于其他各组(P<0.05);29~35日龄时,Ⅱ、Ⅲ和Ⅳ组的平均日采食量均显著高于Ⅰ组(P<0.05)。综观1~42日龄,Ⅲ组的平均日采食量最高,与Ⅳ组无显著差异(P>0.05),2者均显著高于Ⅰ组(P<0.05)。
复合益生菌制剂对肉鸡平均日增重的影响见表2。1~7日龄时,各组的平均日增重无显著差异(P>0.05);8~42日龄时,Ⅲ组的平均日增重显著高于Ⅰ和Ⅳ组(P<0.05),其中15~21日龄时,Ⅱ和Ⅲ组的平均日增重无显著差异(P>0.05)。综观1~42日龄,Ⅲ组的平均日增重最高,显著高于Ⅰ、Ⅱ和Ⅳ组(P<0.05),分别增加了21.46%、7.98%和9.97%。
复合益生菌制剂对肉鸡料重比的影响见表2。1~7和29~35日龄时,各组的料重比无显著差异(P>0.05);8~14和36~42日龄时,Ⅲ组的料重比显著低于其他各组(P<0.05);15~21日龄时,Ⅲ和Ⅳ组的料重比显著高于其他各组(P<0.05);22~28日龄时,Ⅱ和Ⅲ组的料重比显著低于Ⅰ和Ⅳ组(P<0.05)。综观1~42日龄,Ⅱ和Ⅲ组的料重比无显著差异(P>0.05),其中Ⅲ组的料重比最低,显著低于Ⅰ和Ⅳ组(P<0.05),分别降低了9.25%和7.10%。
2.2 复合益生菌制剂对肉鸡屠宰性能的影响
复合益生菌制剂对肉鸡屠宰性能的影响见表3。Ⅱ、Ⅲ和Ⅳ组的屠宰率、半净膛率和全净膛率与Ⅰ组相比均有不同程度的提高,但差异不显著(P>0.05);Ⅲ和Ⅳ组的胸肌率显著高于Ⅰ组(P<0.05),分别提高了4.11%和4.60%;各组的腿肌率无显著差异(P>0.05),其中Ⅳ组的腿肌率最高,与Ⅰ、Ⅱ和Ⅳ组相比分别提高了4.25%、4.52%和4.30%。
2.3 复合益生菌制剂对肉鸡免疫指标的影响
复合益生菌制剂对肉鸡免疫器官指数的影响见表4。在21和42日龄时,各组的脾脏指数、胸腺指数和法氏囊指数均无显著差异(P>0.05),但Ⅱ、Ⅲ和Ⅳ组均高于Ⅰ组。
复合益生菌制剂对肉鸡血清IgG和IgA含量的影响见表4。21日龄和42日龄时,各组的血清IgG含量无显著差异(P>0.05),其中Ⅲ组的血清IgG含量最高,与Ⅰ、Ⅱ和Ⅳ组相比,21日龄时分别提高了48.54%、21.24%和6.05%,42日龄时分别提高了50.64%、25.46%和22.54%。21日龄时,Ⅱ、Ⅲ和Ⅳ组的血清IgA含量无显著差异(P>0.05),其中Ⅲ组的血清IgA含量最高,显著高于Ⅰ组(P<0.05),提高了93.88%;42日龄时,Ⅲ组的血清IgA含量显著高于Ⅰ、Ⅱ和Ⅳ组(P<0.05),分别提高了63.83%、42.59%和30.51%。
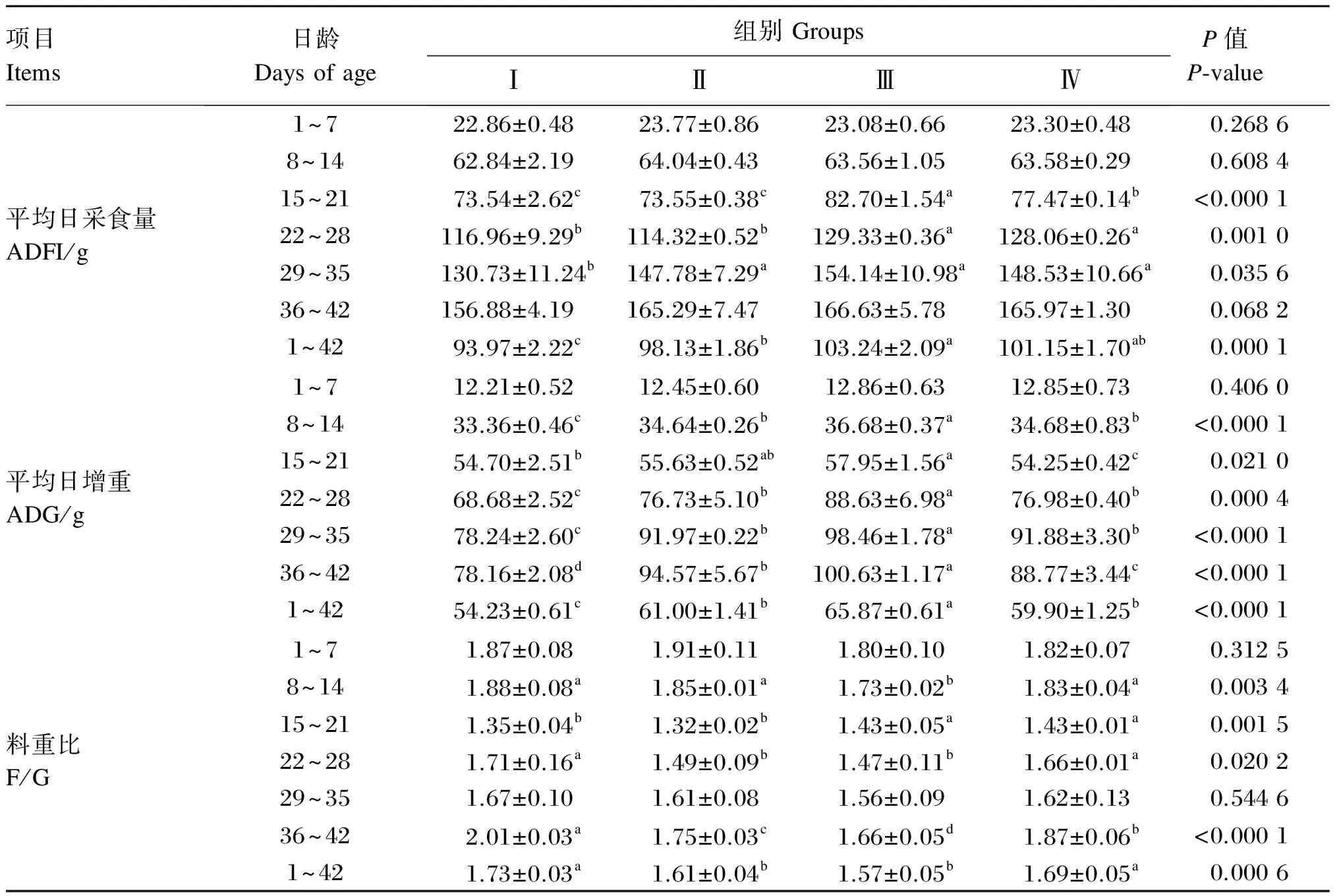
表2 复合益生菌制剂对肉鸡生长性能的影响
同行数据肩标相同或无字母表示差异不显著(P>0.05),不同字母表示差异显著(P<0.05)。下表同。
In the same row, values with the same or no letter superscripts mean no significant difference (P>0.05), while with different letter superscripts mean significant difference (P<0.05). The same as below.

表3 复合益生菌制剂对肉鸡屠宰性能的影响
3 讨 论
3.1 复合益生菌制剂对肉鸡生长性能的影响
复合益生菌制剂和抗菌肽均有改善机体性能、促进动物生长发育和提高饲料转化率等功能[7]。本试验使用的复合益生菌制剂由枯草芽孢杆菌(含抗菌肽CC34的基因工程菌)、酿酒酵母、嗜酸乳杆菌和乳双歧杆菌混合组成。枯草芽孢杆菌为需氧菌,且大多数为有益菌,其主要通过减少肠道内的游离氧进而抑制有害需氧菌的繁殖[8],为乳酸菌和双歧杆菌等有益专性厌氧菌提供无氧的有利环境。枯草芽孢杆菌的细胞膜为单层,分泌的抗菌肽容易回收、纯化,操作简便[9];还能产生脂肪酶、蛋白酶和淀粉酶等多种消化酶,生成纤维素酶和葡聚糖酶等非淀粉多糖酶[10],这些酶能够分解饲粮中的多种营养物质,为有益菌供应丰富的转化基质。酵母菌具备发酵特性,可以促进消化,加快有益菌的生长;酵母菌菌体含有丰富的蛋白质、脂肪、糖分和B族维生素等,能被芽孢杆菌产生的消化酶消化吸收,为机体提供大量的营养物质;且酵母菌能够补充硒元素,增加机体的免
疫力[11]。乳酸菌和双歧杆菌能合成动物体所需的维生素,还可以将碳水化合物转化为乳酸、醋酸、丙酸和丁酸等有机酸,使饲粮和动物肠道中的pH下降,激活动物肠道中的胰蛋白酶、淀粉酶、脂肪酶和总蛋白水解酶等消化酶,促进排泄,抑制肠道腐败作用[12]。
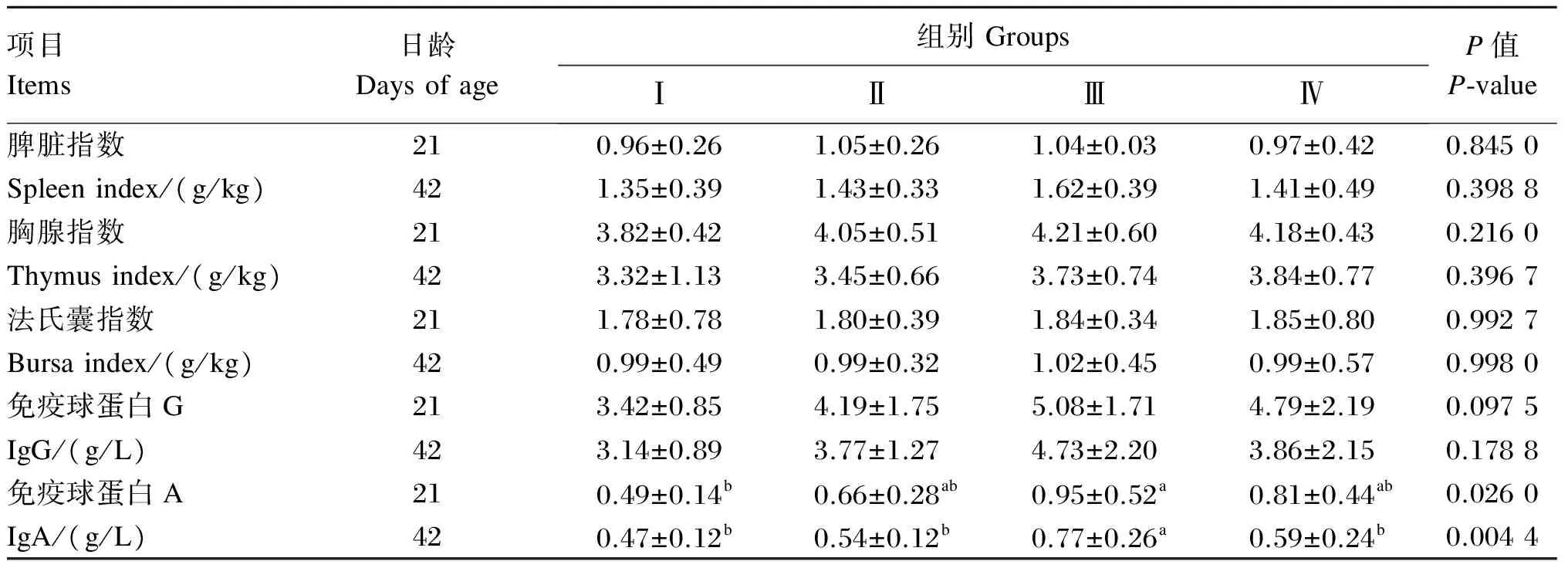
表4 复合益生菌制剂对肉鸡免疫指标的影响
黄金华等[13]研究发现,饲粮中添加0.1%和0.2%由植物乳杆菌、嗜酸乳杆菌、地衣芽胞杆菌、枯草芽胞杆菌、蜡样芽胞杆菌和酿酒酵母组成的复合益生菌制剂,能显著增加肉鸡的平均日增重和成活率,使料重比大幅度下降,其中以0.1%组的综合效果最好。本试验结果表明,饲粮中添加不同配比复合益生菌制剂后,1~7日龄时,各组肉鸡的平均日采食量、平均日增重和料重比均无显著差异,这可能是由于肉鸡经过长途运输产生了应激,且生长前期消化系统尚未发育完全,消化吸收功能较差,需要一段时间来适应环境和饲粮的变化,且外源益生菌在动物肠道内的定植也需要一定的时间。本试验所用的含抗菌肽CC34的基因工程菌为菌粉制剂,而此基因工程菌为胞外分泌型,需要在肠道内复苏且经过一段时间才能分泌抗菌肽,促进肉仔鸡的生长发育。通常情况下,第1周的料重比最低,随着周龄的增加而提高。本试验前2周的料重比较高,其原因可能是雏鸡体型较小,前期采用的饲槽为食料桶,放置在鸡笼当中,因为禽类具有刨食的习性,饲粮浪费较严重,导致料重比较高;第3周开始采用挂式饲槽,饲粮浪费减少,料重比降低。综观1~42日龄整个试验期,与对照组相比,Ⅱ、Ⅲ和Ⅳ组肉鸡的平均日采食量和平均日增重显著增加,料重比降低,这可能是由于肉鸡在适应环境和饲粮之后,复合益生菌、含有抗菌肽的基因工程菌以及其所产生的各种代谢产物和抗菌肽有助于消化利用饲粮中的养分,改善肠道内微生态环境,促进肉鸡的健康生长,从而提高了肉鸡的生长性能。其中Ⅲ组的效果最好,这可能是因为添加比例为2倍的酿酒酵母,其自身带有特殊的芬芳香味,能够刺激动物的嗅觉,增进食欲,从而提高平均日采食量;酵母菌还有增强肠黏膜屏障功能、下调黏膜通透性和提高肠黏膜营养的作用[14],能够促进肉鸡对营养物质的消化和利用,提高肉鸡的生长性能。
3.2 复合益生菌制剂对肉鸡屠宰性能的影响
屠宰率、胸肌率和腿肌率是评价肉鸡产肉性能的重要指标,也是评价肉鸡屠宰性能的关键[15]。陆银等[16]研究表明,复合益生菌能够提高21~35日龄肉鸡的屠宰率、腿肌率和胸肌率,并且呈剂量依赖效应。本试验中,饲粮中添加复合益生菌制剂可以改善肉鸡的屠宰性能,不同程度地提高半净膛率、全净膛率、屠宰率、胸肌率和腿肌率,这可能是因为抗菌肽在促进肉鸡生长发育的同时,对营养物质在肌肉中的沉积起到了一定的调节作用;且添加的4株益生菌均可提高肉鸡自身蛋白质的合成,在胃肠道通过发酵饲粮和菌体代谢均可产生不同种类的短链脂肪酸,从而提高肉鸡的屠宰性能。其中Ⅳ组添加比例为1.5倍的乳酸菌,与对照组相比,提高了肉仔鸡的胸肌率和腿肌率,其具体作用机理还需进一步研究,这与郭元晟[17]的试验结果相一致。
3.3 复合益生菌制剂对肉鸡免疫指标的影响
免疫器官是免疫细胞发育、增殖和分化的场所,免疫器官的发育情况以及功能的强弱对禽类的免疫水平起着决定性的作用,所以免疫器官指数是反映禽类机体免疫水平的可靠指标[18]。禽类的免疫器官主要包括脾脏、胸腺和法氏囊[19]。郭欣怡等[20]研究发现,肉鸡饲粮中添加乳酸菌、丁酸菌和复合菌,随着肉鸡日龄的增加和益生菌的连续应用,其作用越来越显著。本试验研究发现,饲粮中添加不同配比复合益生菌制剂对肉鸡的免疫器官指数无显著影响,但具有改善免疫器官指数的趋势,与林谦等[21]报道的益生菌对黄羽肉鸡胸腺、脾脏和法氏囊等免疫器官指数均无显著影响的结果相一致。
血清免疫球蛋白含量是反映动物机体免疫功能变化的重要标志[22]。IgG的主要作用是介导体液免疫,禽类血清中的IgG具有抗细菌、病毒、外毒素等多种活性功能,尤其在体液免疫中具有重要的作用[23]。IgA的主要作用是参与黏膜局部免疫,通过与相应病原微生物结合,阻止病原体黏附到细胞表面,在局部抗感染中发挥作用[24]。谢全喜等[25]研究指出,添加适量复合微生态制剂可以提高肉鸡血清IgG含量,提高盲肠内容物分泌型免疫球蛋白A(sIgA)含量,增强新城疫血凝抑制抗体效价水平,最终增强其机体免疫力。王佳丽等[26]报道,复合益生菌可显著提高21日龄肉鸡的胸腺和法氏囊指数以及42日龄肉鸡的胸腺指数,显著提高21日龄肉鸡的血清IgG含量和42日龄肉鸡的血清IgA含量,显著提高21日龄肉鸡的外周血T淋巴细胞增殖功能。本试验研究发现,21和42日龄时,复合益生菌制剂可以提高肉鸡血清免疫球蛋白含量,其中Ⅲ组效果最好,原因可能是酵母菌含有丰富的蛋白质、B族维生素和氨基酸等生理活性物质,能够增强畜禽的抗病能力,但添加2倍酿酒酵母只是因素之一。尽管益生菌具有较好的免疫调节作用,但并不是所有的有益菌群对动物的免疫防御系统都有促进作用。本试验中采用的复合益生菌制剂为益生菌和含有抗菌肽的基因工程菌以不同比例混合而成的制剂,各菌种之间可能存在相互协同作用,由于这方面的研究较少,其具体作用机理还需后续试验验证。
4 结 论
饲粮中添加不同配比复合益生菌制剂可不同程度提高肉鸡的生长性能,改善屠宰性能,提高血清免疫球蛋白含量,其中以添加1 000 mg/kg配比为1∶2∶1∶1(枯草芽孢杆菌∶酿酒酵母∶嗜酸乳杆菌∶乳双歧杆菌)复合益生菌制剂的效果最好。
[1] KAFSHDOUZAN K,ROUZBEHAN B,MOSLEMY M.Reviewing the role of probiotics used in poultry feeding on health promotion of chicken meet[J].Iranian Journal of Nutrition Sciences & Food Technology,2013,7(5):821-828.
[2] 赵朋超,王建华,权春善,等.枯草芽孢杆菌抗菌肽生物合成的研究进展[J].中国生物工程杂志,2010,30(10):108-113.
[3] 黄福佳.WB800N-CC31工程菌发酵产物对大鼠生长、消化、肠道菌群及免疫的影响[D].硕士学位论文.大庆:黑龙江八一农垦大学,2016.
[4] 李渤南,由佳,王曙光,等.肉鸡饲粮添加复合益生菌制剂应用效果分析[J].中国家禽,2016(5):50-53.
[5] 吕英,刘家福,郑世民.雏鸡应用益生素后免疫器官体液免疫动态变化[J].中国预防兽医学报,2009,31(4):305-309.
[6] 关静姝,董经勇,张江.益生菌和抗菌肽复合物对肉鸡生产性能及免疫性能的影响[J].饲料博览,2016(3):19-22.
[7] 唐志刚,钱巧玲,侯晓莹,等.益生菌的作用机理及其在肉鸡和蛋鸡中的应用[J].家畜生态学报,2010,31(2):5-8.
[8] KOMPIANG I P.Effect of yeast:saccharomyces cerevisiae and marine yeast as probiotic supplement on performance of poultry[J].Indonesian Journal of Animal & Veterinary Science,2014,7(1):18-21.
[9] BONGERS R S,VEENING J W,VAN WIERINGEN M,et al.Development and characterization of a subtilin-regulated expression system inBacillussubtilis:strict control of gene expression by addition of subtilin[J].Applied and Environmental Microbiology,2005,71(12):8818-8824.
[10] 古从伟,姜荣华,王博,等.益生芽孢杆菌抗感染的作用机理[J].中国畜牧兽医文摘,2011,27(4):194-195.
[11] 华均超,张邦辉.微生态制剂对仔猪肠道微生态调控的研究与应用进展[J].中国饲料,2011(3):19-22.
[12] 白耀辉.肉仔鸡生产中复合微生态制剂与抗生素联用效果研究[D].硕士学位论文.呼和浩特:内蒙古农业大学,2011.
[13] 黄金华,李泰佑,王士长,等.复合益生菌制剂对肉鸡生长性能、屠宰性能和肌肉品质的影响[J].畜牧与饲料科学,2014,35(5):30-33.
[14] 姬劲峰,熊丽丽.布拉氏酵母菌应用于肠内营养治疗的效果观察[J].数理医药学杂志,2015(7):1060-1061.
[15] 廖玉英,黄英飞,韦凤英,等.不同益生菌制剂对黄羽肉鸡生长性能不同益生菌制剂对黄羽肉鸡生长性能、屠宰性能及肉品质的影响[J].中国家禽,2014,36(23):29-32.
[16] 陆银,武旭峰,费拥军,等.复合益生菌对肉仔鸡的生长性能及屠体品质的影响[J].中国畜牧杂志,2013,49(1):50-53.
[17] 郭元晟.乳酸杆菌对肉鸡生产性能、免疫机能及肠道菌群的影响[D].博士学位论文.呼和浩特:内蒙古农业大学,2011.
[18] 郑蓓.鸡和鹌鹑β-干扰素基因的克隆、表达及免疫调节作用的研究[D].硕士学位论文.泰安:山东农业大学,2014.
[19] 王志跃,汪张贵,龚道清,等.核黄素对家禽免疫器官发育的影响[J].中国畜牧杂志,2005,40(10):28-30.
[20] 郭欣怡,张曼,韩飞,等.不同益生菌制剂对肉鸡生产性能、免疫功能和肠道菌群的影响[J].家畜生态学报,2016,37(11):79-83.
[21] 林谦,戴求仲,宾石玉,等.益生菌与酶制剂对黄羽肉鸡血液生化指标和免疫性能影响的协同效应研究[J].饲料工业,2012,33(14):31-36.
[22] 孙全友,彭翔,李杰,等.姜黄素和抗菌肽对肉仔鸡生长性能和免疫机能的影响及其互作效应研究[J].中国畜牧杂志,2014,50(17):62-67.
[23] 刘建欣,郑昌学.现代免疫学:免疫的细胞和分子基础[M].北京:清华大学出版社,2002.
[24] 涂健,吴鹏飞,柳矿里,等.复合微生态制剂对肉鸡生产性能及免疫生化指标的影响[J].中国家禽,2015,37(17):47-49.
[25] 谢全喜,崔诗法,徐海燕,等.复合微生态制剂与饲用抗生素对肉鸡生长性能、免疫性能和抗氧化指标的影响[J].动物营养学报,2012,24(7):1336-1344.
[26] 王佳丽,张玉科.复合益生菌对肉仔鸡免疫功能的影响[J].饲料研究,2013(8):65-67.
*Corresponding author, professor, E-mail: aizhzhang@sina.com

