抗菌肽Sublancin增强小鼠获得性免疫的研究
张晓雅 杨 青 王 帅 杨天任 曾祥芳 谯仕彦
(中国农业大学动物科技学院,北京 100193)
抗菌肽(antimicrobial peptide,AMPs)是生物体产生的一类具有生物活性的小分子多肽,广泛地存在于生物界,是机体先天性免疫防御系统的重要组成部分,构成宿主防御病原微生物入侵的第1道屏障[1-2]。抗菌肽具有广谱抗菌活性,通常广泛地作用于革兰氏阳性菌、革兰氏阴性菌、分歧杆菌和真菌,还对寄生虫和病毒具有杀伤效果,甚至可以杀死肿瘤细胞[1,3-4]。大多数抗菌肽通过破坏细菌细胞质膜的完整性发挥抗菌活性,一些抗菌肽能够穿透细胞膜并与胞内不同的靶标结合抑制细菌生长,不易产生耐药性,因此成为抗生素替代品研究的热点[3,5]。随着对抗菌肽结构和功能研究的不断深入,其免疫调节功能逐渐被研究者们所发现。抗菌肽除了具有直接抑菌活性外,还具有多种免疫调节作用,例如调节炎症反应、趋化免疫细胞、促进细胞分化、激活先天性和获得性免疫系统等[2,6]。研究表明,鱼源α-螺旋抗菌肽、鸡源β-防御素(AvBD)1~14可以提高动物的抗原特异性体液免疫和细胞免疫应答水平,提高疫苗免疫效果[7-9]。
抗菌肽Sublancin是美国马里兰大学Hansen研究团队从枯草芽孢杆菌(Bacillussubtilis)168菌株的发酵液中分离得到一种具有抑菌活性的物质,它是由37个氨基酸组成并含有2个二硫键的阳离子肽,其氨基酸序列为GLGKAQCAALWLQCASGGTIGCGGGAVACQNYRQFCR,相对分子质量约为3 875.74[10-11]。抗菌肽Sublancin的性质极其稳定,可以耐受1.5~9.5的pH,还可以在高温环境中稳定存在[12]。抗菌肽Sublancin具有抗革兰氏阳性菌活性,其抗菌谱包括巨大芽孢杆菌、金黄色葡萄球菌、化脓性链球菌、产气夹膜梭菌等,对革兰氏阴性菌无明显抑菌效果[13-15]。Paik等[13]认为抗菌肽Sublancin通过作用于细菌细胞膜合成的特定分子,使细胞膜形成孔洞,从而发挥其抗菌活性。Kouwen等[16]的研究发现,抗菌肽Sublancin的抑菌活性与其对细菌膜机械敏感性离子通道有关,抗菌肽Sublancin可能通过抑制这种离子通道的关闭,使细菌细胞内物质快速溢出,从而使细菌裂解或死亡。Wang等[14]研究发现,抗菌肽Sublancin可能通过抑制细菌的能量代谢而抑制了细菌的分裂。目前关于抗菌肽Sublancin的研究主要集中在其结构、表达调控、杀菌活性以及杀菌机制等方面,关于抗菌肽Sublancin作为一种免疫调节分子的研究还未见报道。本试验以BALB/c小鼠为模型动物,以卵清白蛋白(ovalbumin,OVA)为模式抗原,研究抗菌肽Sublancin经灌胃途径对小鼠获得性免疫反应的影响,为抗菌肽Sublancin作为免疫增强剂在动物生产中的应用提供理论依据。
1 材料与方法
1.1 试验材料
OVA:Sigma公司,美国;左旋咪唑:Sigma公司,美国;抗菌肽Sublancin:由国家饲料工程技术研究中心构建了一个新型重组质粒并将其转入枯草芽孢杆菌W800中,获得高效表达的抗菌肽Sublancin,再通过AKTA纯化系统得到纯度高达99.6%的抗菌肽Sublancin样品,将抗菌肽Sublancin溶于生理盐水,浓度分别为0.04、0.08和0.16 mg/mL,用于小鼠灌胃;RPMI-1640液体培养基:Gibco公司,美国;红细胞裂解液:Gibco公司,美国;活细胞检测试剂盒Cell Counting Kit-8(CCK-8):同仁化学研究所,日本;刀豆蛋白A(concanavalin A,ConA):Sigma公司,美国;磷酸缓冲盐溶液(phosphate buffer saline,PBS):Gibco公司,美国;胎牛血清(fetal calf serum,FBS):Hyclone公司,美国;100 U/mL青霉素以及100 μg/mL链霉素:Gibco公司,美国;牛血清白蛋白(bovine serum albumin,BSA):Sigma公司,美国;辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗小鼠的免疫球蛋白G(IgG):Arigo公司,中国台湾;HRP标记的山羊抗小鼠的IgG1、IgG2a:Abcam公司,英国;碳酸盐包被缓冲液(0.05 mol/L,pH 9.6):Na2CO31.59 g,NaHCO32.93 g,加蒸馏水至1 000 mL,磁力搅拌溶解,调pH至9.6;增强型PBS洗涤液(PBST)(0.01 mol/L,pH 7.4):NaCl 8.00 g,Na2HPO4·12H2O 2.90 g,NaH2PO40.20 g,KCl 0.20 g,Tween-20 0.5 mL,加蒸馏水至1 000 mL,磁力搅拌溶解,调pH至7.2;抗体稀释液,1% BSA:1 g BSA溶于100 mL洗涤液;封闭液,3% BSA:3 g BSA溶于100 mL洗涤液;底物缓冲液(pH 5.0):Na2HPO4·12H2O 3.68 g,柠檬酸0.933 g,加蒸馏水至100 mL;四甲基联苯胺(TMB)底物缓冲液:TMB储存液(10 mg溶于100 μL二甲基亚砜和900 μL蒸馏水)0.1 mL,底物缓冲液10 mL,30% H2O210 μL,临用前新鲜配制;终止液(2 mol/L硫酸):浓硫酸(98%)22.2 mL,蒸馏水177.8 mL;白细胞介素-2(IL-2)、干扰素-γ(IFN-γ)、白细胞介素-4(IL-4)、白细胞介素-10(IL-10)检测酶联免疫吸附测定(ELISA)试剂盒:R&D公司,美国。
1.2 试验设计与饲养管理
试验选取6周龄无特定病原体(specific pathogen free,SPF)雌性BALB/c小鼠(购自北京华阜康生物科技股份有限公司)60只,随机分为5组,每组12只小鼠。空白对照组小鼠灌胃生理盐水,阳性对照组小鼠灌胃2.5 mg/kg体重的左旋咪唑,抗菌肽Sublancin组小鼠分别灌胃0.5、1.0和2.0 mg/kg体重的抗菌肽Sublancin。各组小鼠每天灌胃0.2 mL溶液,连续灌胃14 d。灌胃结束24 h后用模式抗原OVA对各组小鼠进行首次免疫。免疫方式为背部皮下多点注射,注射剂量为100 μg/只,注射体积为0.2 mL/只。首次免疫14 d后各组小鼠分别以相同剂量和方式加强免疫1次(二次免疫)。
本试验在农业部饲料效价和安全评价监督检验测试中心(北京)鼠营养代谢室进行。小鼠饲喂在控温和控湿的房间内,温度为(22±2) ℃,相对湿度为(45±10)%。昼夜光照交替时间为12 h∶12 h的光照制度,自由采食和饮水,定期换垫料,清理鼠粪,保持鼠房清洁卫生。
1.3 样品采集
于OVA二次免疫7 d后,用眼眶采血法采集血样。用直径为1 mm左右灭菌的毛细管插入小鼠眼底,捻动玻璃针挤破眼底动脉丛,收集200~300 μL血样至1.5 mL无菌离心管中。室温静置2 h后,将血样在4 ℃条件下3 000 r/min离心10 min。之后在无菌条件下,用移液枪吸出上层淡黄色血清并分装,贮存于-80 ℃冰箱中待测。采血完成后,将小鼠颈部脱臼处死,无菌取脾脏,制备脾脏淋巴细胞悬浮液。
1.4 检测指标
1.4.1 体重
分别于灌胃前、首次免疫前、二次免疫前以及剖杀前称量小鼠的体重。
1.4.2 血清OVA特异性IgG及其亚类IgG1、IgG2a含量的检测
间接ELISA法检测小鼠血清中OVA特异性抗体IgG及其亚类IgG1、IgG2a含量。将含5 μg/mL OVA的包被液加入96孔ELISA板,100 μL/孔,4 ℃冰箱中孵育过夜。每孔加入PBST 300 μL,每次3 min,洗涤5次,拍干。加入3%的BSA封闭液,150 μL/孔,37 ℃温箱中孵育60 min。PBST洗板5次,每次3 min,加入待检血清(1∶1 000倍稀释),100 μL/孔,设2个重复,37 ℃温箱中孵育60 min。PBST洗板5次,每次3 min,加入经1∶5 000倍稀释HRP标记的山羊抗小鼠IgG,1∶10 000倍稀释的HRP标记的山羊抗小鼠IgG1或者1∶5 000倍稀释的HRP标记的山羊抗小鼠IgG2a 100 μL/孔,37 ℃温箱中孵育60 min。PBST洗板5次,每次3 min,加入TMB底物溶液显色,100 μL/孔,37 ℃避光孵育5 min。每孔加50 μL 2 mol/L硫酸终止反应,轻轻振荡混匀。立即用酶标仪测定其在450 nm波长下的吸光度(OD)值。
1.4.3 脾脏淋巴细胞增殖能力检测
小鼠脾脏淋巴细胞活性通过CCK-8活细胞检测试剂盒检测,于OVA二次免疫7 d后将小鼠颈椎脱臼处死,并用75%的乙醇浸泡3~5 min。在超净台中无菌取脾脏,置于盛有10 mL冷Hanks液的平皿中,于200目不锈钢丝网上轻辗。吸取冷3 mL Hanks液冲洗筛网,收集网下细胞注入离心管。1 000 r/min离心5 min后弃上清液。加入2 mL红细胞裂解液,重悬细胞后,裂解5 min,加3 mL Hanks液洗涤2次,1 000 r/min离心5 min后弃去上清,用1 mL 10% FBS的RPMI-1640完全培养基重悬细胞。用台盼蓝染色(1∶9体积比稀释)进行活细胞计数,保证活细胞数不低于95%,然后调整细胞浓度到2.5×106/mL。细胞悬液加入96孔板,每孔100 μL。然后在阳性对照孔加入ConA,终浓度为5 μg/mL。检测孔加入OVA,终浓度为5 μg/mL。同时设阴性对照孔(细胞和RPMI-1640培养基)和空白孔(RPMI-1640培养基)。每孔总体积为200 μL。每个样品重复3孔,于37 ℃、5% CO2培养箱中培养68 h。再将CCK-8试剂加入培养孔,每孔10 μL。于37 ℃、5% CO2的培养箱中继续培养4 h。用酶标仪测定在450 nm的OD值。计算刺激指数:
刺激指数=(各刺激孔OD值-培养基OD值)/
(未刺激孔的OD值-培养基OD值)。
1.4.4 脾脏淋巴细胞上清液细胞因子含量的检测
按照1.4.3所述方法取脾脏并制备脾脏淋巴细胞悬浮液,染色计数调整细胞浓度至5×106/mL。将细胞悬液加入96孔板,每孔100 μL。然后再在每个孔中加入100 μL OVA,终浓度为5 μg/mL。将细胞与37 ℃、5% CO2培养箱孵育48 h。孵育结束后,1 000 r/min离心10 min,轻轻吸取上层细胞培养上清液。脾脏淋巴细胞上清液中1型辅助性T细胞(T helper type 1 cell,Th1)细胞因子IFN-γ、IL-2和2型辅助性T细胞(T helper type 2 cell,Th2)细胞因子IL-4、IL-10的含量用ELISA检测试剂盒进行检测,具体步骤按照说明书进行。
1.5 统计方法
采用GraphPad Prism 6.0软件中两独立样本t检验方法对试验数据进行分析。试验结果用平均值表示,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 抗菌肽Sublancin对小鼠体重的影响
由表1可知,在生理盐水、左旋咪唑以及抗菌肽Sublancin灌胃小鼠2周后,各组小鼠的体重无显著差异(P>0.05)。在OVA首次免疫小鼠14 d和二次免疫7 d后,各组小鼠的体重无显著差异(P>0.05)。结果表明,抗菌肽Sublancin灌胃对小鼠体重没有影响。
2.2 抗菌肽Sublancin对小鼠血清OVA特异性IgG含量的影响
抗菌肽Sublancin对小鼠血清OVA特异性IgG含量的影响见图1。由图1可知,与空白对照组相比,0.5、1.0、2.0 mg/kg抗菌肽Sublancin组小鼠血清的OVA特异性IgG含量显著或极显著增高(P<0.05或P<0.01),阳性对照组小鼠血清OVA特异性IgG含量显著提高(P<0.05)。0.5、1.0、2.0 mg/kg抗菌肽Sublancin组与阳性对照组之间小鼠血清OVA特异性IgG含量无显著差异(P>0.05)。

表1 抗菌肽Sublancin对小鼠体重的影响
同行数据肩标无字母表示差异不显著(P>0.05)。
In the same row, values with no letter superscripts mean no significant difference (P>0.05).
2.3 抗菌肽Sublancin对小鼠血清OVA特异性IgG的亚类IgG1、IgG2a含量的影响
抗菌肽Sublancin对小鼠血清OVA特异性IgG的亚类IgG1、IgG2a含量的影响见图2。由图2-a可知,与空白对照组相比,2.0 mg/kg抗菌肽Sublancin组和阳性对照组小鼠血清OVA特异性IgG1含量显著提高(P<0.05),1.0 mg/kg抗菌肽Sublancin组小鼠血清OVA特异性IgG1含量极显著提高(P<0.01)。0.5、1.0、2.0 mg/kg抗菌肽Sublancin组与阳性对照组之间的小鼠血清OVA特异性IgG1含量无显著差异(P>0.05)。
由图2-b可知,与空白对照组相比,1.0 mg/kg抗菌肽Sublancin组和阳性对照组的小鼠血清OVA特异性IgG2a含量显著提高(P<0.05)。0.5和2.0 mg/kg抗菌肽Sublancin组的小鼠血清OVA特异性IgG2a含量与空白对照组相比没有显著差异(P>0.05)。0.5、1.0、2.0 mg/kg抗菌肽Sublancin组与阳性对照组之间的小鼠血清OVA特异性IgG2a含量无显著差异(P>0.05)。
以上结果表明,1.0和2.0 mg/kg抗菌肽Sublancin灌胃2周能不同程度地提高OVA免疫小鼠血清中OVA特异性IgG亚类IgG1和IgG2a含量,且与左旋咪唑灌胃的阳性对照组无显著差异。
2.4 抗菌肽Sublancin对小鼠脾脏淋巴细胞增殖能力的影响
抗菌肽Sublancin对小鼠脾脏淋巴细胞增殖能力的影响见图3。由图3可知,与空白对照组相比,1.0 mg/kg抗菌肽Sublancin组和阳性对照组的小鼠脾脏淋巴细胞的刺激指数均显著提高(P<0.05)。0.5和2.0 mg/kg抗菌肽Sublancin组的小鼠脾脏淋巴细胞的刺激指数与空白对照组相比没有显著差异(P>0.05)。0.5、1.0、2.0 mg/kg抗菌肽Sublancin组与阳性对照组之间的小鼠脾脏淋巴细胞的刺激指数无显著差异(P>0.05)。
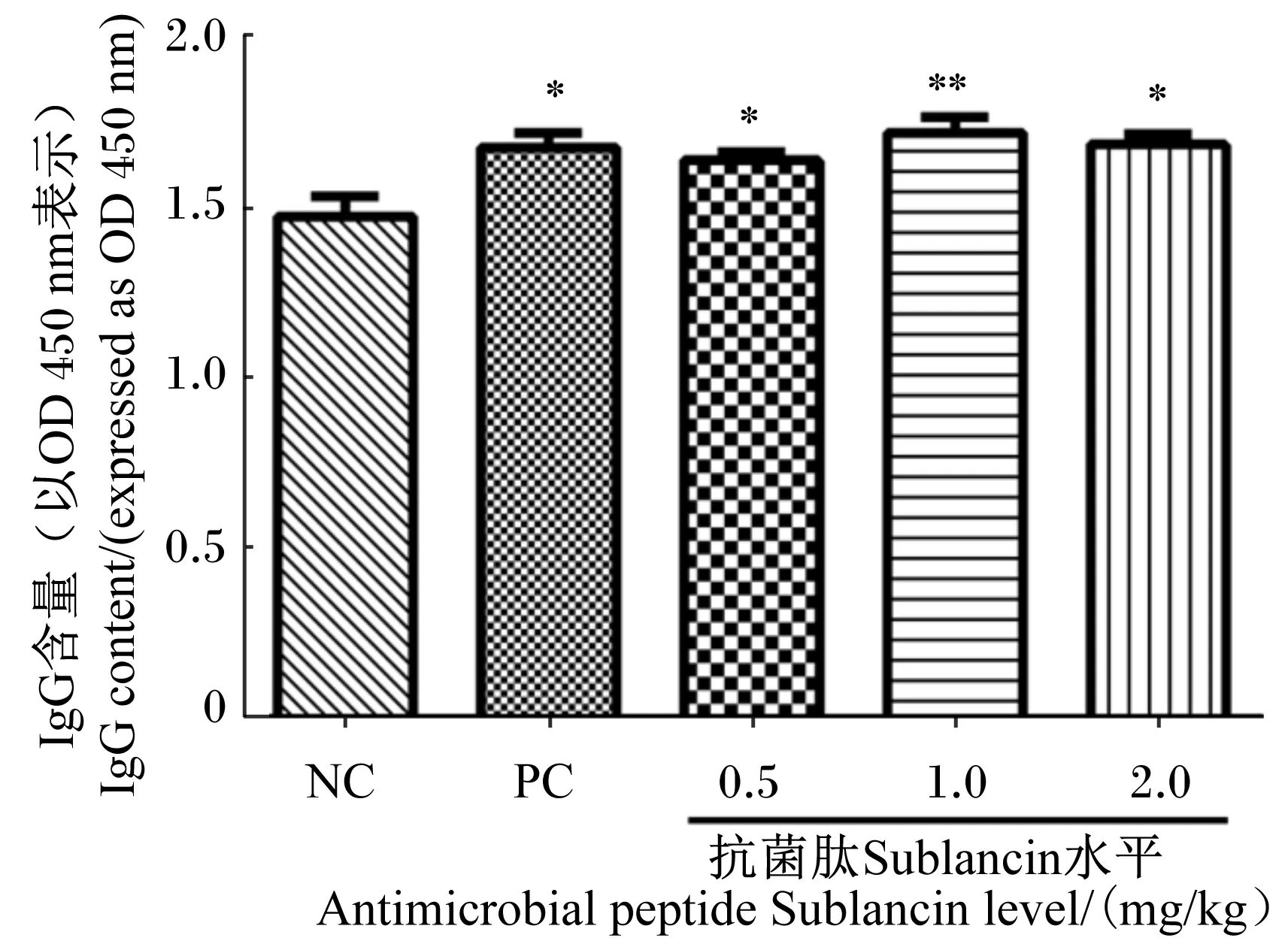
NC:空白对照组;PC:阳性对照组。数据柱标*表示与空白对照组差异显著(P<0.05),**表示与空白对照组差异极显著(P<0.01),抗菌肽Sublancin组数据柱未标字母表示与阳性对照组之间无显著差异(P>0.05)。下图同。
NC: blank control group; PC: positive control group. Value columns with * mean significant difference compared with blank control group (P<0.05), and with ** mean extremely significant difference compared with blank control group (P<0.01), while value columns of antimicrobial peptide Sublancin groups with no letter mean no significant difference compared with positive control group (P>0.05). The same as below.
图1抗菌肽Sublancin对小鼠血清OVA特异性IgG含量的影响
Fig.1 Effects of antimicrobial peptide Sublancin on serum OVA-specific IgG content of mice (n=12)
2.5 抗菌肽Sublancin对小鼠脾脏淋巴细胞上清液中Th1型细胞因子含量的影响
抗菌肽Sublancin对小鼠脾脏淋巴细胞上清液中Th1型细胞因子含量的影响见图4。由图4-a可知,与空白对照组相比,1.0 mg/kg抗菌肽Sublancin组和阳性对照组的小鼠脾脏淋巴细胞上清液中IFN-γ含量显著提高(P<0.05)。0.5和2.0 mg/kg抗菌肽Sublancin组的小鼠脾脏淋巴细胞上清液中IFN-γ含量与空白对照组相比没有显著差异(P>0.05)。0.5、1.0、2.0 mg/kg抗菌肽Sublancin组与阳性对照组之间的小鼠脾脏淋巴细胞上清液中IFN-γ含量无显著差异(P>0.05)。
由图4-b可知,与空白对照组相比,1.0和2.0 mg/kg抗菌肽Sublancin组的小鼠脾脏淋巴细胞上清液中IL-2含量极显著提高(P<0.01),阳性对照组的小鼠脾脏淋巴细胞上清液中IL-2含量显著提高(P<0.05)。0.5、1.0、2.0 mg/kg抗菌肽Sublancin组与阳性对照组之间的小鼠脾脏淋巴细胞上清液中IL-2含量无显著差异(P>0.05)。
上述结果表明,1.0和2.0 mg/kg抗菌肽Sublancin灌胃2周可以促进小鼠脾脏淋巴细胞分泌Th1型细胞因子IFN-γ和IL-2。
2.6 抗菌肽Sublancin对小鼠脾脏淋巴细胞上清液中Th2型细胞因子含量的影响
抗菌肽Sublancin对小鼠脾脏淋巴细胞上清液中Th2型细胞因子含量的影响见图5。由图5-a可知,与空白对照组相比,0.5 mg/kg抗菌肽Sublancin组和阳性对照组的小鼠脾脏淋巴细胞上清液中IL-4含量显著提高(P<0.05),1.0 mg/kg抗菌肽Sublancin组的小鼠脾脏淋巴细胞上清液中IL-4含量极显著提高(P<0.01)。0.5、1.0、2.0 mg/kg抗菌肽Sublancin组与阳性对照组之间的小鼠脾脏淋巴细胞上清液中IL-4含量无显著差异(P>0.05)。
由图5-b可知,与空白对照组相比,1.0 mg/kg抗菌肽Sublancin组和阳性对照组的小鼠脾脏淋巴细胞上清液中IL-10含量极显著提高(P<0.01),0.5 mg/kg抗菌肽Sublancin组的小鼠脾脏淋巴细胞上清液中IL-10含量显著提高(P<0.05)。0.5、1.0、2.0 mg/kg抗菌肽Sublancin组与阳性对照组之间的小鼠脾脏淋巴细胞上清液中IL-10含量无显著差异(P>0.05)。
上述结果表明,0.5和1.0 mg/kg抗菌肽Sublancin灌胃2周可以促进小鼠脾脏淋巴细胞分泌Th2型细胞因子IL-4和IL-10。
3 讨 论
除了抗菌活性外,抗菌肽如α-防御素和β-防御素可以通过诱导巨噬细胞和树突状细胞的分化,趋化树突状细胞、单核-巨噬细胞和T细胞等免疫细胞,从而将先天性免疫和获得性免疫联系起来[2,6]。此外,抗菌肽如θ-防御素可以通过促进CD4+T淋巴细胞增殖与细胞因子的分泌直接调节获得性免疫[17]。因此,抗菌肽可以增强模式抗原或病原微生物特异性的获得性免疫反应[18]。研究表明,抗菌肽Sublancin具有一定的体外和体内抑菌活性[13-15],但是目前关于抗菌肽Sublancin对机体获得性免疫的作用还不清楚。本试验以小鼠为动物模型,选用OVA为模式抗原[7,19],初步探讨了抗菌肽Sublancin对获得性免疫反应的影响。
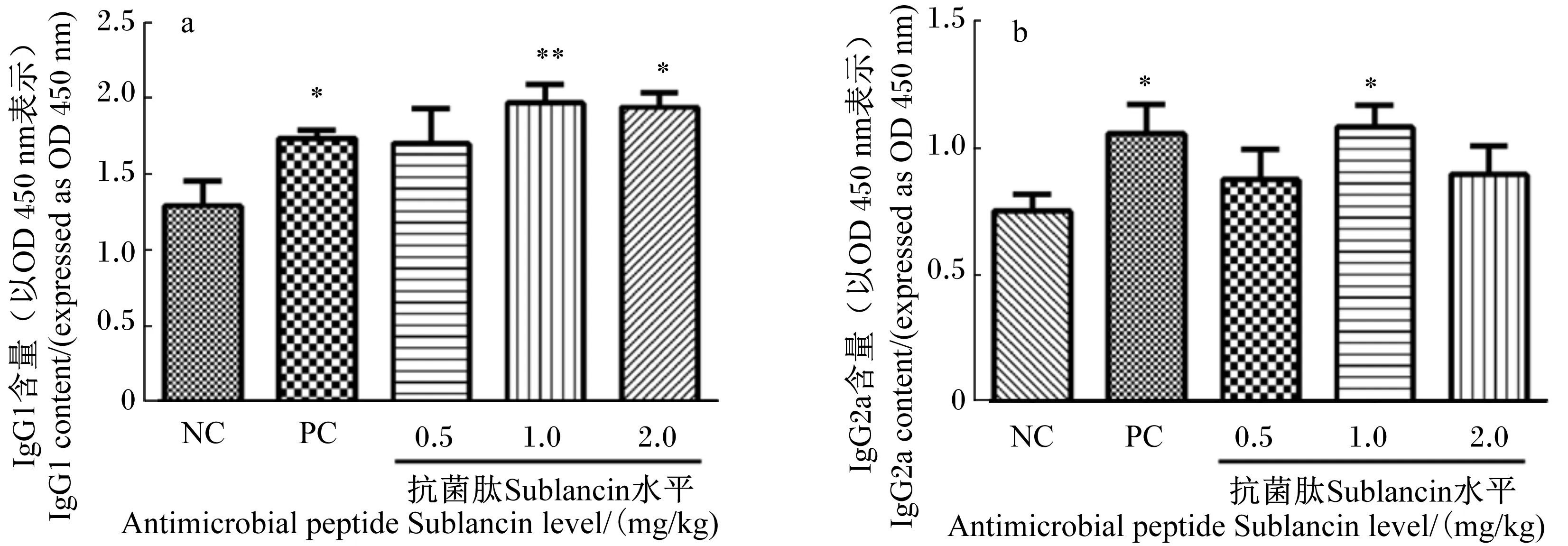
图2 抗菌肽Sublancin对小鼠血清OVA特异性IgG亚类IgG1(a)、IgG2a(b)含量的影响
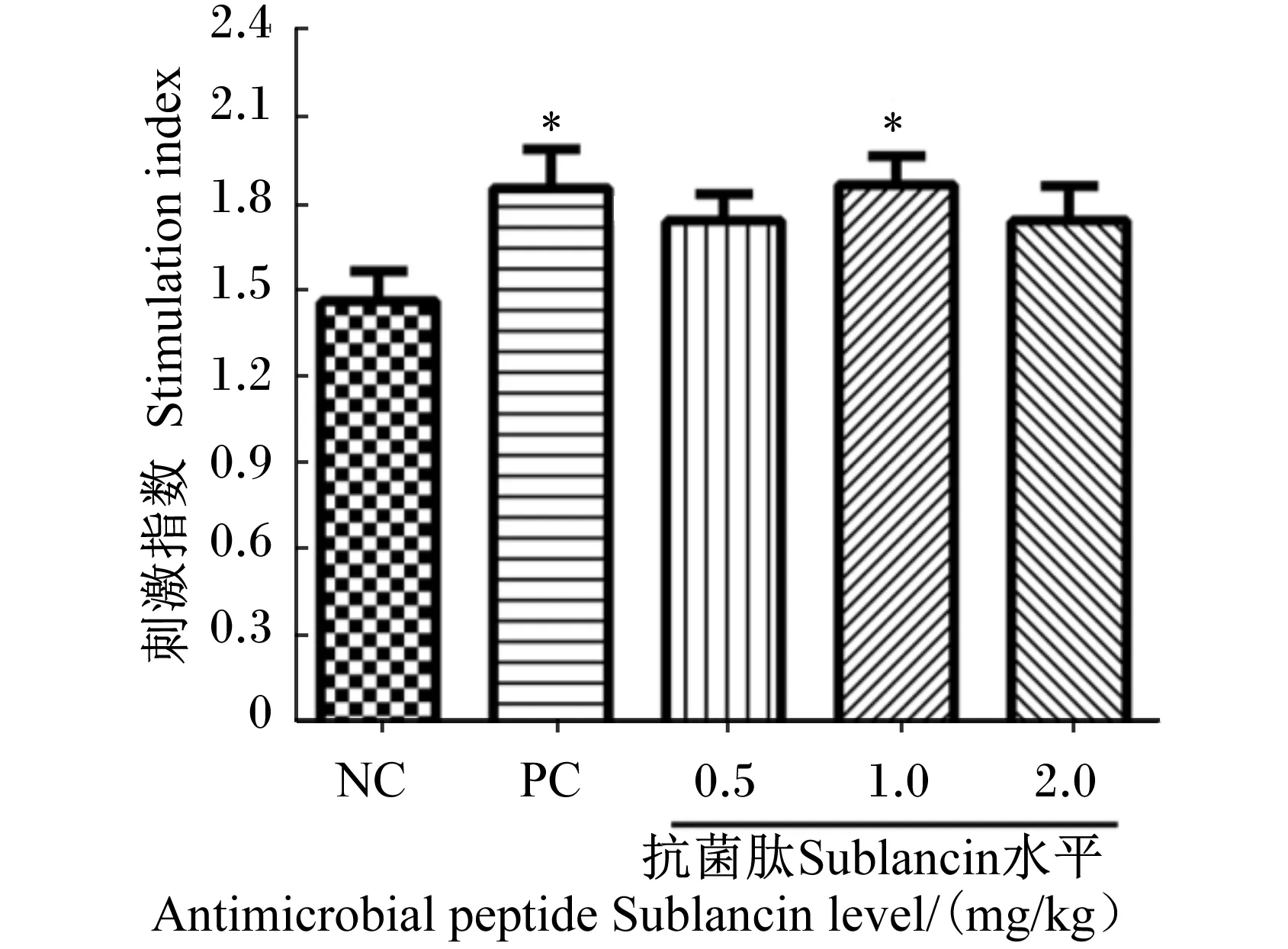
图3 抗菌肽Sublancin对小鼠脾脏淋巴细胞增殖能力的影响
获得性免疫包括由B淋巴细胞介导的体液免疫和由T淋巴细胞介导的细胞免疫。体液免疫是抗原进入机体后诱导相应的B细胞活化、增殖、分化以及产生特异性抗体进入体液发挥效应的过程[20]。常用动物血清抗原特异性抗体含量来反映动物的体液免疫功能。细胞免疫应答由T细胞介导,过程包括3个阶段:1)初始T细胞特异性识别抗原;2)初始T细胞活化、增殖和分化为效应T细胞;3)效应T细胞发挥免疫效应,清除抗原[20]。辅佐性T细胞(T helper cell,Th)是调节免疫应答的主要细胞,其产生的众多细胞因子通过复杂的调节网络实现对免疫应答的调控。CD4+Th细胞根据所产生的细胞因子可分为Th1型细胞和Th2型细胞[21]。Th1型细胞可以通过活化巨噬细胞和释放多种细胞因子,诱导细胞免疫反应,清除细胞内抗原;Th2型细胞可以通过产生IL-4、白细胞介素-5(IL-5)、白细胞介素-6(IL-6)和IL-10等细胞因子,促进B细胞增殖、分化以及产生抗体,辅助体液免疫[20-21]。
本试验结果发现,抗菌肽Sublancin灌胃2周可以提高小鼠血清OVA特异性IgG含量,表明抗菌肽Sublancin可以增强OVA特异性体液免疫反应。除了提高血清中OVA特异性IgG含量外,抗菌肽Sublancin还促进了血清OVA特异性IgG亚类IgG1和IgG2a的产生。IgG1和IgG2a含量的测定可以分别用来衡量Th2和Th1型体液免疫反应[22]。因此本试验结果表明,抗菌肽Sublancin可以增强机体的Th1型和Th2型体液免疫反应。
抗菌肽Sublancin可以提高OVA免疫小鼠脾脏淋巴细胞在OVA刺激下分泌Th1型细胞因子IL-2和IFN-γ以及Th2型细胞因子IL-4和IL-10的含量,由此可知,抗菌肽Sublancin可以增强Th1型和Th2型免疫反应。这一结果与抗菌肽Sublancin对IgG亚型产生的影响结果相吻合。OVA特异性抗体亚类以及细胞因子含量的检测结果共同表明,抗菌肽Sublancin可以提高Th1和Th2混合型免疫反应。
另外,抗菌肽Sublancin可以提高小鼠脾脏淋巴细胞的刺激指数。脾脏淋巴细胞增殖能力是反映细胞免疫水平的一个重要指标[23]。本试验结果表明,抗菌肽Sublancin可以辅助OVA诱导机体产生较好的细胞免疫应答,这与抗菌肽Sublancin促进Th1型细胞因子产生的结果吻合。
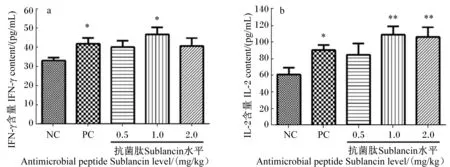
图4 抗菌肽Sublancin对小鼠脾脏淋巴细胞上清液中IFN-γ(a)和IL-2(b)含量的影响

图5 抗菌肽Sublancin对小鼠脾脏淋巴细胞上清液中IL-4(a)和IL-10(b)含量的影响
左旋咪唑是人工合成的噻咪唑的左旋异构体。大量研究表明,左旋咪唑具有免疫调节作用,可以作为免疫增强剂提高动物的体液免疫和细胞免疫应答,是许多免疫增强剂试验的对照品[24-27]。因此,本试验选用左旋咪唑作为阳性对照。本试验结果发现,0.5、1.0和2.0 mg/kg抗菌肽Sublancin灌胃与2.5 mg/kg左旋咪唑灌胃对OVA免疫小鼠的体液免疫和细胞免疫的增强作用相当。本试验的结果显示抗菌肽Sublancin灌胃对小鼠的体重没有显著影响,表明抗菌肽Sublancin以0.5~2.0 mg/kg的剂量连续灌胃2周对小鼠具有很好的安全性。
抗菌肽影响机体先天免疫和获得性免疫的免疫应答[28]。已有研究显示抗菌肽可以增强小鼠的免疫反应,来源于人类嗜中性粒细胞的α-防御素提高其血清抗原特异性IgG含量,并促进CD4+释放IFN-γ、IL-5、IL-6和IL-10[29-30]。人工合成的抗菌肽KLKL5KLK是产生Th2型适应性免疫的有效诱导剂[7]。由抗菌肽KLKL5KLK和脱氧肌苷/脱氧胞嘧啶混合的合成佐剂诱导Th1型细胞和体液免疫应答反应[31-32]。近些年来,抗菌肽可以影响机体先天和获得性免疫应答的研究结果层出不穷,但是抗菌肽究竟是通过何种机制使机体产生免疫应答,与其相关的研究并不多。已有的研究显示,抗菌肽可以通过激活先天性免疫系统,启动获得性免疫应答,如诱导树突状细胞、巨噬细胞的分化[33-35]。抗菌肽还可以通过直接作用于T细胞和B细胞,直接调节获得性免疫[6]。根据体内试验的研究结果,抗菌肽可能通过提高抗原与抗原递呈细胞(antigen-presenting cells,APCs)之间的联系或者延长抗原在注射部位的存留时间增强获得性免疫反应[7]。Fritz等[7]的研究发现,人工合成抗菌肽KLKL5KLK可以提高OVA抗原递呈到单核-巨噬细胞系P388D1,他们的研究还发现,KLKL5KLK可以延长OVA在注射部位的停留时间。抗菌肽Sublancin灌胃小鼠可以提高抗原特异性细胞免疫和体液免疫应答,并产生Th1和Th2混合型免疫反应,其调节获得性免疫的机理还需进一步研究。
4 结 论
抗菌肽Sublancin可以诱导OVA免疫小鼠产生Th1和Th2混合型免疫反应,增强体液免疫和细胞免疫应答。
[1] ZASLOFF M.Antimicrobial peptides of multicellular organisms[J].Nature,2002,415(6870):389-395.
[2] LAI Y P,GALLO R L.AMPed up immunity:how antimicrobial peptides have multiple roles in immune defense[J].Trends in Immunology,2009,30(3):131-141.
[3] NGUYEN L T,HANEY E F,VOGEL H J.The expanding scope of antimicrobial peptide structures and their modes of action[J].Trends in Biotechnoloy,2011,29(9):464-472.
[4] ZHANG L J,GALLO R L.Antimicrobial peptides[J].Current Biology,2016,26:R14-R19.
[5] BALTZER S A,BROWN M H.Antimicrobial peptides-promising alternatives to conventional antibiotics[J].Journal of Molecular Microbiology and Biotechnology,2011,20(4):228-235.
[6] MANSOUR S C,PENA O M,HANCOCK R E W.Host defense peptides:front-line immunomodulators[J].Trends Immunology,2014,35(9):443-450.
[7] FRITZ J H,BRUNNER S,BIRNSTIEL M L,et al.The artificial antimicrobial peptide KLKLLLLLKLK induces predominantly a TH2-type immune response to co-injected antigens[J].Vaccine,2004,22(25/26):3274-3284.
[8] ZHANG H H,YANG X M,XIE Q M,et al.The Potent adjuvant effects of chicken β-defensin-1 when genetically fused with infectious bursal disease virus VP2 gene[J].Veterinary Immunology and Immunopathology,2010,136(1/2):92-97.
[9] ACOSTA J,CARPIO Y,VALDES I,et al.Co-administration of tilapia alpha-helical antimicrobial peptides with subunit antigens boost immunogenicity in mice and tilapia (Oreochromisniloticus)[J].Vaccine,2014,32(2):223-229.
[10] OMAN T J,BOETTCHER J M,WANG H,et al.Sublancin is not a lantibiotic but an S-linked glycopeptides[J].Nature Chemical Biology,2011,7(2):78-80.
[11] STEPPER J,SHASTRI S,LOO T S,et al.Cysteine S-glycosylation,a new post-translational modification found in glycopeptide bacteriocins[J].FEBS Letters,2011,585(4):645-650.
[12] JI S Y,LI W L,BALOCH A R,et al.Improved production of sublancinviaintroduction of three characteristic promoters into operon clusters responsible for this novel distinct glycopeptides biosynthesis[J].Microbial Cell Factries,2015,14:17.
[13] PAIK S H,CHAKICHERLA A,HANSEN J N.Identification and characterization of the structural and transporter genes for,and the chemical and biological properties of Sublancin 168,a novel lantibiotic produced byBacillussubtilis168[J].The Journal of Biological Chemistry,1998,273(36):23134-23142.
[14] WANG Q W,ZENG X F,S WANG S,et al.The bacteriocin Sublancin attenuates intestinal injury in young mice infected withStaphylococcusaureus[J].Anatomical Record,2014,297(8):1454-1461.
[15] WANG G S,LI X,WANG Z.APD3.The antimicrobial peptide database as a tool for research and education[J].Nucleic Acids Research,2015,44:D1087-D1093.
[16] KOUWEN T R H M,TRIP E N,DENHAM E L,et al.The large mechanosensitive channel mscl determines bacterial susceptibility to the bacteriocin Sublancin 168[J].Antimicrobial Agents and Chemotherapy,2009,53(11):4702-4711.
[17] YANG D,BIRAGYN A,HOOVER D M,et al.Multiple roles of antimicrobial defensins,cathelicidins,and eosinophil-derived neurotoxin in host defense[J].Annual Review of Immunology,2004,22(1):181-215.
[18] NICHOLLS E F,MADERA L,HANCOCK R E W.Immunomodulators as adjuvants for vaccines and antimicrobial therapy[J].Annals of the New York Academy of Sciences,2010,1213:46-61.
[19] BOMMINENI Y R,PHAM G H,SUNKARA L T,et al.Immune regulatory activities of fowlicidin-1,a cathelicidin host defense peptide[J].Molecular Immunology,2014,59(1):55-63.
[20] 曹雪涛.医学免疫学[M].6版.北京:人民卫生出版社,2013:49-110.
[21] 龚非力.医学免疫学[M].3版.北京:科学出版社,2009:167-168.
[22] FINKELMAN F D,HOLMES J,KATONA I M,et al.Lymphokine control of in vivo immunoglobulin isotype selection[J].Annual Review of Immunology,1990,8(1):303-333.
[23] MOHAN T,SHARMA C,BHAT A A,et al.Modulation of HIV peptide antigen specific cellular immune response by synthetic α- and β-defensin peptides[J].Vaccine,2013,31(13):1707-1716.
[24] KANG Y M,JIN H L,ZHENG G X,et al.The adjuvant effect of levamisole on killed viral vaccines[J].Vaccine,2005,23(48/49):5543-5550.
[25] MALIK F,SINGH J,KHAJURIA A,et al.A standardized root extract ofWithaniasomniferaand its major constituent with an olide-A elicit humoral and cell-mediated immune responses by up regulation of Th1-dominant polarization in BALB/c mice[J].Life Sciences,2007,80(16):1525-1538.
[26] GAUTAM M,SAHA S,BANI S,et al.Immunomodulatory activity ofAsparagusracemosuson systemic Th1/Th2 immunity:implications for immunoadjuvant potential[J].Journal of Ethnopharmacology,2009,121(2):241-247.
[27] ZHAI L J,LI Y T,WANG W Y,et al.Effect of oral administration of ginseng stem-and-leaf saponins(GSLS) on the immune responses to Newcastle disease vaccine in chickens[J].Vaccine,2011,29(31):5007-5014.
[28] HANCOCK R E W,DIAMOND G.The role of cationic antimicrobial peptides in innate host defences[J].Trends in Microbiology,2000,8(9):402-410.
[29] LILLARD J W,BOYAKA P N,CHERTOV O,et al.Mechanisms for induction of acquired host immunity by neutrophil peptide defensins[J].Proceedings of the National Academy of Sciences of the United States of America,1999,96(2):651-656.
[30] TANI K,MURPHY W J,CHERTOV O,et al.Defensins act as potent adjuvants that promote cellular and humoral immune responses in mice to a lymphoma idiotype and carrier antigens[J].International Immunolog,2000,12(5):691-700.
[31] AGGER E M,ROSENKRANDS I,OLSEN A W,et al.Protective immunity to tuberculosis with Ag85B-ESAT-6 in a synthetic cationic adjuvant system IC31[J].Vaccine,2006,24(26):5452-5460.
[32] DE GONZALO C V G,ZHU L Y,OMAN T J,et al.NMR structure of the S-linked glycopeptides sublancin 168[J].ACS Chemical,Biology,2014,9(3):796-801.
[33] BIRAGYN A,RUFFINI P A,LEIFER C A,et al.Toll-like receptor 4-dependent activation of dendritic cells by β-defensin 2[J].Science,2002,298(5595):1025-1029.
[34] VAN DER DOES A M,JOOSTEN S A,VROOMANS E,et al.The antimicrobial peptide hLF1-11 drives monocyte-dendritic cell differentiation toward dendritic cells that promote antifungal responses and enhance Th17 polarization[J].Journal of Innate Immunity,2012,4(3):284-292.
[35] PENA O M,AFACAN N,PISTOLIC J,et al.Synthetic cationic peptide IDR-1018 modulates human macrophage differentiation[J].PLoS One,2013,8(1):e52449.
*Corresponding author, professor, E-mail: qiaoshy@mafic.ac.cn

