植物乳杆菌和苦荞黄酮及其复合物对断奶仔猪生长性能、营养物质消化率及血清指标的影响
王 强 张乃锋 崔 凯 王世琴 吕小康 刁其玉
(1.中国农业科学院饲料研究所,农业部饲料生物技术重点开放实验室,生物饲料开发国家工程研究中心,北京 100081;2.四川省凉山州畜牧兽医科学研究所,西昌 615042)
断奶仔猪受生理、环境、营养等应激因素的影响,常导致生长抑制、饲料报酬低、腹泻甚至死亡。抗生素以亚治疗剂量添加于饲粮中可以预防仔猪疾病发生和促进生长,但由此带来的细菌耐药性、药物残留以及对人类健康威胁等问题[1]促使世界各国陆续采取措施禁止或限制抗生素在饲粮中的使用。因此,寻找抗生素替代品显得尤为重要。目前研究较多的抗生素替代物质包括益生素(寡糖类物质、益生菌)、植物提取物、抗菌肽和噬菌体等[2]。益生菌作为一类安全无污染、无残留、无耐药性的新型生物饲料添加剂,已被广泛应用于畜禽养殖业[3]。本课题组前期研究发现,植物乳杆菌(Lactobacillusplantarum)GF103具备良好的体外益生特性[4],并且在饲粮中添加植物乳杆菌GF103具有改善断奶仔猪生长性能[5]、促进断奶仔猪肠道菌群平衡、维持肠道健康的作用[6]。植物提取物是一类来源于植物的、具有一种或多种生物学功能的活性物质,当前应用较多的有植物精油、多糖、黄酮类化合物等[7]。苦荞黄酮(buckwheat flavone)存在于苦荞各组织部位,含量在0.51%~6.28%,具有抗氧化、抗癌、抗菌和增强免疫等作用[8]。目前黄酮类植物提取物在畜禽养殖上的应用主要集中在大豆异黄酮等[9]的研究上,有关苦荞黄酮抗氧化性和增强免疫功能等作用对断奶仔猪是否有影响值得研究,而植物乳杆菌和苦荞黄酮联合应用对断奶仔猪生长性能的影响则未见报道。因此,本试验旨在通过研究植物乳杆菌和苦荞黄酮及其复合物对断奶仔猪生长性能、营养物质消化率及血清指标的影响,为植物乳杆菌和苦荞黄酮在断奶仔猪上的应用提供理论依据。
1 材料与方法
1.1 试验材料
植物乳杆菌GF103由中国农业科学院饲料研究所家畜研究室实验室制备,活菌数≥2×109CFU/g。苦荞黄酮由南京景竹生物科技有限公司提供,苦荞黄酮含量≥70%。
1.2 试验设计
本试验采用单因素完全随机设计,选取(35±3)日龄、平均体重为(7.85±0.67) kg的“长×大”二元杂交断奶仔猪50头,随机分为5组,每组10个重复,每个重复1头仔猪。5个组分别为:负对照组(NC组),饲喂基础饲粮(不添加抗生素、植物乳杆菌和苦荞黄酮);正对照组(PC组),饲喂基础饲粮+抗生素(40 mg/kg硫酸黏杆菌素);植物乳杆菌组(LP组),饲喂基础饲粮+植物乳杆菌(1×109CFU/kg);苦荞黄酮组(BF组),饲喂基础饲粮+苦荞黄酮(40 mg/kg);植物乳杆菌和苦荞黄酮复合组(LB组),饲喂基础饲粮+植物乳杆菌(1×109CFU/kg)+苦荞黄酮(40 mg/kg)。上述各组中硫酸黏杆菌素、植物乳杆菌和苦荞黄酮的添加量均为有效成分添加量。
试验期共28 d,分为2个阶段,第1阶段为第1~14天,第2阶段为第15~28天。
1.3 试验饲粮及饲养管理
参照NRC(1998)关于仔猪的营养需要配制玉米-豆粕型基础饲粮,各试验组按照试验设计要求在基础饲粮中添加抗生素、植物乳杆菌或苦荞黄酮。基础饲粮组成及营养水平见表1。

表1 基础饲粮组成及营养水平(干物质基础)
1)预混料为每千克饲粮提供 Premix provided the following per kg of the diet:VA 8 000 IU,VD33 000 IU,VE 20 IU,VK32 mg,VB14 mg,VB23.6 mg,VB540 mg,VB64 mg,VB120.02 mg,生物素 biotin 0.15 mg,叶酸 folic acid 1.0 mg,D-泛酸D-pantothenic acid 11 mg,烟酸 nicotinic acid 10 mg,抗氧化剂 antioxidant 100 mg,Cu 10 mg,Fe 80 mg,Mn 80 mg,Zn 75 mg,I 0.40 mg,Se 0.30 mg。
2)消化能为计算值,其余为实测值。DE was a calculated value, while the others were measured values.
试验在北京昌平区轶雄养殖场完成,试验猪在漏缝式高床上饲养,粉料自动拌湿饲喂,自由采食与饮水,通风良好,舍温保持在20~25 ℃,每日清粪1次,保持舍内清洁,每周消毒2次。试验期间,按照猪场常规免疫、驱虫程序进行。
1.4 测定指标及方法
1.4.1 生长性能
生长性能指标包括平均日采食量(ADFI)、平均日增重(ADG)和料重比(F/G)。于试验的第1天、第15天和第29天08:00逐头空腹称重,记录每头仔猪体重(BW),用于计算ADG;以组为单位记录每次加料量,于试验的第15天和第29天早晨称剩料量,用于计算ADFI。根据ADG和ADFI计算F/G。计算公式如下:
ADG(g/d)=每头猪总增重/饲养天数;ADFI(g/d)=每栏总采食量/
(每栏仔猪头数×饲养天数);F/G=ADFI/ADG。
1.4.2 营养物质消化率
试验采用二氧化钛(TiO2)作为外源指示剂进行消化试验,试验期为10 d。于试验的第19天向饲粮中添加0.1%的TiO2,预饲4 d后连续采饲料样、粪样6 d。每天从各组料槽中取部分饲料样约50 g,采样结束后按组将6 d的饲料样均匀混合存放;每天以组为单位采集仔猪刚排出的新鲜粪便约50 g/头,对当天已采猪只作好标记,当天不再重复采集,每组采集头数必须大于6头,每组尽量在1~2 h内完成采集,并按粪便重量的10%加入10%盐酸(HCl)固氮,每组每天的粪样作为一个样品,放置冰箱冷冻保存。试验结束后,将粪样在65 ℃条件下烘48 h,在室内回潮24 h,粉碎过40目待测。
分析测定饲料样及粪样中的总能(GE)及干物质(DM)、粗蛋白质(CP)、粗脂肪(EE)、粗灰分(Ash)、钙(Ca)和磷(P)的含量,方法参照《饲料分析及饲料质量检测技术》(第3版)。钛(Ti)含量的测定参照邓雪娟等[10]的方法进行。
营养物质消化率(%)=[1-(饲料样中钛的含量/
粪样中钛的含量)×(粪样中营养物质的含量/
饲料样中营养物质的含量)]×100。
1.4.3 血清指标
于试验第29天08:00,每组随机选取6头仔猪,于前腔静脉采血10 mL,3 000 r/min离心20 min,分离血清,于-20 ℃保存备检。测定血清中总蛋白(TP)、白蛋白(ALB)、球蛋白(GLB)、尿素氮(UN)、葡萄糖(GLU)、游离脂肪酸(NEFA)、胰岛素生长因子Ⅰ(IGF-Ⅰ)和生长激素(GH)的含量;测定血清中免疫球蛋白G(IgG)、免疫球蛋白M(IgM)、免疫球蛋白A(IgA)等免疫指标的含量;测定血清中总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)、丙二醛(MDA)等抗氧化指标的含量或活性。
TP、ALB、GLB、UN、GLU、IgG、IgA和IgM含量使用KHB-1280全自动生化仪测定;IGF-Ⅰ和GH含量测定采用放免法,使用GC-1200全自动放免计数仪测定;NEFA、T-AOC、SOD、GSH-Px、CAT和MDA含量或活性测定采用比色法,使用L-3180半自动生化分析仪测定。
1.5 数据分析
试验数据采用Excel 2007软件进行整理,采用SPSS V17.0统计软件的one-way ANOVA程序进行单因素方差分析,差异显著则用Duncan氏法进行多重比较。P<0.05为差异显著,0.05≤P<0.10为有显著性趋势。
2 结 果
2.1 植物乳杆菌和苦荞黄酮及其复合物对断奶仔猪生长性能的影响
由表2可知,各组之间断奶仔猪初重差异不显著(P>0.05),符合试验要求。从末重来看,BF组显著高于NC组和LP组(P<0.05),与LB组和PC组差异不显著(P>0.05)。在1~14 d和15~28 d 2个阶段,各组之间ADG差异不显著(P>0.05),在2个阶段BF组的ADG比NC组分别提高了65.88%和46.42%(0.05≤P<0.10),比PC组分别提高了12.37%和49.94%(0.05≤P<0.10);在试验全期(1~28 d),BF组的ADG显著高于NC组、PC组和LP组(P<0.05),与LB组差异不显著(P>0.05)。试验全期各组之间F/G差异不显著(P<0.05),但BF组F/G为1.63,与NC组和PC组相比有降低趋势(0.05≤P<0.10)。
2.2 植物乳杆菌和苦荞黄酮及其复合物对断奶仔猪营养物质消化率的影响
由表3可知,PC组、LP组、BF组和LB组饲粮GE、DM、OM、CP、EE、Ca和P的消化率均显著高于NC组(P<0.05)。LB组的GE、DM、OM和P的消化率显著高于其余各组(P<0.05)。
2.3 植物乳杆菌和苦荞黄酮及其复合物对断奶仔猪血清生化指标的影响
由表4可知,各组之间血清GLB含量差异不显著(P>0.05),但BF组与NC组相比有上升趋势(0.05≤P<0.10),各组间血清ALB/GLB和IGF-Ⅰ含量差异不显著(P>0.05)。BF组血清TP含量显著高于PC组、LP组和NC组(P<0.05),与LB组差异不显著(P>0.05)。BF组血清ALB含量显著高于其他各组(P<0.05)。BF组血清UN含量显著高于LB组、LP组和NC组(P<0.05),与PC组差异不显著(P>0.05)。BF组和LB组血清GLU含量显著高于LP组和NC组(P<0.05),与PC组差异不显著(P>0.05)。BF组血清NEFA含量显著高于LP组和NC组(P<0.05),与LB组和PC组差异不显著(P>0.05)。LP组血清GH含量显著高于其他各组(P<0.05),而BF组、NC组、LB组和PC组之间差异不显著(P>0.05)。
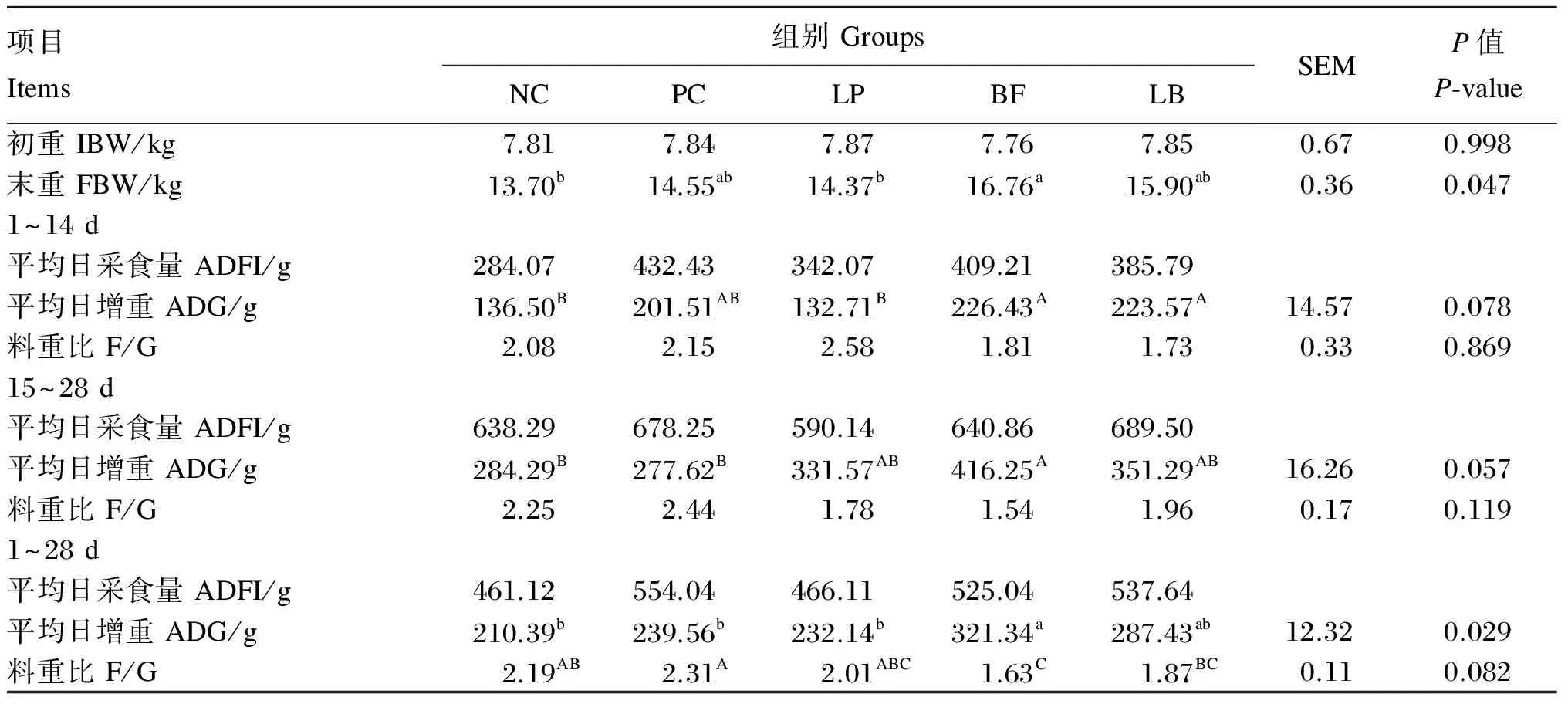
表2 植物乳杆菌和苦荞黄酮及其复合物对断奶仔猪生长性能的影响
同行数据肩标不同小写字母表示差异显著(P<0.05),不同大写字母表示有显著性趋势(0.05≤P<0.10)。下表同。
In the same row, values with different small letter superscripts mean significant difference (P<0.05), while with different capital letter superscripts mean trending significant difference (0.05≤P<0.10). The same as below.

表3 植物乳杆菌和苦荞黄酮及其复合物对断奶仔猪营养物质消化率的影响
2.4 植物乳杆菌和苦荞黄酮及其复合物对断奶仔猪血清免疫指标的影响
由表5可知,BF组血清IgG含量显著高于LP组和NC组(P<0.05),与LB组和PC组差异不显著(P>0.05)。BF组血清IgA含量显著高于其他各组(P<0.05),而LB组、NC组、PC组和LP组之间差异不显著(P>0.05)。BF组血清IgM含量显著高于PC组、LP组和NC组(P<0.05),与LB组差异不显著(P>0.05);LB组血清IgM含量显著高于NC组(P<0.05),与PC组和LP组差异不显著(P>0.05)。

表4 植物乳杆菌和苦荞黄酮及其复合物对断奶仔猪血清生化指标的影响

表5 植物乳杆菌和苦荞黄酮及其复合物对断奶仔猪血清免疫指标的影响
2.5 植物乳杆菌和苦荞黄酮及其复合物对断奶仔猪血清抗氧化指标的影响
由表6可知,LP组血清T-AOC显著高于PC组、BF组和NC组(P<0.05),与LB组差异不显著(P>0.05)。LP组和LB组血清SOD活性均显著高于PC组、BF组和NC组(P<0.05)。LP组血清GSH-Px活性显著高于其余各组(P<0.05),LB组显著高于PC组、BF组和NC组(P<0.05)。LP组血清CAT活性显著高于其余各组(P<0.05),LB组和PC组显著高于BF组和NC组(P<0.05)。LP组和LB组血清MDA含量显著低于PC组、BF组和NC组(P<0.05)。
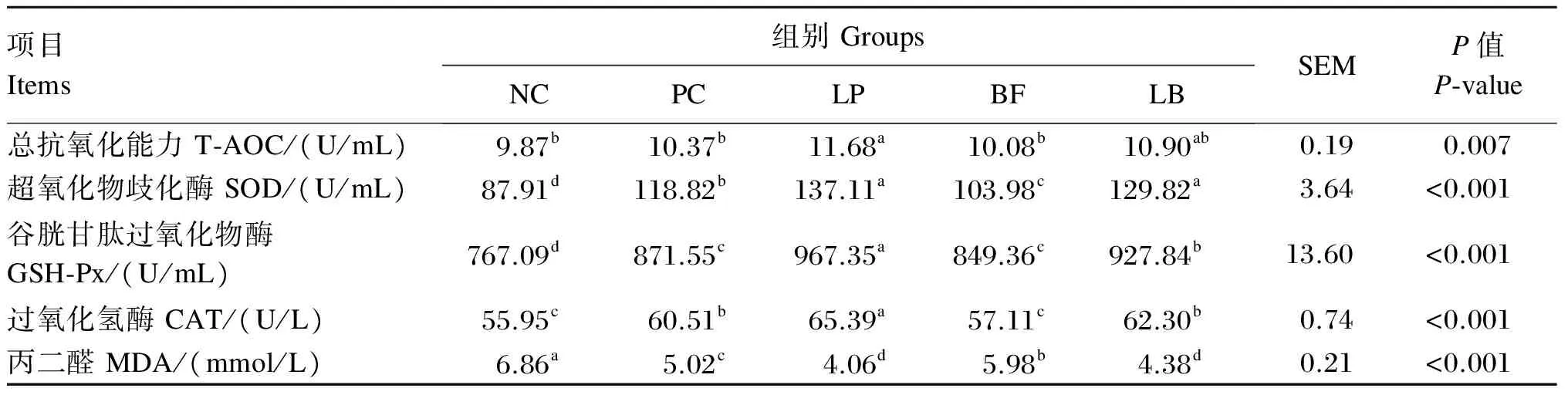
表6 植物乳杆菌和苦荞黄酮及其复合物对断奶仔猪血清抗氧化指标的影响
3 讨 论
3.1 植物乳杆菌和苦荞黄酮及其复合物对断奶仔猪生长性能的影响
断奶应激和胃肠道菌群失衡是引起仔猪食欲减弱、腹泻、生长缓慢甚至停滞等现象的主要原因,如何减少应激和改善胃肠道微生物菌群平衡是提高仔猪生长性能的重要手段。硫酸黏杆菌素具有强大的抗革兰氏阴性菌作用,被认为是治疗阴性菌感染的最后一道防线,鉴于动物产品质量安全和公共卫生安全的考虑,目前已被禁止用于动物饲料。本试验采用硫酸黏杆菌素作正对照研究,目的在于响应行业发展需求,寻找合适的能替代硫酸黏杆菌素促生长作用的添加剂,为产业发展做技术储备。植物乳杆菌是一种同型发酵乳酸菌,能通过胃并定植于肠道发挥有益作用[11]。黄酮类化合物是植物重要的次级代谢产物,含有的多种活性成分,可以通过调节畜禽免疫功能、生长轴和性腺轴功能,从而影响畜禽免疫力、生长性能和繁殖性能。本试验中,饲粮添加苦荞黄酮组仔猪的全期ADG和F/G显著好于NC组,说明饲粮中添加苦荞黄酮可以达到替代抗生素促生长的目的。前人对黄酮类物质的研究也有类似结果,在断奶仔猪饲粮中添加竹叶黄酮[12]、藤茶黄酮[13]增加仔猪ADG,降低F/G,改善了仔猪生长性能。而本试验添加植物乳杆菌以及苦荞黄酮与植物乳杆菌的复合物,与NC组相比无显著差异。前人研究关于饲粮添加植物乳杆菌对仔猪的生长性能的影响效果并不一致,如王士长等[14]、索成等[15]均发现饲粮中添加植物乳杆菌可以显著提高断奶仔猪的生长性能,而柴建民等[6]、董晓丽等[16]在饲粮中添加植物乳杆菌对仔猪的ADG、ADFI和F/G均无显著影响,后者与本试验结果类似。本试验中PC组仔猪ADG高于NC组13.9%,但统计上并无显著差异,其原因可能与组内离散度偏大有关系。
3.2 植物乳杆菌和苦荞黄酮及其复合物对断奶仔猪营养物质消化率的影响
断奶对仔猪肠道菌群影响较大,主要表现在大肠杆菌数量的上升和乳酸杆菌数量的下降,通过饲喂外源益生菌来调节仔猪肠道菌群结构,可以提高饲粮消化率,促进动物生长[17]。前人在研究植物乳杆菌和黄酮类化合物对饲粮消化率影响的结果上并不一致。如黄金华等[18]、周盟等[19]发现,植物乳杆菌在不同程度上改善了仔猪对营养物质的表观消化率。李方方等[20]研究表明,断奶仔猪饲粮中添加大豆异黄酮,可以显著提高饲粮中CP和P的消化率,极显著提高EE和Ca的消化率,且呈现剂量效应。然而,张乃锋等[21]在生长猪饲粮中添加1×109CFU/kg植物乳杆菌后,其GE、DM、OM、CP、EE、中性洗涤纤维(NDF)、Ca和P的消化率没有显著变化。本试验中PC组、LP组、BF组和LB组饲粮GE、DM、OM、CP、EE、Ca、P的消化率均显著高于NC组,表明添加植物乳杆菌或苦荞黄酮可以显著提高仔猪饲粮营养物质消化率。这可能是因为植物乳杆菌能提高小肠绒毛长度,加深胃底腺小凹深度,从而有利于对营养物质的消化吸收[14]。也可能是通过植物乳杆菌产酸降低肠道pH,促进蛋白酶等消化酶的分泌[22],提高肠道蛋白酶、淀粉酶和纤维酶的活性,从而提高营养物质的消化和吸收[23]。本试验联合添加植物乳杆菌和苦荞黄酮对饲粮GE、DM、OM和P的消化率显著高于单独添加,提示植物乳杆菌和苦荞黄酮对饲粮GE、DM、OM和P的消化有协同提高作用,其相互作用的机制还有待进一步研究。
3.3 植物乳杆菌和苦荞黄酮及其复合物对断奶仔猪血清生化指标的影响
TP含量高低主要反映肝脏蛋白质合成能力的强弱[14]。血清ALB在维持血液胶体渗透压、体内代谢物质运输、营养等方面均起着很重要的作用。血清GLB含量的高低在一定程度上反映了动物机体的免疫状况。白球比主要反映脾脏免疫功能状况,其比值的下降表明F/G的合成增加,说明机体提升了特异性免疫应答水平,增强了免疫力[24]。本试验中,添加苦荞黄酮后血清中TP、ALB含量显著高于NC组,GLB含量有升高趋势,说明添加苦荞黄酮后仔猪的蛋白质消化、合成得到提高,这与前面生长性能的表现是一致的。赵萌等[25]在仔猪饲粮中添加藤茶黄酮,也同样提高了仔猪血清中TP和ALB含量。
血清UN是蛋白质分解的最终产物,能够反映氨基酸代谢和利用状况。关于植物乳杆菌和苦荞黄酮对仔猪血清UN含量的影响,前人研究结果不尽相同。有报道发现[6,26],在断奶仔猪饲粮中添加植物乳杆菌或大豆黄酮对血清UN含量没有影响。而也有研究表明,植物乳杆菌或藤茶黄酮可以降低血清UN含量[25,27]。本试验植物乳杆菌对血清UN含量的影响与前者一致,而苦荞黄酮却提高了血清UN含量,与前人研究不一致。蛋白质、氨基酸、尿素氮在机体内的分解、合成、转化处于一个动态平衡的状态,影响血清UN含量的因素很多。血清UN含量升高,一般情况下是大量氨基酸代谢的结果[28],本试验BF组血清UN含量的提高可能与相对于NC组来讲采食量和消化率的提高导致的蛋白质摄入量的改变、蛋白质分解与合成、肝脏氨基酸代谢等方面的变化有关。而苦荞黄酮所起作用及其机制还有待进一步研究。
GLU是血液中最重要的单糖,是维持细胞功能的必需能量供体。NEFA是中性脂肪分解代谢的中间产物,是机体重要的能源物质之一。糖代谢和脂代谢关系极为密切,两者可循糖酵解途径相通。从本试验血清GLU和NEFA含量在各组间的变化和差异性表现来看基本上是一致的。本试验BF组血清GLU和NEFA含量增加显著,说明苦荞黄酮增加了肠道吸收入血液的GLU含量,提高了机体能量代谢水平,在正常范围内血清GLU含量的增加有助于提高动物的免疫力。
GH具有刺激骨及软骨组织生长,调节蛋白质、脂质和糖类代谢的功能,能提高猪的生长速度[29];IGF-Ⅰ是多功能生长因子,具有类胰岛素功能,可提高小肠黏膜质量及绒毛高度(VH),增加养分吸收[30]。本试验中,除LP组仔猪血清GH含量显著提高外,其余各组仔猪血清GH、IGF-Ⅰ含量无差异,这与柴建民等[6]的报道一致。但也有研究表明,类黄酮化合物有提高动物GH和IGF-Ⅰ的作用[31]。这可能与受试动物的生长阶段、类黄酮成分和剂量有关,也可能是因为GH以脉冲式释放,很难反映GH与生长特性的关系,其促生长作用是通过影响IGF-Ⅰ含量来实现的,且IGF-Ⅰ含量与猪体重和增重呈正相关,故IGF-Ⅰ相对于GH更能反映动物的生长状况[32]。
3.4 植物乳杆菌和苦荞黄酮及其复合物对断奶仔猪血清免疫指标的影响
免疫球蛋白是介导体液免疫的主要抗体,也是反映机体免疫功能的重要指标,血清中抗体的升高一定程度上反映机体免疫功能增强[33]。IgG占总的免疫球蛋白的75%,在特异性免疫中起主力军作用。IgA是黏膜免疫的主要抗体,作为抗感染的最初屏障,起着十分重要的作用[34]。IgM是抗原刺激诱导体液免疫应答中最先产生的抗体,其杀菌、溶菌、促吞噬和凝集作用比IgG高500~1 000倍,在机体的早期防御中起着重要的作用。本试验中,添加植物乳杆菌对断奶仔猪血清IgG、IgM、IgA含量没有影响。前人研究也有相似结果,如王杰等[35]在断奶仔猪饲粮中添加含植物乳杆菌的复合益生菌对仔猪血清IgG、IgM、IgA含量没有显著影响。Kin等[36]发现在仔猪饲粮中添加益生菌复合剂,不影响血清免疫球蛋白含量。本试验中,BF组与NC组相比显著提高了断奶仔猪血清中IgG、IgM、IgA的含量,说明苦荞黄酮可以显著提高断奶仔猪的免疫球蛋白含量,增强免疫功能。许效群等[37]研究发现,苦荞糖皮总黄酮可以显著提高脾脏指数,提高吞噬细胞的吞噬能力和血清血溶水平,增强细胞免疫和体液免疫,从而提高机体的特异性免疫和非特异性免疫能力,增强免疫功能,与本试验结果一致。肠道是最大的消化器官,也是最大的免疫器官,BF组仔猪血清IgA含量显著高于其余各组,说明BF组仔猪黏膜免疫应答良好,肠道发育完善。结合生长性能和血清指标,苦荞黄酮未通过生长轴途径表现出对生长的促进作用,而可能是通过提高机体免疫力,特别是肠道健康促进营养物质吸收,达到促生长的作用。
3.5 植物乳杆菌和苦荞黄酮及其复合物对断奶仔猪血清抗氧化指标的影响
在新陈代谢过程中不断产生的一系列自由基通过氧化作用会加速机体衰老进程,降低免疫功能并诱发各种疾病。因此,机体防御体系中抗氧化能力的强弱与健康程度存在着密切联系,该抗氧化防御体系有酶促类和非酶促类2个体系,酶促类包括SOD、GSH-Px和CAT,非酶促类包括维生素C、维生素E、谷光甘肽(GSH)等。T-AOC是反映整个机体总的抗氧化能力的指标,其高低决定了机体清除自由基的能力。SOD、GSH-Px和CAT是酶促体系中常用反映抗氧化能力的指标,反映了机体清除氧自由基的能力。SOD主要清除超氧阴离子自由基,GSH-Px是体内重要的自由基捕获酶之一,具有清除自由机和衍生物的作用,减少脂质过氧化物的形成。CAT可以将SOD清除超氧阴离子自由基时产生的过氧化氢清除而生成水。MDA是氧自由基攻击细胞膜中多不饱和脂肪酸引发脂质过氧化反应形成的脂质过氧化物,可直接或间接引起细胞损伤。因此,MDA含量的高低可以反映体内脂质过氧化反应程度,间接反映细胞受氧自由基攻击损伤的严重程度。本试验中,BF组仔猪血清T-AOC与NC组没有显著差异,其原因可能是苦荞黄酮已有的抗氧化性研究主要基于体外化学环境的抗氧化试验,而本试验是通过体内试验后测定部分反映抗氧化能力的指标,动物体内生物反应复杂,受影响因素多,苦荞黄酮的抗氧化作用在经过动物复杂的生物环境后在某些抗氧化指标上不一定表现出作用。也有可能是添加剂量不足以引起抗氧化指标的变化。另外,饲粮中的抗氧化剂与苦荞黄酮是否相互作用而影响抗氧化能力也可能是原因之一。LP组可以显著提高断奶仔猪血清T-AOC、SOD、GSH-Px和CAT的活性,显著降低血清MDA含量,表明添加植物乳杆菌提高了机体清除新陈代谢过程中产生自由基的能力,降低了机体氧化受损程度,提高了机体的健康水平。
4 结 论
在本试验条件下,饲粮中添加苦荞黄酮提高了断奶仔猪ADG,改善了断奶仔猪机体免疫功能;饲粮中添加植物乳杆菌或植物乳杆菌与苦荞黄酮复合物增强了断奶仔猪机体抗氧化能力;植物乳杆菌、苦荞黄酮及其复合物还提高了仔猪对饲粮营养物质的消化率。
[1] BARTON M D.Antibiotic use in animal feed and its impact on human health[J].Nutrition Research Reviews,2000,13(2):279-299.
[2] 卢国民,孙虎芝,任慧英,等.抗生素替代品及其作用机理的研究进展[J].中国畜牧兽医,2014,41(12):276-281.
[3] 朱丹,张佩华,文宇,等.益生菌在养猪生产上的应用研究进展[J].养猪,2014(3):17-19.
[4] 董晓丽,张乃锋,周盟,等.一株乳酸菌GF103的分离鉴定及体外益生效果评价[J].动物营养学报,2012,24(9):1832-1838.
[5] 周盟,张乃锋,董晓丽,等.益生菌对断奶仔猪生长性能、免疫器官指数及胃肠道pH的影响[J].动物营养学报,2014,26(2):445-452.
[6] 柴建民,魏荣贵,刘希峰,等.植物乳杆菌和非淀粉多糖复合酶对断奶仔猪生长性能、粪便微生物菌群及血清指标的影响[J].动物营养学报,2016,28(6):1859-1866.
[7] 甘利平,杨维仁,张崇玉,等.植物提取物的生物学功能及其作用机理[J].动物营养学报,2015,27(9):2667-2675.
[8] 刘栓娣,赵媛媛.苦荞麦的药理作用研究进展[J].国际中医中药杂志,2016,38(11):1053-1056.
[9] 于光远,边连全.大豆黄酮在养猪生产中的应用与研究进展[J].猪业科学,2014(2):64-66.
[10] 邓雪娟,刘国华,蔡辉益,等.分光光度计法测定家禽饲料和食糜中二氧化钛[J].饲料工业,2008,29(2):57-58.
[11] 王水泉,包艳,董喜梅,等.植物乳杆菌的生理功能及应用[J].中国农业科技导报,2010,12(4):49-55.
[12] 张婧菲,王建军,王恬.竹叶提取物对断奶仔猪生产性能、血浆抗氧化水平和免疫性能的影响[C]//中国畜牧兽医学会2011学术年会论文集.成都:中国畜牧兽医学会,2011:228.
[13] 武书庚,刁其玉,石波,等.藤茶黄酮对仔猪生产性能的影响[J].饲料工业,2005,26(7):29-31.
[14] 王士长,陈静,潘健存,等.植物乳杆菌对断奶仔猪生产性能和血液生化指标的影响[J].中国畜牧兽医,2006,33(8):67-70.
[15] 索成,尹业师,王小娜,等.植物乳杆菌对断奶仔猪生长性能及猪肉品质的影响[J].中国食品学报,2012,12(7):155-161.
[16] 董晓丽,张乃锋,周盟,等.复合菌制剂对断奶仔猪生长性能、粪便微生物和血清指标的影响[J].动物营养学报,2013,25(6):1285-1292.
[17] 朱伟云,姚文,毛胜勇.肠道微生物研究:从组成到功能——肠道健康功能微生物的研究进展[C]//第三届第八次全国学术研讨会暨动物微生态企业发展战略论坛论文集.珠海:中国畜牧兽医学会,2006:191-194.
[18] 黄金华,梁珠民,宁国信,等.复合益生菌制剂对断奶仔猪的生长性能、养分消化率和血清生化指标的影响[J].饲料工业,2014,35(12):27-31.
[19] 周盟,张乃锋,董晓丽,等.益生菌对断奶仔猪生长及消化性能的影响[J].饲料工业,2013,34(2):18-21.
[20] 李方方,朱涛涛,朱宇旌,等.大豆异黄酮对断奶仔猪生长性能、免疫性能、养分消化率和粪中微生物菌群的影响[J].养猪,2015(5):25-29.
[21] 张乃锋,王杰,崔凯,等.植物乳杆菌GF103对生长猪生长性能、营养物质消化率及粪便微生物数量的影响[J].动物营养学报,2015,27(6):1853-1860.
[22] HUANG C H,QIAO S Y,LI D F,et al.Effects ofLactobacillion the performance,diarrhea incidence,VFA concentration and gastrointestinal microbial flora of weaning pigs[J].Asian-Australasian Journal of Animal Sciences,2004,17(3):401-409.
[23] 杨继琼.植物乳杆菌对肉兔养分消化率及肠道消化酶活性的影响[J].饲料研究,2016(9):1-3,22.
[24] 林谦,戴求仲,宾石玉,等.益生菌与酶制剂对黄羽肉鸡血液生化指标和免疫性能影响的协同效应研究[J].饲料工业,2012,33(14):31-36.
[25] 赵萌,郁建生,郁建平,等.藤茶总黄酮对仔猪血清生化指标及免疫功能的影响[J].中国畜牧兽医,2016,43(5):1221-1225.
[26] 程忠刚,林映才,周桂莲,等.大豆黄酮对仔猪生产性能及血液生化指标的影响[J].河南科技大学学报:农学版,2003,23(4):44-48.
[27] 张建梅,李晓颖,谢全喜,等.复合微生态制剂对断奶仔猪生产性能、粪便菌群及血液指标的影响[J].中国微生态学杂志,2012,24(9):796-800,804.
[28] KO T C,LEE J H,KIM B C,et al.Effects of phase feeding and sugar beet pulp on growth performance,nutrient digestibility,blood urea nitrogen,nutrient excretion and carcass characteristics in finishing pigs[J].Asian-Australasian Journal of Animal Sciences,2004,17(8):1150-1157.
[29] 李丹,张乃锋,张秀云,等.饲粮添加代乳品对断奶仔猪生产性能及血清指标的影响[J].中国畜牧杂志,2015,51(11):64-68.
[30] 徐子伟.仔猪肠道损伤修复营养调控及其机制和应用[J].动物营养学报,2014,26(10):3033-3035.
[31] 曲培滨.桑叶黄酮和热带假丝酵母对犊牛生长性能、屠宰性能、肉品质及血清指标的影响[D].硕士学位论文.邯郸:河北工程大学,2015.
[32] 甘荫全.中草药提取物对猪血清GH和IGF-Ⅰ水平的影响[D].硕士学位论文.长沙:湖南农业大学,2004.
[33] 刘辉,季海峰,王四新,等.益生菌对生长猪生长性能、粪便微生物数量、养分表观消化率和血清免疫指标的影响[J].动物营养学报,2015,27(3):829-837.
[34] 上官明军,王芳,张红岗,等.菊粉对蛋雏鸡生长性能、免疫器官指数和血清免疫球蛋白的影响[J].动物营养学报,2009,21(1):118-122.
[35] 王杰,艾萍萍,刁其玉,等.复合益生菌和纤维寡糖对断奶仔猪生长性能、粪便微生物及血清指标的影响[J].动物营养学报,2016,28(3):881-890.
[36] KIM K H,INGALE S L,KIM J S,et al.Bacteriophage and probiotics both enhance the performance of growing pigs but bacteriophage are more effective[J].Animal Feed Science and Technology,2014,196:88-95.
[37] 许效群,刘志芳,霍乃蕊,等.苦荞糠皮总黄酮的抗氧化活性及免疫调节活性[J].中国食品学报,2012,12(6):42-47.
*Corresponding authors: ZHANG Naifeng, professor, E-mail: zhangnaifeng@caas.cn; DIAO Qiyu, professor, E-mail: diaoqiyu@caas.cn

