预曝气及提取方法对活性污泥胞外聚合物的影响
吕文洲,王小宝,刘 英,孙慧萍,王 聪 (宁波大学建筑工程与环境学院市政与环境工程系,浙江 宁波315211)
活性污泥的胞外聚合物(EPS)通过合适的方法提取后可用于水中悬浮物或者金属离子的去除[1-3].提取 EPS的得率及其各组分占比会受到污泥预处理及提取方法[4-5]的影响,比如对活性污泥短时间预曝气可以明显提高超声法提取EPS的得率,使得预曝气后EPS的絮凝率和得率分别提高了 31%和 34%[6];采用化学法的提取效率一般比物理法高且提取过程不会引起细胞大量裂解[7-9],也有研究表明化学法提取的 EPS的络合性能更好[10],因此探索合理的污泥预处理及EPS提取方法对于EPS得率及对污染物的去除效率提升具有重要意义.不同提取方法提取的EPS对金属离子的去除也有不同机制,如利用加热法提取的 EPS对金属离子的去除中, Cd2+、Zn2+同 EPS之间存在多种作用方式,且多糖在吸附过程中起着重要作用[11];利用NaOH法从生物膜中提取的EPS对 Cu2+吸附的主要作用是离子交换[12];利用超声法从活性污泥中提取的EPS吸附 Cd2+和 Cu2+时吸附位点对金属离子吸附的主要机制是静电作用[13].截至目前,采用预曝气及不同提取方法提取的 EPS及组分对于高岭土及Cr3+的去除机制差异尚不明晰.本研究旨在探索提高EPS得率和对污染物去除效果的方法,比较了超声波提取与化学提取方法的异同,利用三维荧光解析了 EPS组分差异并通过红外光谱法探讨了EPS对于高岭土絮凝及Cr3+吸附能力差异的深层机制,为利用EPS去除水中悬浮物及重金属离子的应用提供理论依据.
1 材料和方法
1.1 实验材料
实验污泥为宁波市某污水处理厂的二沉池回流污泥.该厂采用 A2/O 工艺处理生活废水,日处理水量2×105m3,回流污泥浓度(SS)8.5~11.5g/L挥发性悬浮颗粒物质量(VSS)与悬浮颗粒物质量(SS)的比值为58%~65%,pH值为6.5~7.2.
1.2 实验试剂
高岭土购自国药集团化学试剂有限公司,平均颗粒粒径为0.45μm.使用Cr(NO3)3配制浓度为1000mg/L 的 Cr3+储备液 250mL,滴加 2~3 滴0.1mol/L的 HNO3防止沉淀.研究所用试剂如未特别说明均为分析纯级.
1.3 实验设计
将污泥置于 4L的有机玻璃容器中,利用稀H2SO4或稀NaOH溶液调节pH值至7,控制温度在25℃.试验采用电磁振动式空气泵连接砂芯曝气头进行曝气,转子气体流量控制空气流量并使用便携式溶解氧仪(HQ40d,Hach ,USA)监测溶解氧,使其在 2~3mg/L.为了考察不同预曝气时间对提取EPS的影响,预曝气共6h,每2h取一次污泥样进行EPS提取.
超声法提取 EPS参照文献[13]:取预曝气的污泥25mL,加入10mL去离子水混合均匀后置于超声波细胞破碎仪上进行超声处理(时间2min、间隔3s、功率210W),将处理后的污泥通过高速冷冻离心机(Eppendorf Centrifuge 5415R,Germany)在4℃、12000r/min下离心10min得到的上清液即为EPS试样.
甲醛+NaOH提取EPS法参照文献[14]:取出预曝气的污泥 25mL,加入 150μL质量分数为36.5%的甲醛,在磁力搅拌器(IKA@RH basic 1,Germany)上搅拌 1h(转速 200r/min),加入 10mL浓度为1mol/L的NaOH,最后继续在磁力搅拌器上搅拌 3h.采用与超声法一致的离心方法获得EPS.
1.4 分析方法
新课程改革提出了“以学生为发展”的教育理念,提倡让学生在课堂活动中发挥出自身主体地位与价值,有效的激发学生知识能动性,让整个教学活动得以有序的实施。在这种课程教育理念之下,初中数学课堂就提出了要对学生自主探究能力进行培养的教学理念,因为如果能够做好这一项工作就能让学生真正参与到自主探究活动之中,进而就能让学生各方能力得以发展和进步,基于这一培养目标,笔者也提出了如下建议:
1.4.1 絮凝率的测定 在100mL比色管中加入0.4g高岭土,3mL质量浓度为 1%的 CaCl2溶液,2mL EPS试样,定容至 100mL,混匀后静置5min,然后用移液器吸取其上清液5mL于比色皿中,用分光光度计(UNICO UV-2000,中国)在550nm下测其吸光度(B).以不加EPS试样、在相同操作条件下的高岭土悬浊液的吸光度作对照(A).以絮凝率(E)来表示絮凝活性,计算方法如式(1):

所有试验均设 3个重复,结果以平均值±标准偏差表示,下同.
1.4.2 Cr3+去除率测定 吸附去除实验参照文献[15]:在50mL的离心管中先加入5mL EPS试样,再加入 1mL金属 Cr3+储备液,超纯水定容到20mL,用0.1mol/L HNO3和0.1mol/L NaOH调节pH 值到4.5.在 25℃,200r/min转速下振荡2h,然后在12,000r/min转速下离心10min,取适量上清液经过 0.45μm 滤膜过滤,利用电感耦合等离子体发射光谱仪(PQ 9000Elite, Germany)测定Cr3+的浓度. Cr3+去除率可以根据式 (2)计算:

式中:C0为 Cr3+初始浓度, mg/L; Ce为 Cr3+最终浓度, mg/L.1.4.3 EPS组分测定 EPS的多糖含量(PS)采用苯酚硫酸法测定,用葡萄糖作为标准物质[16];蛋白质含量(PN)用 Bradford法测定,用牛血清蛋白作为标准物质[17];核酸含量采用二苯胺法测定,用小牛胸腺 DNA作为标准物质[18];不同提取方法对污泥絮体的影响采用微分干涉显微观察法:使用胶头滴管取 1滴污泥于载玻片上,制成水浸片利用微分干涉显微镜(尼康 80i,日本)观察;三维荧光法解析:使用荧光光谱仪(日立 F-4600,日本)记录EPS的三维荧光光谱,激发光源是氙弧灯,激发波长 Ex=220~400nm,发射波长 Em=280~550nm,激发和发射狭缝宽度为 5nm,激发波长间隔为 2nm,发射波长间隔为 5nm,扫描速度为2000nm/min,响应时间为 5s;红外光谱法解析:在室内温度 25℃条件下,取经过真空冷冻干燥机(CHRIST ALPHR 1-2LD,Germany)处理后的EPS跟干燥的KBr按1:200混合均匀后制片,利用红外光谱仪(Nicolet 5700,USA)在波数 4000~400cm-1的范围内进行扫描[19].
2 结果
2.1 预曝气及提取方式对EPS得率的影响
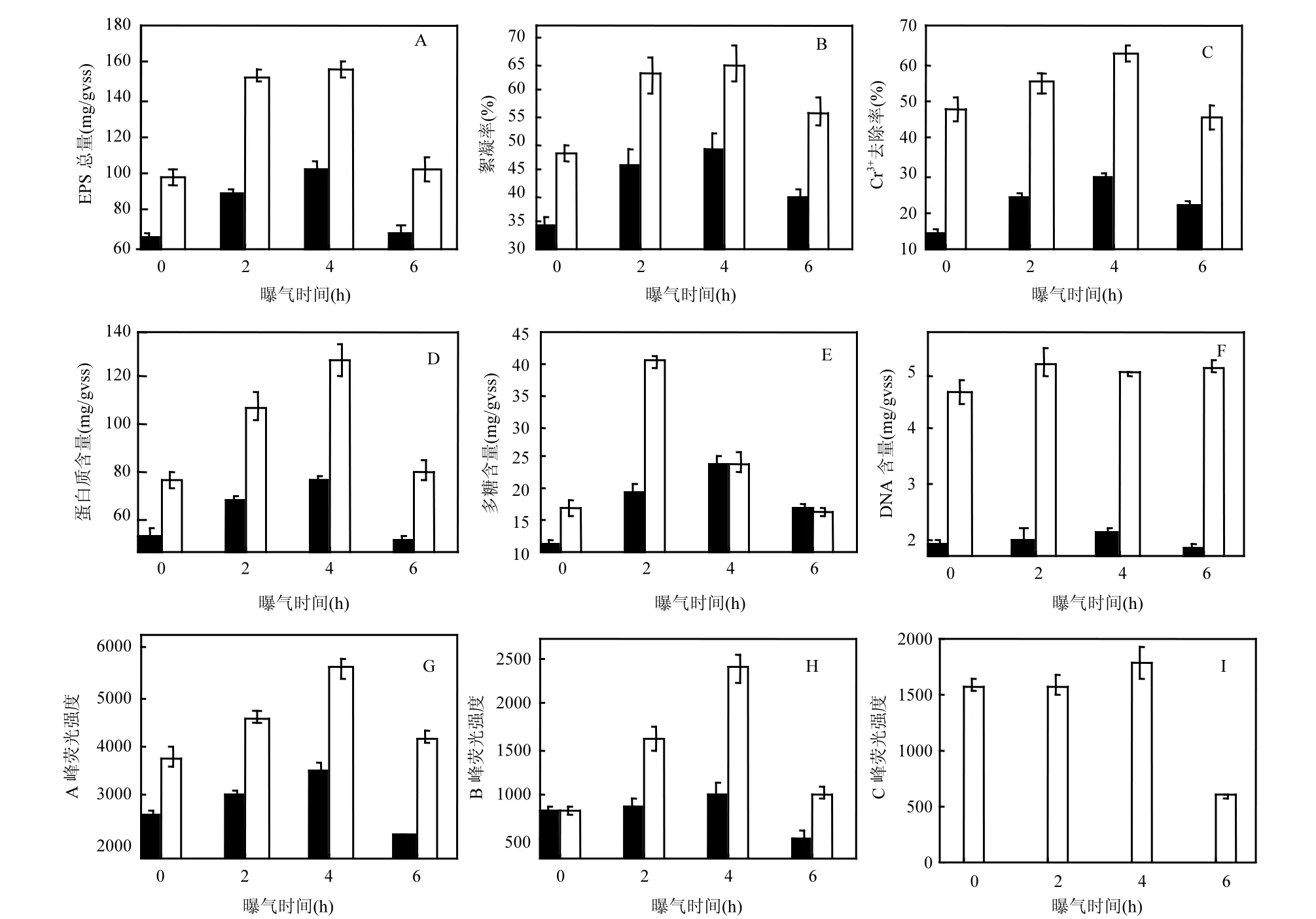
图1 预曝气时间及提取方式对EPS的影响Fig.1 Effects of pre-aeration time and extraction methods on the yield and components of EPSA.EPS总量; B.絮凝率; C.Cr3+去除率; D.蛋白质含量; E.多糖含量; F.DNA含量; G~I. EPS荧光强度
预曝气处理活性污泥 6h 过程中,随预曝气时间的延长,超声法、甲醛+NaOH法提取的EPS得率的变化规律相似(图 1A),即在 0~4h内 EPS得率随预曝气时间的增加而增加,之后EPS得率均有降低,预曝气4h时2种方法提取的EPS得率最高,分别为102.43,156.99mg/gVSS.甲醛+NaOH法提取的EPS是超声法的1.5~1.7倍.
2.2 预曝气及提取方式对EPS化学组分的影响
图1显示,PN和PN+PS含量都在预曝气4h时最高,超声法提取的PN和PN+PS分别为75.94和100.29mg/gVSS,甲醛+NaOH法提取的PN和PN+PS分别为127.62,151.97mg/gVSS;然而2种方法提取的EPS中PS和DNA含量随预曝气时间的变化规律并不一致,其中甲醛+NaOH法提取的 PS在曝气 2h达到最高(图 1E),含量为40.13mg/gVSS;此外在4h时内DNA含量最高分别为 2.14(超声法)和 5.21mg/gVSS(甲醛+NaOH法,见图1F),相对于PN和PS,DNA的量较小.从EPS各化学组成来看,甲醛+NaOH法提取的EPS中的PN、PS、DNA含量分别是超声法的1.4~1.7、0.8~2和 2.3~2.7倍.
不同曝气时间下超声法和甲醛+NaOH法提取的EPS对高岭土的絮凝率(图1B)和 Cr3+的去除率(图1C)与EPS得率(图1A)的变化规律一致,即在4h时EPS对高岭土絮凝率和Cr3+的去除率最高,且对高岭土的絮凝率分别达到了 49%和65%,对Cr3+的去除率分别达到了30%和63%.
利用SPSS 19.0 软件分析了EPS及其组分与 EPS对高岭土絮凝率和对 Cr3+去除率的相关性(表1),结果显示EPS对高岭土的絮凝率与EPS总量(P>0.05, R2=0.570)、PN(P>0.05, R2=0.592)、PS(P>0.05, R2=0.363)相关性不明显;EPS对Cr3+的吸附效果与 EPS得率(P<0.05, R2=0.843)、PN(P<0.05, R2=0.850)、PN/PS(P<0.05, R2=0.825)显著相关,说明EPS中蛋白组分是Cr3+去除的主要物质基础,这与Wang等[20]研究发现EPS中主要是类蛋白质(类色氨酸)与重金属离子结合的结论相一致.

表1 EPS中各组分含量与絮凝率及Cr3+去除率的相关分析Table 1 Correlation analysis of contents of various components in EPS with the flocculation efficiencies as well as the Cr3+ removal rates
2.4 预曝气及提取方法对EPS荧光组分及红外光谱的影响
三维荧光光谱(EEM)中可以定义 3种峰,即A、B和C峰(图2).A峰的激发和发射(Ex/Em)光谱位于 225/335~350nm 处,B峰的 Ex/Em 在275~280/330~350nm处,这2个峰分别表征的是芳香蛋白物质(低激发波长类色氨酸)和溶解性微生物代谢产物(高激发波长类色氨酸)[4]; C峰位于320~340/380~450,表征的是天然溶解性有机物,被描述为胡敏酸[21].芳香蛋白(即A峰)、溶解性微生物代谢产物(即 B峰)在所有提取的 EPS中存在[21-23].三维荧光光谱结果显示(图1中 G、H和I),超声法和甲醛+NaOH法提取的EPS中的荧光物质强度变化规律跟 EPS得率及其对高岭土絮凝率的变化规律相似,在预曝气4h时EPS中的荧光物质A峰强度和B峰强度最高.在预曝气0h、2h、4h、6h时超声法提取的EPS中A峰强度比甲醛+NaOH法分别低30%、35%、38%、48%;B峰强度分别低0%、47%、58%、50%;然而 C峰只出现在甲醛+NaOH法提取的EPS中.
图 3A、3B的红外光谱显示,预曝气处理对特征吸收峰的影响相对较小,仅仅改变了相应特征峰的透光率,而提取方式对EPS的红外光谱影响较大,不仅改变了相应特征峰的透光率,而且又影响了特征峰的种类.2种方式提取的EPS在如下光谱带中振动相类似:在3419cm-1附近都有明显的宽峰,其由-OH伸缩振动形成[25];2921cm-1附近与烷烃类有机物及大分子多糖中的-CH2-伸缩振动有关;在 1620cm-1、1540cm-1处的强烈吸收峰为蛋白中酰胺I(主要是C=O伸缩振动)和酰胺 II(C-N伸缩振动和 N-H变形振动)[26];在1460cm-1附近吸收峰是甲基中 C-H键振动产生[27];在 1070cm-1吸收峰是多糖类化合物 C-O键的伸缩振动导致[28].对比以上吸收峰强度,甲醛+NaOH法提取的EPS相应基团的量明显高于超声法提取的 EPS, 其中-OH、-CH2-、C=O、C-N、C-H和 C-O分别高出后者 55.81%、66.61%、67.82%、67.82%、84.84%和 41.40%.值得一提的是,有些光谱带只存在于甲醛+NaOH法提取的 EPS中,如在 1790~1720cm-1是羰基的伸缩振动,该物质与羧酸有关;在 1280~1137cm-1是碳氧键的伸缩振动,其与脂类、苯酚、乙醚等物质有关;在1000~500cm-1区域出现多个小尖峰,是红外光谱的“指纹区”,表明有含硫和磷基团的存在.甲醛+NaOH法提取的EPS中的这些特别基团可能参与了对Cr3+的去除,比如Wei等[22]指出COO-可与金属离子结合;Zhang等[13]指出含硫和磷的基团对金属离子有一定的结合作用.


图2 2种方法提取的EPS的荧光组分含量随预曝气时间的变化Fig.2 Changes of the EEM fluorescence spectra of the EPS extracted by the ultrasonic or formaldehyde+NaOH versus the pre-aeration time

图3 预曝气前后超声法及甲醛+NaOH法提取的EPS红外光谱图Fig.3 FTIR spectrograms of the EPS extracted by ultrasonic or formaldehyde+NaOH before and after pre-aeration
2.5 两种提取方法提取的EPS吸附Cr3+前后荧光物质组分及基团变化
从图4中可以看出EPS吸附Cr3+之后,所有荧光峰的强度都在减小,表明 EPS络合了 Cr3+,说明发生了荧光猝灭,这与 Wei等[24]研究得出荧光性类蛋白物质可与 Zn2+络合而导致荧光猝灭的结果类似.超声法提取的EPS与Cr3+结合后A峰比B峰荧光强度猝灭的量要大(图4a和图4c),A峰荧光值从3500降到300,B峰荧光值从1000降到200;相比而言,甲醛+NaOH法提取的EPS与Cr3+结合后A峰完全消失(从5600降到0),C峰衰减了2200(从2400降到200),然而B峰变化较小(从 2400降到 1800),这表明甲醛+NaOH法提取的EPS对Cr3+去除率高的原因不仅仅在于提取的EPS总量的增加,另一方面也与提取出了腐殖质有关(C峰),再者也可能与蛋白的种类有关(A、B峰强度在吸附前后的变化).
超声法提取的EPS吸附Cr3+前后的红外光谱图透光率变化很小(图 5A),吸附 Cr3+后只有光谱 1660cm-1、1090cm-1的透光率有变化,吸收峰强度分别减小了5.11%和4.81%.甲醛+NaOH法提取的EPS吸附 Cr3+前后的红外光谱图变化较大(图 5B),特别是光谱 1700~1720cm-1、1652cm-1透光率变化最大,且吸收峰强度分别减小了53.30%和 81.62%,表明-COOH、-NH2与 Cr3+发生了络合作用[13,24],证实了前面提到的羧基参与Cr3+去除的推测. 透光率在1000~500cm-1的指纹区变化也较大,说明了有含硫和磷的基团参与了 对Cr3+的去除.

图4 EPS吸附Cr3+前后的三维荧光图谱Fig.4 3D-EEM fluorescence spectrograms of the EPS extracted by ultrasonic or formaldehyde+NaOH before and after adsorption of Cr3+

图5 不同提取方式提取的EPS吸附重金属Cr3+前后红外光谱强度的变化Fig.5 Changes of FTIR spectra of the EPS extracted by ultrasonic or formaldehyde+NaOH before and after adsorption of Cr3+
2.6 预曝气、提取方法及EPS吸附Cr3+前后相 关基团强度的变化
预曝气对EPS的光谱强度有明显影响(图6).由图6A、6C可看出,预曝气对EPS中O-H、C-H、C=O、N-H、C=X等处吸收峰强度有一定提高作用;相比之下,甲醛+NaOH法提取的 EPS中相应基团的吸收峰强度受预曝气的影响更大,是前者的2~3倍.图6B和6D的两组数据显示,利用预曝气4h的EPS吸附Cr3+,超声法提取的EPS吸附Cr3+后EPS的红外光谱强度几乎没有变化,这跟此条件下提取的 EPS对 Cr3+去除率低的结果相一致.然而,甲醛+NaOH 法提取的 EPS吸附Cr3+之后EPS的-OH、-COOH、-NH2等基团量发生了较大的变化,透光强度分别增加了58.50%、53.30%和81.62%,说明这些基团参与了对Cr3+的络合作用.
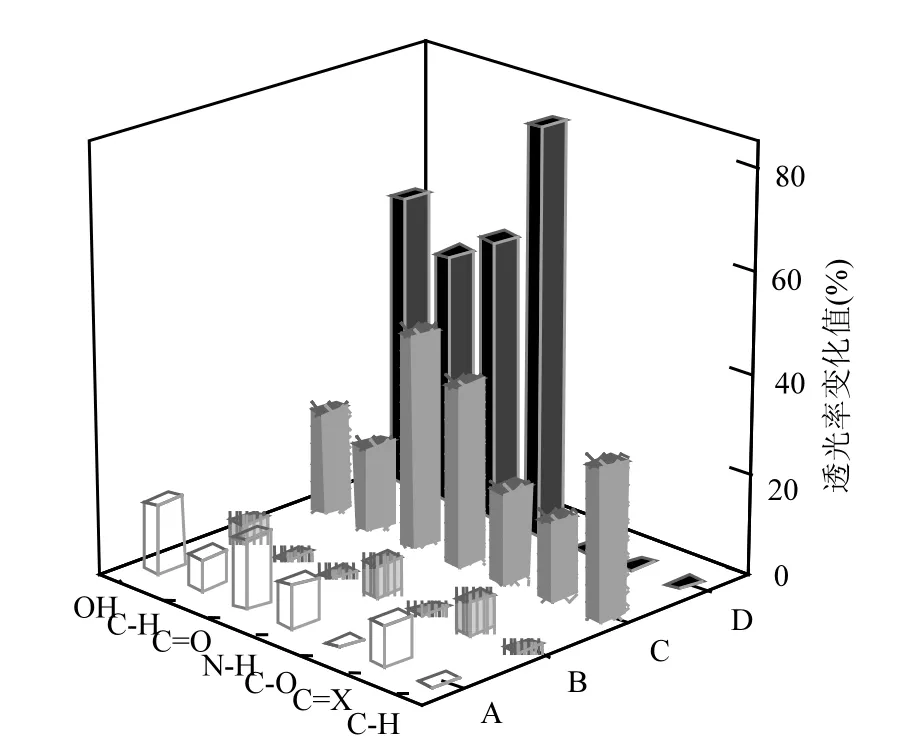
图6 EPS红外光谱中主要的特征基团预曝气前后和吸附Cr3+前后的透光率变化值Fig.6 The variation of light transmittance values of the main characteristic groups in the FTIR spectra of the EPS before and after the pre-aeration and the adsorption of Cr3+
3 讨论
3.1 提取方式对EPS产量的影响
甲醛+NaOH法提取的EPS中蛋白质和多糖的量高于超声法,与周俊等[29]的研究结果类似.其原因可能是甲醛+NaOH法对污泥中紧密结合的胞外聚合物提取效率较高.甲醛+NaOH法提取EPS的效率优于超声法的原因可以用菌胶团说[30-31]来解释:甲醛+NaOH 法是通过加强 EPS酸性基团的分离和带负电荷 EPS分子之间的排斥促进了 EPS从菌胶团中的大量溶出[9];而超声是一种物理能量形式,虽能产生强烈脉冲力、高加速度、空化效应、搅拌等特殊作用可以使污泥絮体分散,能使菌胶团有效解聚[32],但菌胶团破碎的并不彻底,因此可能仍然有大量的EPS未能从菌胶团中分离出来(见图7),此外荧光数据也显示腐殖质信号未在超声法提取的EPS中检出(图2a).
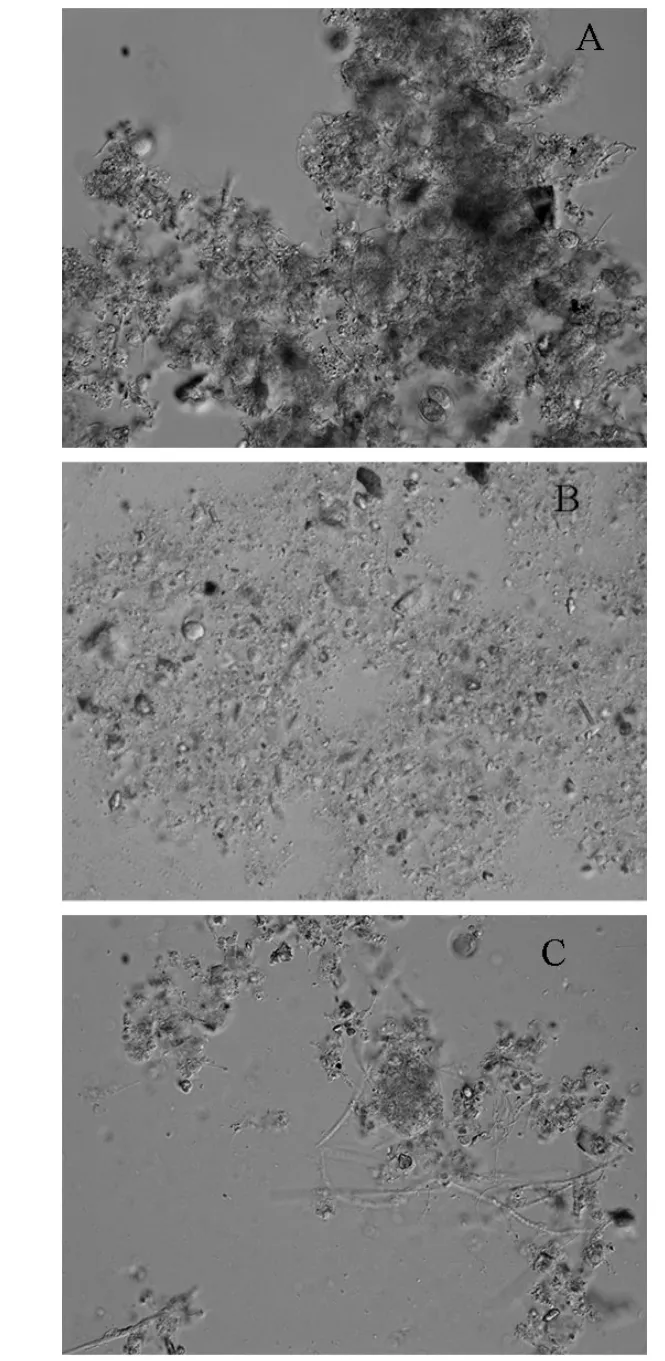
图7 超声法、甲醛+NaOH法处理污泥的微分干涉图像Fig.7 Microscopic images of the activated sludge treated by ultrasonic or formaldehyde+NaOH
3.2 预曝气对EPS产量的影响
图1A、1B显示,污泥经过预曝气提高了EPS的得率和对高岭土的絮凝率,与 Zhang等[6]的研究结果相似. EPS在预曝气前期(0~4h)增加的原因可能是:曝气产生的流体剪切力作用使菌胶团中的EPS三维凝胶状结构[30]和絮凝的EPS“云”结构[31]紧密程度降低,因而EPS更加容易被提出;另一可能的原因是,污泥中的产絮微生物在好氧过程中利用废水中有限营养进行生物絮凝剂合成(主要是 EPS)[6],从而导致 EPS总量的增加,这一推测有待进一步验证;预曝气后期(如 4h后)EPS提取量开始降低可能是因为剩余污泥经过一段时间曝气,溶解性营养物质被耗尽,微生物开始利用EPS作为营养物质,因此EPS被消耗而降低.张云霞等[33]研究结果也证实了处于饥饿状态下的二沉池活性污泥或好氧颗粒污泥的 EPS中,多糖和蛋白质会被降解,且在3~10h之间降解速率最快.
3.3 三维荧光光谱和红外光谱联合解析两种方式提取的EPS差异
芳香蛋白(A峰)、溶解性微生物代谢产物(B峰)在2种方式提取的EPS中存在,然而腐殖质(C峰)仅在甲醛+NaOH法提取的 EPS中被检测到(如图2-5~8).Qu等[34]认为,腐殖质主要分布在溶解性胞外有机物质(dEOM)中,而结合性胞外有机物质(bEOM)只含有蛋白质和多糖,但本研究用超声法提取的 EPS中并没有检测到腐殖质(C峰).而Zhang等[35]研究认为污泥中的腐殖质一部分来自废水,菌胶团形成的过程中大量吸附废水中腐殖质、多糖、蛋白、DNA等物质后形成结构紧密且复杂的结合性胞外有机物质(bEOM),超声法仅在几分钟的作用下难以提取紧密结合在菌胶团上的腐殖质. 此外,2种方法提取的EPS差异还表现在参与吸附的基团差异.超声法提取的EPS吸附Cr3+前后的红外光谱图透光率变化很小,吸附后只有光谱1660,1040cm-1的透光率有变化(图 5A).而甲醛+NaOH法提取的 EPS吸附Cr3+前后的红外光谱图变化较大(图 5B),3330、3450cm-1是-OH的伸缩振动峰,吸附后吸收峰向更高的波数段移动了 120cm-1,表明-OH在吸附过程中与Cr3+结合;1620,1650cm-1处的吸收峰为蛋白中酰胺 I(主要是 C=O 伸缩振动)和酰胺II(C-N伸缩振动和N-H变形振动)[26],吸附后比吸附前移动了30cm-1,表明蛋白质中的-COOH、-NH2在吸附时也发生了反应;2950,2500cm-1的峰值转移到较低的波数,表明EPS吸附Cr3+与烷烃类有机物及大分子多糖和羧酸有关;1460、1390cm-1处的峰对应的是-C=O的伸缩振动和-OH的变形振动,吸附后向更低的波数段移动了70cm-1,这些物质通常衍生自羧酸盐,醇或酚结构[36].然而 EPS 吸附 Cr3+之后 1150,1070,769,698cm-1等吸收峰一起消失,表明有脂类、苯酚、乙醚、多糖衍生物和含有硫和磷基团的物质参与了吸附过程[13].
3.4 EPS结合Cr3+的机制
实验结果表明,甲醛+NaOH法提取的EPS对Cr3+去除效率是超声法的2.1~3.2倍,其主要归因于前者提取的EPS总量较高,另一方面可能与前者提取的EPS中的腐殖质有关[37-38],由表1可以看出,EPS吸附Cr3+与EPS中蛋白质含量、荧光性物质类腐殖质含量呈显著相关.有关研究指出EPS主要通过络合、螯合、离子交换等物理-化学作用致使多价重金属离子与蛋白质、多糖和腐殖质形成螯合物[11,39-40],本研究的三维荧光分析证实了荧光性蛋白物质(A峰)和荧光性腐殖质(C峰)与金属Cr3+结合后荧光信号猝灭;红外光谱也显示 EPS与金属 Cr3+结合后 3300~3500cm-1(-OH)、1700~1720cm-1(-COOH)、1652cm-1(-NH2)等处吸收峰波长发生移动,且-OH在pH值为4.5时不能解离H+,因此络合是主要的吸附机制[39].
4 结论
4.1 污泥经预曝气处理,可提升 EPS的提取量,且在4h时得率最高;甲醛+NaOH法提取的EPS中的PN、PS、DNA含量分别是超声法的1.4~1.7、0.8~2和2.3~2.7倍.甲醛+NaOH法提取EPS的得率、对高岭土的絮凝率和对Cr3+的除去率分别是超声法 1.5~1.7、1.3~1.4 和 2.1~3.2 倍.
4.2 三维荧光结果表明胡敏酸类物质只存在甲醛+NaOH法提取的EPS中,且此类腐殖质与Cr3+去除率呈极显著相关(P<0.01,R2=0.920),说明利用该化学法提取的 EPS对金属离子的去除效率优于超声法,其原因不仅在于总 EPS量的提高,也在于EPS组分的差异.
4.3 甲醛+NaOH法提取 EPS中存在区别于超声法的特殊基团,其中的羟基(-OH)、氨基(-NH2)和羧基(-COOH)等基团可以和 Cr3+发生配位络合作用.
[1]Li W W, Yu H Q. Insight into the roles of microbial extracellular polymer substances in metal biosorption [J]. Bioresource Technology, 2014,160(2):15-23.
[2]Sheng G P, Yu H Q, Li X Y. Extracellular polymeric substances(EPS) of microbial aggregates in biological wastewater treatment systems: a review [J]. Biotechnology Advances, 2010,28(6):882.
[3]Wei L, Li Y, Noguera D R ,et al. Adsorption of Cu (II) and Zn (II)by extracellular polymeric substances (EPS) in different sludges:Effect of EPS fractional polarity on binding mechanism [J].Journal of Hazardous Materials, 2016,321:473.
[4]张俊珂,曾 萍宋,于会斌,等.受四环素影响的活性污泥胞内外聚合物特征 [J]. 中国环境科学, 2016,36(3):751-758.
[5]包宜俊,杨存满,李 颖,等.光谱法研究胞外聚合物与四溴双酚A的相互作用 [J]. 中国环境科学, 2016,36(6):1773-1779.
[6]Zhang Z, Zhang J, Zhao J, et al. Effect of short-time aerobic digestion on bioflocculation of extracellular polymeric substances from waste activated sludge [J]. Environmental Science and Pollution Research, 2015,22(3):1812-1818.
[7]Guo X, Liu J, Xiao B. Evaluation of the damage of cell wall and cell membrane for various extracellular polymeric substance extractions of activated sludge [J]. Journal of Biotechnology,2014,188(1):130-135.
[8]D'Abzac P, Bordas F, van Hullebusch E ,et al. Effects of extraction procedures on metal binding properties of extracellular polymeric substances (EPS) from anaerobic granular sludges [J].Colloids and Surfaces B, Biointerfaces, 2010,80(2):161-168.
[9]D'Abzac P, Bordas F, Van Hullebusch E ,et al. Extraction of extracellular polymeric substances (EPS) from anaerobic granular sludges: comparison of chemical and physical extraction protocols [J]. Applied Microbiology and Biotechnology, 2010,85(5):1589-1599.
[10]Comte S, Guibaud G, Baudu M. Relations between extraction protocols for activated sludge extracellular polymeric substances(EPS) and complexation properties of Pb and Cd with EPS: Part II. Consequences of EPS extraction methods on Pb2+and Cd2+complexation [J]. Enzyme & Microbial Technology, 2006,38(2):237-245.
[11]郑 蕾,丁爱中,王金生,等.不同组成活性污泥胞外聚合物吸附Cd2+、Zn2+特征 [J]. 环境科学, 2008,29(10):2850-2855.
[12]胡学伟,李 姝,荣 烨,等.不同 EPS组成生物膜对Cu2+吸附的研究 [J]. 中国环境科学, 2014,34(7):1749-1753.
[13]Zhang Z, Wang P, Zhang J ,et al. Removal and mechanism of Cu(II) and Cd (II) from aqueous single-metal solutions by a novel biosorbent from waste-activated sludge [J]. Environmental Science and Pollution Research, 2014,21(18):10823-10829.
[14]Liu H, Fang H H. Extraction of extracellular polymeric substances (EPS) of sludges [J]. Journal of Biotechnology,2002,95(3):249-256.
[15]Sheng G P, Xu J, Luo H W ,et al. Thermodynamic analysis on the binding of heavy metals onto extracellular polymeric substances(EPS) of activated sludge [J]. Water Research, 2013,47(2):607-614.
[16]Adav S S, Lee D J. Extraction of extracellular polymeric substances from aerobic granule with compact interior structure[J]. Journal of Hazardous Materials , 2008,154(1—3):1120-1126.[17]Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding [J]. Analytical Biochemistry, 1976,72(1/2):248—254.
[18]Sun Y, Clinkenbeard K D, Clarke C ,et al. Pasteurella haemolytica leukotoxin induced apoptosis of bovine lymphocytes involves DNA fragmentation [J]. Veterinary Microbiology, 1999,65(2):153-166.
[19]Xia S, Zhang Z, Wang X, et al. Production and characterization of a bioflocculant by Proteus mirabilis TJ-1 [J]. Bioresource Technology, 2008,99(14):6520-6527.
[20]Wang J, Li Q, Li M M ,et al. Competitive adsorption of heavy metal by extracellular polymeric substances (EPS) extracted from sulfate reducing bacteria [J]. Bioresource Technology, 2014,163(7):374—376.
[21]Sheng G P, Yu H Q. Characterization of extracellular polymeric substances of aerobic and anaerobic sludge using three-dimensional excitation and emission matrix fluorescence spectroscopy [J]. Water Research, 2006,40(6):1233-1239.
[22]Wei L, Li Y, Noguera D R ,et al. Adsorption of Cu2+and Zn2+by extracellular polymeric substances (EPS) in different sludges:Effect of EPS fractional polarity on binding mechanism [J].Journal of Hazardous Materials, 2017,321:473-483.
[23]姚 萌,罗红元,谢小青,等.城市污水厂活性污泥胞外聚合物的三维荧光特性分析 [J]. 中国环境科学, 2012,32(1):94-99.
[24]Wei D, Li M, Wang X ,et al. Extracellular polymeric substances for Zn (II) binding during its sorption process onto aerobic granular sludge [J]. Journal of Hazardous Materials, 2015,301:407-415.
[25]王晓慧,刘永军,刘 喆,等.用三维荧光和红外技术分析好氧颗粒污泥形成初期胞外聚合物的变化 [J]. 环境化学, 2016,35(1):125-132.
[26]Guibaud G, Tixier N, Bouju A ,et al. Relation between extracellular polymers' composition and its ability to complex Cd,Cu and Pb [J]. Chemosphere, 2003,52(10):1701-1710.
[27]王子超,高孟春,魏俊峰,等.盐度变化对厌氧污泥胞外聚合物的影响 [J]. 环境科学学报, 2016,36(9):3273-3281.
[28]Zhu L, Lv M L, Dai X ,et al. The stability of aerobic granular sludge under 4-chloroaniline shock in a sequential air-lift bioreactor (SABR) [J]. Bioresource Technology, 2013,140(3):126-130.
[29]周 俊,周立祥,黄焕忠.污泥胞外聚合物的提取方法及其对污泥脱水性能的影响 [J]. 环境科学, 2013,34(7):2752-2757.
[30]Eriksson L, Steen I, Tendaj M. Evaluation of sludge properties at an activated sludge plant [J]. Waterence & Technology, 2011,25(6):251-265.
[31]Keiding K, Nielsen P H. Desorption of organic macromolecules from activated sludge: Effect of ionic composition [J]. Water Research, 1997,31(7):1665-1672.
[32]青 常,王彬斌,彭党聪,等.基于粒度分布的活性污泥胞外聚合物提取及凝聚特性分析 [J]. 环境工程学报, 2015,9(5):2284-2289.
[33]张云霞,季 民,李 超,等.好氧颗粒污泥胞外聚合物(EPS)的生化性研究 [J]. 环境科学, 2008,29(11):3124-3127.
[34]Qu F, Liang H, He J ,et al. Characterization of dissolved extracellular organic matter (dEOM) and bound extracellular organic matter (bEOM) of Microcystis aeruginosa and their impacts on UF membrane fouling [J]. Water Research, 2012,46(9):2881-2890.
[35]Zhang W, Peng S, Xiao P ,et al. Understanding the evolution of strati fi ed extracellular polymeric substances in full-scale activated sludges in relation to dewaterability [J]. Rsc. Advances,2014,5(2):1282-1294.
[36]Guibaud G, Comte S, Bordas F ,et al. Comparison of the complexation potential of extracellular polymeric substances(EPS), extracted from activated sludges and produced by pure bacteria strains, for cadmium, lead and nickel [J]. Chemosphere,2005,59(5):629-638.
[37]王雅辉,邹雪刚,舒冉君,等.胡敏素对 Pb2+吸附的响应面优化及机理 [J]. 中国环境科学, 2017,37(5):1814-1822.
[38]谢发之,谢志勇,李国莲,等.腐植酸对氧化锌吸附 Cu(Ⅱ)的影响[J]. 中国环境科学, 2017,37(8):2970-2977.
[39]Liu W, Zhang J, Jin Y ,et al. Adsorption of Pb(II), Cd(II) and Zn(II) by extracellular polymeric substances extracted from aerobic granular sludge: Efficiency of protein [J]. Journal of Environmental Chemical Engineering, 2015,3(2):1223-1232.
[40]郝晓地,唐 兴,曹亚莉.腐殖质对污泥厌氧消化的影响及其屏蔽方法 [J]. 环境科学学报, 2017,37(2):407-418.

