气相色谱-质谱法同时测定护手霜中的4种丁二醇
,
(恩福(上海)检测技术有限公司, 上海 201112)
丁二醇(BDO)常温下是一类无色、无味、透明的液体,是自然界生物体内的一种重要代谢产物,同时也是一类重要的有机和精细化工产品。因其独有的结构特性和优良的理化性质,丁二醇可用于制备油墨、熏蒸剂、增湿剂、增塑剂以及药物的手性载体等[1-3],在燃料、医药、化工、纺织、食品和日用化工等领域得到广泛的应用。保湿功能是化妆品的基本特性,不论是日常使用的唇膏,还是国际顶级的香水,丁二醇因其独特的吸湿保湿性能一直在化妆品领域中发挥重要的作用。而近年来研究发现,1,4-丁二醇在人体内可以代谢产生γ-羟基丁酸,过量的γ-羟基丁酸具有强烈的镇静和麻醉作用[4-8],已被多国列入药品管制目录。2007年多国曾发生儿童吞食含有1,4-丁二醇的玩具后中毒的事件,因此监测化妆品中的1,4-丁二醇具有非常重要的意义。尽管丁二醇在化妆品领域的应用广泛,但未见关于测定化妆品中丁二醇的报道。
当前国内外报道的丁二醇的测定方法主要有气相色谱法[9]、气相色谱-质谱法[10]、高效液相色谱法[11]以及高效液相色谱-质谱法[8,12]等,分析测定的丁二醇种类相对单一。目前国内主要应用气相色谱法测定各类基质中丁二醇的含量[3,13-16],但随着分析方法的发展和经济成本的降低,气相色谱-质谱技术因其具有高选择性、高灵敏度、可实现谱库检索定性等特点,无疑将成为检测该类物质越来越重要的手段。本工作以基质相对复杂的护手霜为样本,采用超声萃取结合气相色谱-质谱法,建立同时测定化妆品中4种丁二醇含量的分析方法,拟为化妆品以及相关行业中丁二醇的监测提供借鉴。
1 试验部分
1.1 仪器与试剂
7890B型气相色谱-质谱联用仪,配5977MSD;Vortex-Genie 2.0型漩涡振荡仪;SK 8210HP型超声振荡器;Sorvall ST 40R型高速离心机。
标准溶液:分别称取4种丁二醇标准品50.0 mg于50 mL容量瓶中,用甲醇配制成质量浓度为1.000 g·L-1的标准储备溶液,使用时用甲醇稀释上述标准储备溶液,配制成质量浓度为0.50,5.0,10.0,50.0,100.0 mg·L-1的标准溶液系列。
1,2-丁二醇、1,3-丁二醇、1,4-丁二醇和2,3-丁二醇等4种丁二醇标准品;其他试剂均为色谱纯。
1.2 仪器工作条件
1) 气相色谱条件 DB-23毛细管柱(60 m×250 μm,0.25 μm);进样口温度250 ℃;载气为高纯氦气,流量为1.0 mL·min-1;不分流进样;进样量1 μL。升温程序:初始温度80 ℃,保持2 min;以10 ℃·min-1速率升温至240 ℃,保持3 min。
2) 质谱条件 电子轰击(EI)离子源,电离能量70 eV,离子源温度230 ℃;四极杆温度150 ℃,传输线温度250 ℃;扫描模式为全扫描(扫描范围m/z31~250)。4种待测物的保留时间、定量离子和定性离子见表1。

表1 丁二醇的保留时间、定量离子和定性离子Tab. 1 Retention time, quantitative ions and qualitative ions of butanediols
1.3 试验方法
称取护手霜试样1.000 0 g于40 mL安瓿瓶中,加入甲醇10 mL,在适当温度下超声萃取,待样品完全分散后,冷却至室温。取提取液约5 mL于过滤注射器中,过0.45 μm有机滤膜,取中间滤液于进样小瓶,按仪器工作条件进行测定。
2 结果与讨论
2.1 色谱柱的选择
由于待测物及样品的特殊性质,不同的色谱柱可能对丁二醇的定性和定量产生影响。试验考察了DB-5MS、DB-624、DB-innowax和DB-23等4种不同极性的色谱柱对丁二醇的分析性能。结果表明:选用DB-5MS、DB-624、DB-innowax色谱柱测定时,丁二醇在低质量浓度下响应很低;当质量浓度达到10.0 mg·L-1时,4种丁二醇的峰形很差,而且拖尾严重;而选用DB-23色谱柱时,不仅可以在低质量浓度下测定4种待测物,而且可以获得很好的分离度和峰形。因此,试验选用DB-23色谱柱作为分析柱。5.0 mg·L-1混合标准溶液的总离子流图见图1。

图1 4种丁二醇混合标准溶液在DB-23色谱柱上的总离子流图Fig. 1 TIC chromatogram of the mixed standard solution of four butanediols on DB-23 column
2.2 萃取条件的选择
2.2.1 萃取时间
由于不同样品的理化性质的差异,试验以10.0 mg·L-1的1,2-丁二醇为分析对象,分别萃取5,10,20,30,40 min,考察萃取时间对丁二醇萃取效果的影响,结果见图2。

图2 萃取时间对峰面积的影响Fig. 2 Effect of extraction time on the peak area
由图2可知:黏度相对较低的样品(样品5)萃取时间上的变化不是很明显,但对于黏度较高尤其呈膏状的样品(样品6),随着超声萃取时间的增加,丁二醇的响应也逐渐增大。综合考虑萃取效率,试验选择超声萃取时间为30 min。
2.2.2 萃取温度
适当提高萃取温度可以缩短样品前处理的时间,提高萃取效率。分别进行温度为40,50,60,70,80 ℃的萃取试验,考察温度对10.0 mg·L-1的1,2-丁二醇的萃取效果的影响,结果见图3。

图3 萃取温度对峰面积的影响Fig. 3 Effect of extraction temperature on the peak area
由图3可知:随着温度的提高,多数样品中待测物的提取量明显增大;当萃取温度达到70 ℃时,待测物的提取量基本达到平衡。因此,试验选择70 ℃作为丁二醇的萃取温度。
2.3 标准曲线与检出限
用标准储备溶液配制成质量浓度为0.50,5.0,10.0,50.0,100.0 mg·L-1的混合标准溶液系列,在选定的色谱和质谱条件下进行测定,以待测物的峰面积(A)对其质量浓度(ρ)作图,4种丁二醇的质量浓度均在0.50~100.0 mg·L-1内呈线性,2,3-丁二醇的线性回归方程为A=1.20×104ρ+2.95×103,相关系数为0.999 4;1,2-丁二醇的线性回归方程为A=1.27×104ρ+7.29×102,相关系数为0.999 6;1,3-丁二醇的线性回归方程为A=8.99×103ρ-3.05×102,相关系数为0.999 5;1,4-丁二醇的线性回归方程为A=1.33×104ρ+4.91×103,相关系数为0.999 9。
采用空白基质加目标物组分的方法,以3倍信噪比计算得4种丁二醇的检出限均为0.10 mg·L-1。说明建立的方法具有较高的灵敏度,能够满足分析的要求。
2.4 精密度和回收试验
取空白护手霜样品进行10.0,100.0,500.0 mg·kg-1等3个水平加标回收试验,每个水平重复测定6次,考察其加标回收率和精密度,结果见表2。
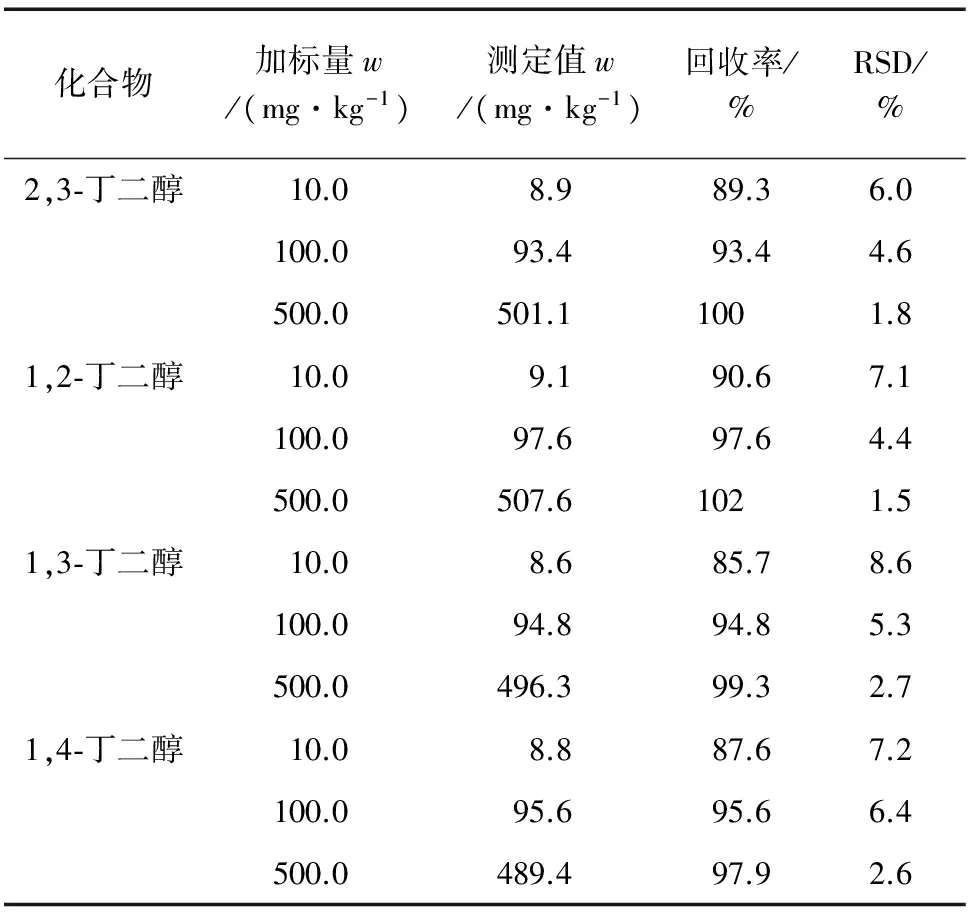
表2 精密度与回收试验结果(n=6)Tab. 2 Results of tests for precision and recovery(n=6)
由表2可知:4种丁二醇的回收率为85.7%~102%,测定值的相对标准偏差(RSD)均小于9.0%。表明该方法具有较高的准确度和精密度。空白护手霜样品在10.0 mg·kg-1加标水平下的色谱图见图4。

图4 加标护手霜样品的总离子流图Fig. 4 TIC chromatogram of spiked hand-cream sample
2.5 样品分析
在优化的试验条件下,对购自超市的6种品牌护手霜进行丁二醇的测定,结果见表3。
由表3可知:除样品2以外,其他5种不同品牌的护手霜中,2,3-丁二醇、1,3-丁二醇和1,4-丁二醇均有不同程度的检出,含量的差异可能和产品配方有关。但6种品牌的样品中1,2-丁二醇均未检出。

表3 6个护手霜样品中丁二醇的测定结果Tab. 3 Determination results of butanediols in six hand-cream samples mg·kg-1
本工作采用气相色谱-质谱法结合超声萃取技术建立了同时测定护手霜中4种丁二醇含量的方法。该方法操作简单、灵敏度高、准确度高、精密度高,可同时实现定性和定量分析,能够为我国化妆品及相关行业提供技术支持。
[1] BARTOWSKY E J, HENSCHKE P A. The 'buttery' attribute of wine-diacetyl-desirability, spoilage and beyond[J]. Int J Food Microbiol, 2004,96(3):235-252.
[3] 练敏,纪晓俊,胡南,等.气相色谱法快速测定产酸克雷伯氏杆菌发酵液中的代谢产物[J].分析实验室, 2008,27(5):19-21.
[4] PALMER P B.γ-Butyrolactone and 1,4-butanediol[J]. Toxicol Rev, 2004,23(1):21-31.
[5] JOHAN D, THYRSA V. Simultaneous analysis ofγ-hydroxybutyric acid,γ-butyrolactone, and 1,4-butanediol by micellar electrokinetic chromatography[J]. Forensic Science International, 2002,125(2/3):113-119.
[6] ANDRESEN H, AYDIN B E, MUELLER A, et al. Disaccharides in urine samples as markers of intravenous abuse of methadone and buprenorphine[J]. Drug Test Analysis, 2011,3(9):560-568.
[7] CARAI M A, QUANG L S, ATZERI S, et al. Withdrawal syndrome fromγ-hydroxybutyric acid (GHB) and 1,4-butanediol (1,4-BD) in Sardinian alcohol-preferring rats[J]. Brain Res Brain Res Protoc, 2005,15(2):75-78.
[8] 张浩杰,王蔚昕,夏学明,等.超高效液相色谱-质谱联用法测定饮料中γ-羟基丁酸及其前体物质γ-丁内酯和1,4-丁二醇[J].分析实验室, 2015,34(1):72-76.
[10] ANNIKA L, ANN-CHRISTINE A, MINNA H. Development of a solid-phase extraction method for simultaneous extraction of adipic acid, succinic acid and 1,4-butanediol formed during hydrolysis of poly(butylene adipate) and poly(butylene succinate)[J]. J Chromatogr A, 2004,1022(1):171-177.
[11] 离子排斥色谱法同时测定2,3-丁二醇发酵液中的葡萄糖和木糖及各种代谢产物[J].分析化学, 2009,37(5):681-684.
[12] MICHELLE W, MARLEEN L, NELE S, et al. Simultaneous analysis of gamma-hydroxybutyric acid and its precursors in urine using liquid chromatography-tandem mass spectrometry[J]. J Chromatogr A, 2004,1056(1/2):83-90.
[13] 徐爱列,吴艳阳,李琰君,等.气相色谱内标法测定发酵产物中2,3-丁二醇的含量[J].分析仪器, 2010,4:22-25.
[14] 殷志敏,贾志奇,赵永祥,等.气相色谱法测定1,4-丁二醇及其酯化产物含量[J].化学与生物工程, 2014,31(7):70-72.
[15] 李美华,罗勇,朱志亮.气相色谱法测定乙二醇精馏液中1,2-丁二醇和一缩二乙二醇含量[J].分析科学学报, 2011,27(4):533-535.
[16] 余书奇,奚星林,陈文锐,等.手性柱分离气相色谱法测定辐照酒中2,3-丁二醇异构体[J].分析测试学报, 2012,31(7):877-880.

