人参皂苷RH2对MCAO大鼠血管新生的调节
谢 靖, 梁华峰, 祁 鸣, 高惠春, 郑 玺
(1石河子大学医学院第一附属医院神经科, 新疆 石河子 832008; 2新疆阜康市人民医院神经科, 新疆 阜康 831500; 3解放军第四七四医院神经科, 新疆 乌鲁木齐 830000)
在人口老龄化趋势愈加明显的今天,脑血管疾病的患病率也呈现上升趋势,其中, 脑卒中致死已成为我国居民第一死因,且其致残率和复发率一直高居不下[1]。脑组织缺血损伤后机体自身可代偿性启动血管生成反应,建立侧支循环以改善缺血区周围的血流供应,为修复神经损伤提供良好的微环境[2-4],故如何促进缺血后脑组织的血管新生已成为脑卒中后期康复治疗的新靶点。随着中医药科学的发展,近年来关于中药和针灸等干预手段治疗缺血后血管新生的研究已得到广泛的关注,应用前景十分广阔。
人参皂苷RH2(ginsenoside RH2,GS-RH2)是由红参中提取出的稀有单体皂苷,归属于达玛烷(dammarane)原人参二醇型皂苷(protopanaxadiol saponins, PDS),是人参中主要的活性成分之一[5],其药理活性范围非常广泛。研究显示, 人参皂苷RH2不仅可通过多种机制抑制肿瘤的发生发展[6-8],单独使用时还可有效增强人体的免疫功能。此外,有实验证明PDS可通过降低大鼠血清总胆固醇并提高血清一氧化氮(nitric oxide, NO)水平来发挥保护血管内皮和抗动脉粥样硬化的作用[9]。但是, 人参皂苷RH2在缺血性脑损伤中的作用并不明确,本研究拟通过构建大鼠大脑中动脉闭塞(middle cerebral artery occlusion, MCAO)模型,研究人参皂苷RH2对缺血性脑损伤后血管新生的作用及相关作用机制。
材 料 和 方 法
1 实验动物、材料与试剂
健康雄性SD大鼠58只,体质量260~280 g,购自石河子大学医学院实验动物中心。实验动物使用许可证号为SYXK(新)2015-0002。饲养、手术、给药及取材等环节均严格遵守实验动物科学与管理的有关规定。
人参皂苷RH2粉末购自上海顺勃生物工程技术有限公司;抗Kelch样环氧氯丙烷相关蛋白1(Kelch-like ECH-associated protein 1, Keap1)、核因子E2相关因子2(nuclear factor E2-related factor 2, Nrf2) 和 血红素加氧酶1(heme oxygenase-1,HO-1)抗体购于Santa Cruz;丙二醛(malondialdehyde, MDA)、超氧化物歧化酶(superoxide dismutase,SOD)及谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)检测试剂盒购于南京建成生物工程研究所。脑立体定向仪购自广东省深圳瑞沃德生命科技有限公司;激光多普勒血流仪购自Perimed。
2 实验方法
2.1MCAO模型的制备和分组 先将实验动物随机分为2组:假手术(sham)组18只和手术组40只。MCAO模型的制备采用改良Longa法[9]:术前12 h开始禁食,麻醉后将大鼠以仰卧位固定,备皮并沿颈部正中线切开皮肤,钝性分离相关肌群后暴露右侧颈总、颈内及颈外动脉,结扎颈外动脉及颈总动脉近心端,后将线拴沿颈内动脉插入大脑中动脉,推进约18 mm后固定,缝合皮肤即可。假手术组仅在颈部正中纵行剖开后缝合。麻醉清醒后以大鼠前爪不能充分伸展或不能正常行走或行走时出现追尾症则视为造模成功。最终手术组造模成功38只,依据Longa 5级评分标准和体重标准纳入36只,并随机分为模型(MCAO)组和实验(GS-RH2)组,每组18只。术后GS-RH2组灌服人参皂苷RH2(20 mg·kg-1·d-1),MCAO组和sham组灌服等量的生理盐水,连续用药7 d。
2.2神经功能评分 3组动物分别于干预第1、3和7天时进行神经功能评分。评分标准如下[10]:无神经功能损伤症状记为0分;垂直提起时损伤对侧前爪不能伸直记为1分;行走时出现追尾症记为2分;行走时身体向左侧跌倒记为3分;不能自发行走或出现意识障碍记为4分。同时观察并记录大鼠的一般生存状态。
2.3脑梗死体积的测量 采用TTC法测定脑梗死体积。干预结束时,将各组大鼠麻醉后,断头取脑组织,速冻后以前囟为基点做连续冠状面切片,切片厚度为2 mm。然后将脑组织切片置于1% TTC溶液中, 37 ℃避光染色30 min。随后置于4%多聚甲醛溶液中固定17 h。显微镜下观察并计算脑梗死体积。
2.4微血管密度(microvessel density, MVD)的测定 采用免疫组化染色法测定微血管密度。具体操作方法参照SP试剂盒(购自北京中杉金桥生物有限公司)说明书进行。CD34多克隆抗体购自北京中杉金桥生物有限公司,PBS替代 I 抗作为阴性对照(negative control,Neg)。
CD34蛋白表达于微血管内皮细胞或内皮细胞簇中,MVD计数参考Weidner等[11]报道的方法,经CD34阳性染色定位后,由2名经验丰富的病理医师随机双盲于低倍镜下观察切片,确定血管最多的区域,然后用高倍镜计数每个区域的微血管数目。每个切片计数5个高倍视野的微血管数,取平均值作为该样本的MVD值。
2.5MDA含量及SOD和GSH-Px活性的检测 各组大鼠脑组织样本经相应处理后,依据南京建成生物工程研究所提供的试剂盒检测说明书检测MDA含量及SOD和GSH-Px的活性。
2.6Western blot检测蛋白表达水平 取各组大鼠脑组织加适量裂解液后用匀浆器匀浆, 离心取上清即可得到各组蛋白样品, 采用BCA试剂盒进行定量分析,调整各组蛋白上样量至60 μg,并加入4倍体积的上样缓冲液,98 ℃水浴变性5 min。而后上样并进行8% SDS-PAGE,将蛋白电转至PVDF膜(约90 min),加5%脱脂牛奶室温封闭120 min。加入相应的 I 抗,4 ℃孵育过夜,复温后加TBST洗涤3次,每次5 min;再加入相应的HRP标记的 II 抗,室温孵育90 min,加TBST洗涤3次,每次10 min。于暗室中将HRP-ECL发光液洒在PVDF膜的蛋白面上激发荧光,经压片、显影及定影后对所得的蛋白条带行灰度分析。以GAPDH为内参照。
3 统计学处理
所有实验数据均录入SPSS 13.0统计学分析软件中进行统计学分析。实验结果以均数±标准差(mean±SD)表示,计量资料行t检验,计数资料行卡方检验或校正卡方检验,多组数据间比较采用单因素方差分析(one-way ANOVA),并用Bonferroni法进行均数组间的两两比较,以P<0.05表示差异有统计学显著性。
结 果
1 一般状态分析
术后第1天,各手术组大鼠精神明显萎靡,反应迟钝,皮毛发暗,饮食饮水减少。术后第3~4天,各手术组大鼠活动度依然较差,饮食饮水量少;但与模型组相比, GS-RH2组大鼠精神状态有所好转。至第7天,GS-RH2实验组大鼠精神状态明显好转,活动自如,但仍比假手术组差。假手术组大鼠实验过程中整体状态良好。
神经功能评分结果显示:模型组各时间点测得神经功能评分均高于假手术组(P<0.05),说明模型组大鼠已出现明显的神经功能缺损;相较于模型组,给予GS-RH2干预3 d及7 d则可显著降低神经功能评分(P<0.05),见表1。
表1GS-RH2对MCAO大鼠神经功能及脑梗死体积的影响
Table 1. The effect of GS-RH2 on the neurological function and infarction volume of MCAO rats(Mean±SD.n=6)
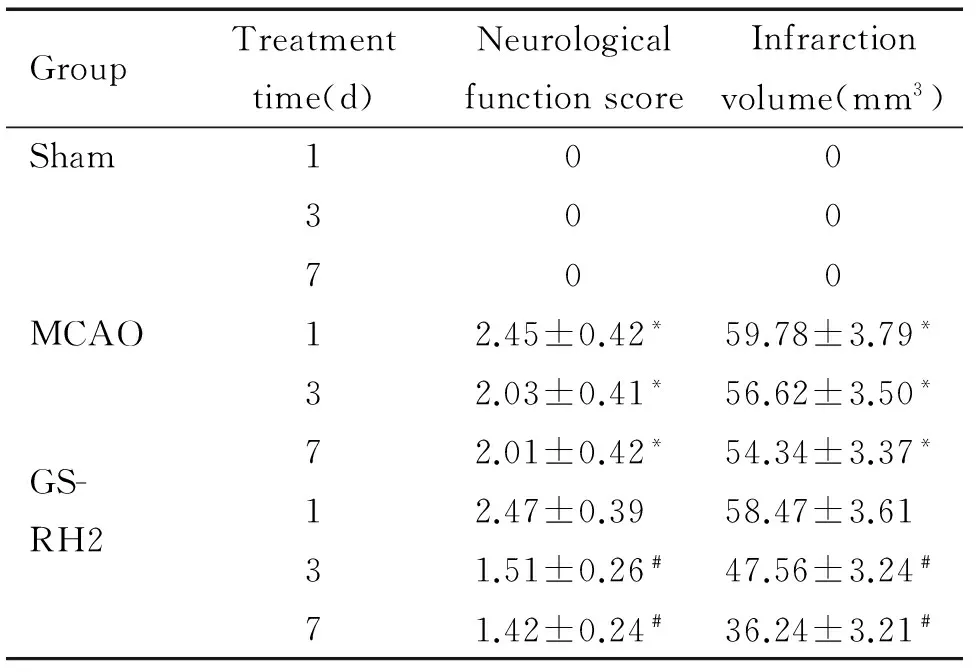
GroupTreatmenttime(d)NeurologicalfunctionscoreInfrarctionvolume(mm3)Sham100300700MCAO12.45±0.42*59.78±3.79*32.03±0.41*56.62±3.50*72.01±0.42*54.34±3.37*GS-RH212.47±0.3958.47±3.6131.51±0.26﹟47.56±3.24﹟71.42±0.24﹟36.24±3.21﹟
*P<0.05vssham group;#P<0.05vsMCAO group.
TTC法脑梗死体积测定结果显示:假手术组并未出现梗死灶;而术后模型组及实验组均出现不同程度的脑梗死;给予GS-RH2干预3 d及7 d所测得脑梗死体积显著小于模型组,差异具有统计学意义(P<0.05),见图1、表1。

Figure 1. The effect of GS-RH2 on the infarction volume of MCAO rats detected by TTC assay.
图1GS-RH2对MCAO大鼠脑梗死体积的影响
2 微血管密度分析
免疫组化结果显示,随生存时间的延长,假手术组MVD值基本无变化。手术后第1天模型组MVD值与假手术组无显著差异,第3天时显著上升,但随生存时间的延长,MVD值呈现下降的趋势。GS-RH2组MVD值随生存时间的延长呈上升趋势,且干预7 d时所测得MVD值显著高于模型组(P<0.05)。结果提示GS-RH2可促进MCAO大鼠血管新生,见图2、表2。

Figure 2. The effect of GS-RH2 on the microvessel density of MCAO rats detected by immunohistochemical staining (×400).
图2免疫组化法测定GS-RH2对MCAO大鼠微血管密度的影响
表2GS-RH2对MCAO大鼠微血管密度的影响
Table 2. The effect of GS-RH2 on the microvessel density of MCAO rats (Mean±SD.n=6)

GroupTimeafterGS-RH2treatment1d3d7dSham14.52±2.0713.42±1.9813.58±2.01MCAO14.75±2.1420.51±2.34*16.33±2.72GS-RH214.69±2.1123.26±2.6424.73±2.67﹟
*P<0.05vssham group;#P<0.05vsMCAO group.
3 脑组织氧化应激状态分析
MDA含量分析结果显示,各时间点模型组的MDA含量均显著高于假手术组,且随生存时间的延长,模型组MDA含量呈轻度下降的趋势;给予GS-RH2干预7 d可显著降低脑组织中MDA的含量(P<0.05)。SOD及GSH-Px的活性分析结果显示,各时间点模型组的SOD及GSH-Px的活性均显著低于假手术组,且随生存时间的延长,模型组SOD及GSH-Px的活性呈轻度上升的趋势;给予GS-RH2干预7 d可显著增加脑组织中SOD及GSH-Px的活性。结果提示GS-RH2可改善MCAO大鼠脑组织的氧化应激状态,见图3。

Figure 3. The effect of GS-RH2 on oxidative stress of MCAO rats. Mean±SD.n=6.*P<0.05vssham group;#P<0.05vsMCAO group.
图3GS-RH2对MCAO大鼠氧化应激水平的影响
4 脑组织Keap1/Nrf2信号通路的活性分析
为进一步探讨GS-RH2调节MCAO大鼠脑组织氧化应激水平的作用机制,我们于实验结束即干预7 d时,取部分脑组织分析了Keap1/Nrf2信号通路的活性。Western blot 的结果显示,假手术组大鼠脑组织中有Keap1、Nrf2及HO-1的基础表达;损伤7 d时,模型组大鼠脑组织中Keap1蛋白表达减少,Nrf2及HO-1的蛋白表达水平升高(P<0.05);相较于模型组,GS-RH2干预可使各蛋白表达的变化趋势更显著(P<0.05)。结果提示GS-RH2可激活Keap1/Nrf2信号通路,见图4。
讨 论
线栓法构建的局灶性脑缺血模型是目前研究脑缺血性疾病的公认理想模型,本实验中我们采用SD大鼠建立线栓法MCAO模型,经神经功能评分及脑梗死体积评定确认模型构建成功,并用于后续实验。脑缺血性损伤后,血管新生是改善局部血流供应及损伤修复的关键环节。基于传统中医药的发展及其在复杂疾病诊疗上的优势,本研究选取人参皂苷RH2这一活性成分,分析了其在MCAO大鼠血管新生中的作用。
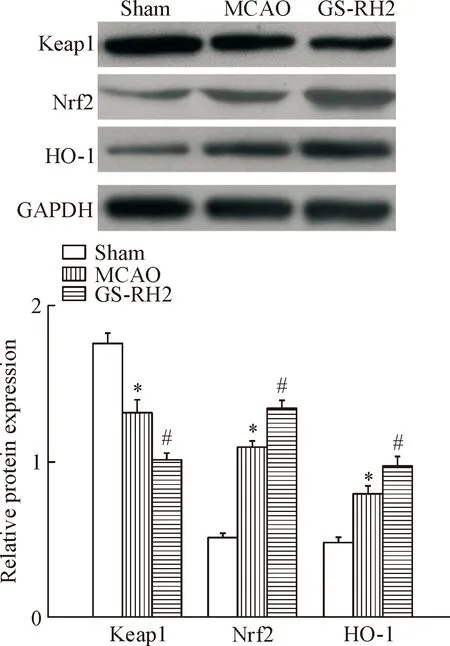
Figure 4. The effect of GS-RH2 on Keap1/Nrf2 signaling pathway of MCAO rats. Mean±SD.n=6.*P<0.05vssham group;#P<0.05vsMCAO group.
图4GS-RH2对MCAO大鼠Keap1/Nrf2信号通路的影响
实验结果显示,与模型组相比,给予人参皂苷RH2干预7 d之后,实验组动物神经行为症状得到明显改善,脑梗死体积显著减小,神经功能评分显著降低。结果表明人参皂苷RH2可显著改善MCAO大鼠脑缺血所致神经损伤。接着我们通过测定微血管密度来评价人参皂苷RH2对MCAO大鼠血管新生的影响,结果显示, 与模型组相比,给予人参皂苷RH2干预可显著升高MVD值,表明人生皂苷RH2可促进MCAO大鼠血管新生。
脑组织代谢旺盛,耗氧量极高,局部缺血易致脂质过氧化的发生,这也是缺血后脑损伤一个重要原因。早期在研究人参皂苷RH2对血管内皮的保护作用时发现,应用人参皂苷RH2可降低血清中MDA的含量,同时提高SOD的活性,具有抗脂质过氧化的作用[9]。故而我们进一步检测了该过程中MDA的含量及SOD和GSH-Px的活性,以评价人参皂苷RH2在调控MCAO大鼠血管新生的过程中是否涉及到氧化应激状态的改变。结果显示, 相较于模型组,给予人参皂苷RH2干预7 d可显著增加脑组织中SOD及GSH-Px的活性,并降低MDA的含量。这一结果表明人生皂苷RH2可改善MCAO大鼠脑组织的氧化应激状态。机体中Nrf2是抗氧化应激反应的重要转录因子[12-13]。研究表明,静息态下,Nrf2与Keap1结合而处于失活态,并可通过泛素-蛋白酶体途径迅速降解;在接受相关信号刺激后,Nrf2则从Keap1上解离、转位后进入细胞核,调控一系列抗氧化酶的表达[12, 14-15];其中血红素加氧酶则是与神经细胞保护作用关系密切的酶系[16-18]。故而我们进一步分析了人参皂苷RH2对Keap1、 Nrf2和HO-1表达的影响,结果显示,相较于模型组,给予人参皂苷RH2可显著减少大鼠脑组织中Keap1蛋白的表达,而促进Nrf2及HO-1的蛋白表达, 提示Keap1/Nrf2抗氧化信号通路可能参与了人生皂苷RH2调控MCAO大鼠血管新生的过程,至于其上下游涉及的其它信号分子及通路还需进一步的实验验证。
综上所述,人参皂苷RH2可促进MCAO大鼠血管新生,其作用机制可能与激活Keap1/Nrf2信号通路,提高抗氧化酶的活性从而抑制氧化应激反应有关。
[1] Zhu L, He D, Han L, et al. Stroke research in China over the past decade: analysis of NSFC funding[J]. Transl Stroke Res, 2015, 6(4):253-256.
[2] Makin SD, Doubal FN, Dennis MS, et al. Clinically confirmed stroke with negative diffusion-weighted imaging magnetic resonance imaging: longitudinal study of clinical outcomes, stroke recurrence, and systematic review[J]. Stroke, 2015, 46(11):3142-3148.
[3] Rostamian S, Mahinrad S, Stijnen T, et al. Cognitive impairment and risk of stroke: a systematic review and meta-analysis of prospective cohort studies[J]. Stroke, 2014, 45(5):1342-1348.
[4] Hui Z, Sha DJ, Wang SL, et al. Panaxatriol saponins promotes angiogenesis and enhances cerebral perfusion after ischemic stroke in rats[J]. BMC Complement Altern Med, 2017, 17(1):70.
[5] Yang J, Li X, Sun T, et al. Semisynthesis and bioactive evaluation of oxidized products from 20(S)-ginsenoside Rg3, Rh2, protopanaxadiol (PPD) and their 20(R)-epimers as cytotoxic agents[J]. Steroids, 2016, 106:26-34.
[6] Shi Q, Shi X, Zuo G, et al. Anticancer effect of 20(S)-ginsenoside Rh2 on HepG2 liver carcinoma cells: activating GSK-3β and degrading β-catenin[J]. Oncol Rep, 2016, 36(4):2059-2070.
[7] Huang J, Peng K, Wang L, et al. Ginsenoside Rh2 inhibits proliferation and induces apoptosis in human leukemia cells via TNF-α signaling pathway[J]. Acta Biochim Biophys Sin (Shanghai), 2016, 48(8):750-755.
[8] Xia T, Wang J, Wang Y, et al. Inhibition of autophagy potentiates anticancer property of 20(S)-ginsenoside Rh2 by promoting mitochondria-dependent apoptosis in human acute lymphoblastic leukaemia cells[J]. Oncotarget, 2016, 7(19):27336-27349.
[9] 李凤娥, 孔繁利, 孙 新, 等. 人参二醇组皂苷(PDS)对血脂、血清NO、MDA含量、SOD活力的影响[J]. 中国民康医学, 2009, (21):2653-2655, 2657.
[10] Longa EZ, Weinstein PR, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1):84-91.
[11] Weidner N. Chapter 14. Measuring intratumoral microvessel density[J]. Methods Enzymol, 2008, 444:305-323.
[12] Lu MC, Ji JA, Jiang ZY, et al. The Keap1-Nrf2-ARE pathway as a potential preventive and therapeutic target: an update[J]. Med Res Rev, 2016, 36(5):924-963.
[13] Chen B, Lu Y, Chen Y, et al. The role of Nrf2 in oxidative stress-induced endothelial injuries[J]. J Endocrinol, 2015, 225(3):R83-R99.
[14] Sandberg M, Patil J, D’Angelo B, et al. NRF2-regulation in brain health and disease: implication of cerebral inflammation[J]. Neuropharmacology, 2014, 79:298-306.
[15] Zhai X, Lin H, Chen Y, et al. Hyperbaric oxygen preconditioning ameliorates hypoxia-ischemia brain damage by activating Nrf2 expressioninvivoandinvitro[J]. Free Radic Res, 2016, 50(4):454-466.
[16] Shu L, Wang C, Wang J, et al. The neuroprotection of hypoxic preconditioning on rat brain against traumatic brain injury by up-regulated transcription factor Nrf2 and HO-1 expression[J]. Neurosci Lett, 2016, 611:74-80.
[17] Gao Y, Xu X, Chang S, et al. Totarol prevents neuronal injuryinvitroand ameliorates brain ischemic stroke: potential roles of Akt activation and HO-1 induction[J]. Toxicol Appl Pharmacol, 2015, 289(2):142-154.
[18] Yoo SJ, Nakra NK, Ronnett GV, et al. Protective effects of inducible HO-1 on oxygen toxicity in rat brain endothe-lial microvessel cells[J]. Endocrinol Metab (Seoul), 2014, 29(3):356-362.

