川楝素对人卵巢癌细胞侵袭和迁移的影响*
李雨颖, 章科娜, 蔡锦威, 林江涛, 邵喜英
(1衢州职业技术学院医学院, 浙江 衢州 324000; 2浙江省肿瘤医院, 浙江 杭州 310022; 3浙江中医药大学,浙江 杭州 310053; 4衢州市柯城区人民医院, 浙江 衢州 324000; 5浙江大学医学院, 浙江 杭州 310058)
卵巢癌是目前致死率最高的恶性妇科肿瘤。我国卵巢癌的新发病例每年约13.15万,是发达国家的6倍。由于卵巢的特殊解剖结构与生理功能,有70%的患者就诊时已属晚期[1],并且,就诊患者中至少有75%已出现淋巴结转移或盆腔外转移[2]。所以阐明卵巢癌细胞的迁移和侵袭机制无疑能提高卵巢癌患者的生存期。目前对卵巢癌的治疗方式以手术为主,药物化疗为辅。但是化疗药具有明显的毒副作用,这就限制了用药时长和剂量,使体内肿瘤细胞无法清除干净,从而引起临床上治疗失败和预后不良。中药抗肿瘤具有高效、低毒和不易耐药等特点,已成为当今研究的热点。
川楝素(toosendanin,TSN)是从传统中药楝属植物川楝子和苦楝皮中提取出的一种四环三萜类化合物[3],具有良好的抑制肿瘤细胞增殖及促进细胞凋亡的作用,是一种极具潜力的抗癌药物[4]。川楝素能抑制肝癌细胞系Hep3B和SMMC-7721的增殖并诱导其凋亡,并伴随Bax和Fas蛋白表达增加,Bcl-2表达下降,该作用涉及死亡受体途径和线粒体途径的参与[5-6]。Wang等[7]认为川楝素能诱导结直肠癌细胞系SW480凋亡,这与抑制AKT/GSK-3β/β-catenin信号通路有关。我们前期研究已证实,川楝素对人卵巢癌细胞具有抑制效应,但其对卵巢癌细胞的迁移和侵袭作用尚未报道。因此,本研究旨在明确川楝素对人卵巢癌细胞迁移和侵袭的影响及相关机制。
材 料 和 方 法
1 细胞株
人卵巢癌细胞系CAVO-3和SKVO-3购于中国科学院上海生命科学研究所。
2 主要试剂
川楝素(分子式为 C30H38O11,分子量 574.60,纯度≥99%) 购自成都曼思特生物科技有限公司;紫杉醇(taxinol,TAX)购自Sigma;RIPA裂解液、抗GAPDH单克隆抗体、BCA蛋白浓度测定试剂盒和CCK-8试剂盒购自江苏碧云天生物技术有限公司;DMEM和RPMI-1640细胞培养液、胰蛋白酶及胎牛血清购自Gibco;荧光标记的山羊抗鼠、山羊抗兔Ⅱ抗、抗核因子κB(nuclear factor-κB,NF-κB) p65、上皮型钙黏蛋白(E-cadherin)、神经型钙黏蛋白(N-cadherin)、波形蛋白(vimentin)和Snail单克隆抗体购自Abcam;NF-κB抑制剂BAY11-7082购自BioVision。
3 主要方法
3.1细胞培养 取对数生长期的CAVO-3和SKVO-3细胞接种至培养皿中,培养液为90% DMEM(RPMI-1640)+ 10% 胎牛血清,加入1×104U/L青、链霉素,在5% CO2、37 ℃密闭条件下培养。一般2 d换液,4 d进行传代。
3.2细胞存活率的测定 取对数生长期的CAVO-3和SKVO-3细胞按一定密度接种至96孔培养板中,按分组分别加入不同浓度的TSN和TAX,于5% CO2、37 ℃条件下培养。细胞培养12 h后给药,在加药后的12、24、48、72和96 h后,各孔均加入10 μL CCK-8试剂,混匀后孵育4 h,用酶标仪测定450 nm波长处的吸光度(A)值,以细胞培养12 h时所测得的对照组A值平均值为100%,计算各组的细胞存活率。细胞存活率(%)=A实验组平均值/A对照组(12 h)平均值×100%。
3.3细胞划痕实验 取对数生长期的CAVO-3细胞按一定密度接种到6孔板中,于5% CO2、37 ℃条件下培养24 h。用1 mL枪头在培养皿中沿直径划痕,划成一条直线(划痕时枪头垂直于板孔底部);再划第二条,垂直于第一条划痕,形成十字交叉。然后用PBS清洗板孔2次。换液,分别按分组加入TSN(500 nmol/L)和或BAY11-7082(20 μmol/L),TSN+BAY11-7802组先加入BAY11-7802处理2 h后再加入TSN。继续培养24 h。弃培养液,再用PBS清洗细胞2次。然后用4%多聚甲醛固定30 min。在显微镜下拍照记录。再用ImageJ软件测定划痕距离。
3.4Transwell小室侵袭实验 将实验用CAVO-3细胞预先饥饿24 h。在24孔板中放入Transwell小室。用无血清培养基稀释人工基底膜,在小室中加入100 μL人工基底膜,37 ℃条件下过夜使胶凝固。在下室中加入750 μL含10%胎牛血清的培养基,再把Transwell小室放进24孔板中,在Transwell小室中加入200 μL事先准备的细胞悬液。按分组分别加入TSN(500 nmol/L)和/或BAY11-7082(20 μmol/L),37 ℃培养24 h,弃去培养基,PBS清洗2次。加入4%多聚甲醛固定2 min,PBS清洗2次。再用吉姆萨染色15 min,PBS清洗2次。最后用棉签刮掉上室内的细胞。在高倍镜(×400)下随机选择6个视野,计数,取平均值。以穿过小室的细胞数量作为评价侵袭能力的指标。
3.5Western blot法检测蛋白表达 各组细胞分别加入相应药物进行孵育(TSN浓度为500 nmol/L,BAY11-7082浓度为20 μmol/L)。诱导24 h后,用Western blot法进行蛋白检测。先裂解细胞,4 ℃离心,取上清液,收集待测蛋白样本。用BCA法测定蛋白浓度并进行定量处理,具体操作按说明书进行。制胶(提前24 h准备好),每孔20 μL上样,用70 V、110 V电压进行电泳,80 V恒压转膜2 h,TBST洗膜3次,每次10 min,10%的BSA封闭2 h,洗膜,再用相应 I 抗孵育,4 ℃过夜,TBST洗膜3次,再在避光环境下用相应荧光 II 抗室温下孵育2 h,TBST洗膜3次。Odyssey红外激光双色图像分析系统进行扫膜,ImageJ软件测定条带光密度值。
4 统计学处理
采用SPSS 22.0软件进行统计学处理。数据均采用均数±标准差(mean±SD)表示。多组间比较采用方差齐性检验和单因素方差分析(one-way ANOVA)。以P<0.05为差异有统计学意义。
结 果
1 川楝素对细胞存活率的影响
TSN对CAVO-3和SKVO-3细胞的增殖均具有明显的抑制效应。在各时点,与阴性对照组相比,TSN浓度越大,其抑制作用越明显。不同浓度TSN处理后,细胞存活率在12、24、48、72和96 h逐渐下降(P<0.05)。阴性对照TAX组细胞活力于48 h后才开始下降,用500 nmol/L TSN处理24 h时,细胞的存活率即开始下降,因此取该点进行后续实验,见表1、2。
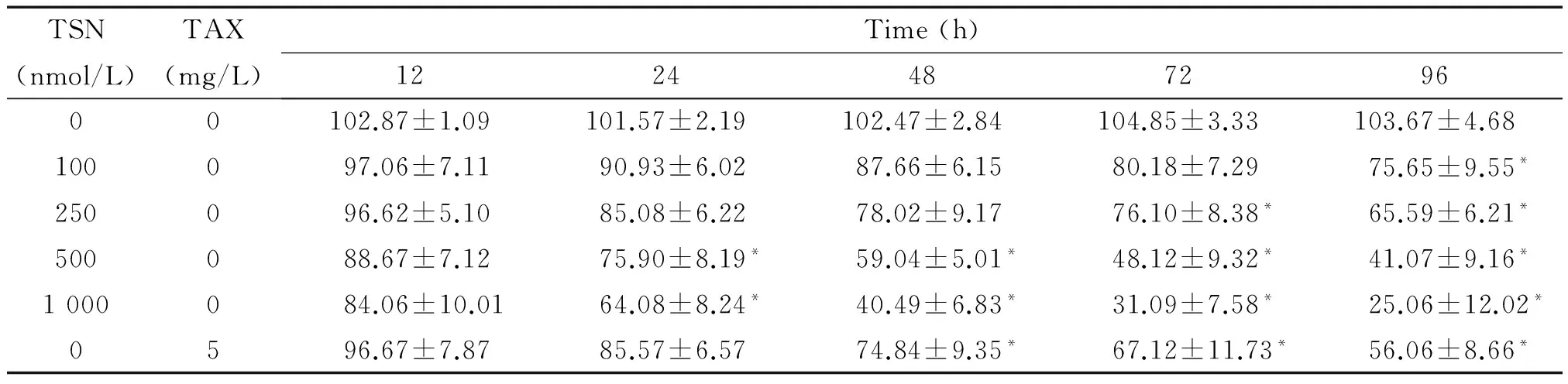
表1 CAVO-3细胞存活率
*P<0.05vscontrol group.
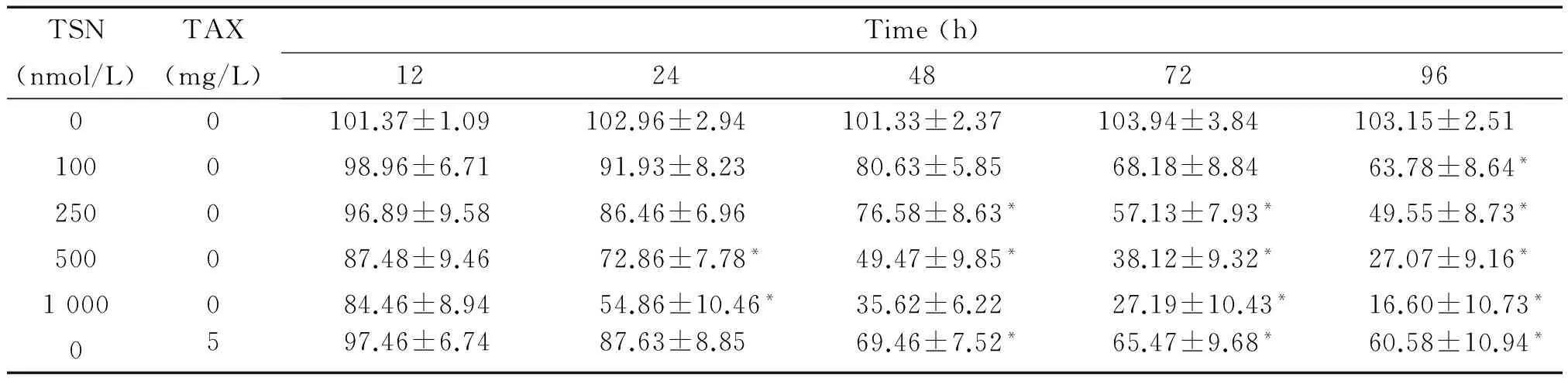
表2 SKVO-3细胞存活率
*P<0.05vscontrol group.
2 川楝素对卵巢癌细胞迁移和侵袭作用的影响
TSN处理组细胞划痕愈合率较对照组显著降低(P<0.05),加入NF-κB抑制剂BAY11-7082处理则逆转了TSN的效应,TSN+BAY11-7082组细胞划痕愈合率较TSN组显著升高(P<0.05),见图1。
TSN处理组侵袭的CAVO-3细胞从上表面转移到下表面的数量较对照组显著降低(P<0.05),加入NF-κB抑制剂BAY11-7082处理也逆转了TSN的该效应,TSN+BAY11-7082组侵袭细胞的数量较TSN组显著增加(P<0.05),见图2。
3 川楝素抑制卵巢癌细胞迁移侵袭的相关分子机制
TSN处理后,与对照组相比,细胞中NF-κB p65显著升高,上皮标记物E-cadherin表达也显著升高(P<0.05),而间充质标记物N-cadherin和vimentin表达则显著下降,Snail蛋白表达也显著下降(P<0.05),见图3、4。
为明确NF-κB与上皮-间充质转化标志物和转录抑制因子Snail是否有相关性,实验使用了NF-κB抑制剂BAY11-7082处理细胞。结果显示,BAY11-7082逆转了TSN的效应,与TSN组相比,TSN+BAY11-7082组的E-cadherin表达显著下降(P<0.05),而N-cadherin、vimentin和Snail蛋白表达则显著增加(P<0.05),见图3、4。
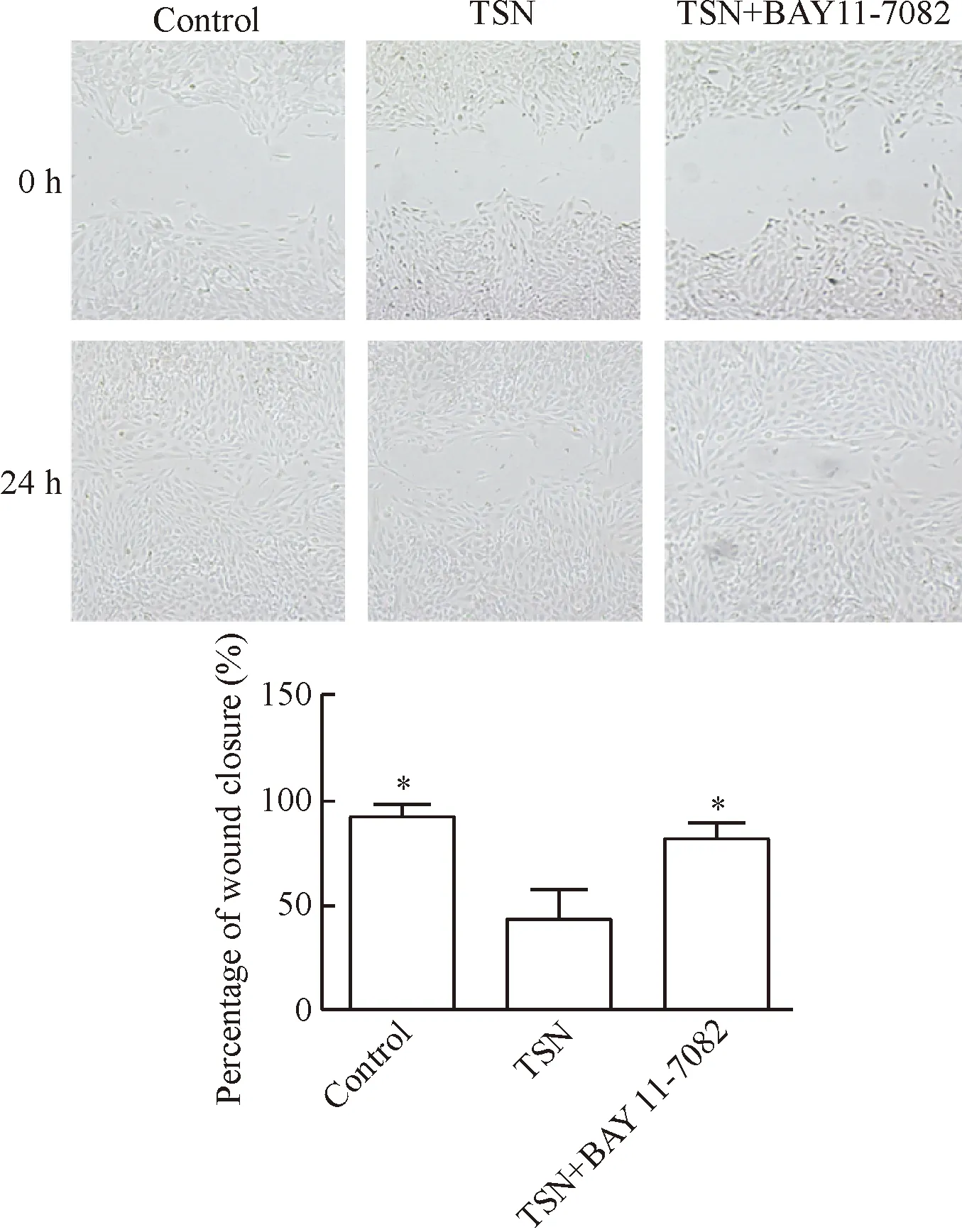
Figure 1. The result of cell scratch wound healing assay. Mean±SD.n=5.*P<0.05vsTSN group.
图1细胞划痕实验结果

Figure 2. The result of Transwell assay (×400). Mean±SD.n=5.*P<0.05vsTSN group.
图2Transwell小室侵袭实验结果
讨 论
迁移和侵袭是恶性肿瘤的生物学特征之一,也是癌症致死的重要原因。肿瘤细胞的迁移侵袭是一个多因素、多阶段和多步骤发生的复杂过程。涉及上皮-间质转化(epithelial-mesenchymal transition,EMT)过程、基底膜和细胞外基质(extracellular matrix,ECM)降解、肿瘤细胞黏附性下降和新生血管生成等因素。其中,EMT发挥了决定性作用。EMT的调控受到多种转录抑制因子和生长因子的影响。E-cadherin是上皮细胞的标志物,通过调节细胞与基质间或细胞与细胞间的黏附反应,来维持组织结构的完整性[8]。研究表明,E-cadherin表达缺失与某些肿瘤的发生相伴行,如乳腺癌、结肠癌及上皮鳞状细胞癌等。并且,减少E-cadherin表达会增大肿瘤细胞迁移侵袭的风险[9]。N-cadherin和vimentin等间充质蛋白会伴随E-cadherin表达的下降而呈现高表达,从而共同诱导EMT过程[10-11]。本研究结果表明TSN组CAVO-3细胞的迁移和侵袭能力明显降低,且E-cadherin表达增加,N-cadherin和vimentin表达下降。说明川楝素逆转了CAVO-3细胞的EMT,从而抑制其迁移侵袭的发生。
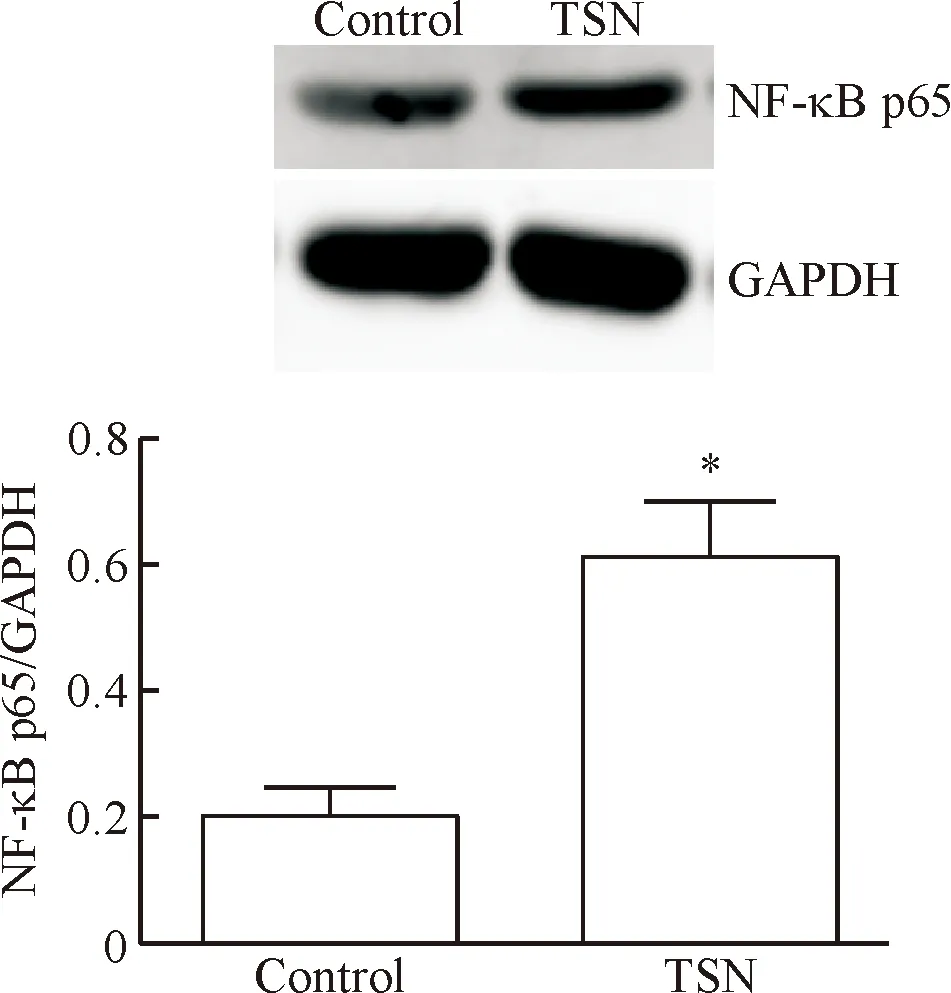
Figure 3. The effect of TSN on the protein expression of NF-κB p65 in CAVO-3 cells. Mean±SD.n=5.*P<0.05vscontrol group.
图3TSN对CAVO-3细胞NF-κBp65蛋白表达的影响
EMT过程的调控也涉及多种转录抑制因子,如Snail、Twist、ZEB1/ZEB2、KLF8和Slug等。它们通过抑制E-cadherin的表达促进EMT,从而提高细胞的迁移侵袭能力[11]。研究认为在各类肿瘤中,Snail可抑制上皮标志物E-cadherin、细胞角蛋白等的表达[12],也可间接上调间充质标志物N-cadherin、vimentin等和基质金属蛋白酶的表达[13]。本研究也表明Snail在川楝素处理后表达明显下调。此外,NF-κB是一类转录因子,其介导的信号通路在血管生成、抑制凋亡和增殖方面都起到关键作用。NF-κB在卵巢癌细胞中的表达明显增加[14]。卵巢癌细胞通过激活NF-κB,来抑制凋亡通路和抵抗外界不利环境[15]。在本研究中,川楝素组细胞内的NF-κB蛋白表达上调。用NF-κB通路抑制剂预处理后,逆转了川楝素的实验效应,其促进了Snail蛋白表达,同时逆转了EMT过程,E-cadherin表达下降,N-cadherin和vimentin表达增加。此外,NF-kB抑制剂处理后也使细胞划痕愈合率增加,细胞侵袭数量增多。

Figure 4. The effect of TSN on the protein expression of E-cadherin, N-cadherin, vimentin and Snail in the CAVO-3 cells. Mean±SD.n=5.*P<0.05vsTSN group.
图4TSN对CAVO-3细胞E-cadherin、N-cadherin、vimentin和Snail蛋白表达的影响
综上所述,川楝素能抑制人卵巢癌细胞的迁移侵袭能力,其机制与抑制EMT过程有关,并由NF-κB/Snail信号通路所介导。
[1] Yun SJ, Kim WJ. Role of the epithelial-mesenchymal transition in bladder cancer: from prognosis to therapeutic target[J]. Korean J Urol, 2013, 54(10):645-650.
[2] Ponnusamy MP, Seshacharyulu P, Lakshmanan I, et al. Emerging role of mucins in epithelial to mesenchymal transition[J]. Curr Cancer Drug Targets, 2013, 13(9):945-956.
[3] Zhong ZC, Xie JX, Chen SF, et al. The chemical structure of toosendanin[J]. J Chem, 1975, 33(1):397-406.
[4] Zhang B, Wang ZF, Tang MZ, et al. Growth inhibition and apoptosis-induced effect on human cancer cells of toosendanin, a triterpenoid derivative from Chinese traditional medicine[J]. Invest New Drugs, 2005, 23(6):547-553.
[5] Liu XL, Wang H, Zhang L, et al. Anticancer effects of crude extract fromMeliatoosendanSieb.et Zucc on hepatocellular carcinomainvitroandinvivo[J]. Chin J Integr Med, 2016, 22(5):362-369.
[6] 王 鹏, 王 进, 姜 慧, 等. 川楝素通过线粒体途径诱导人肝癌细胞凋亡[J]. 中国中西医结合杂志, 2011, 31(2):218-222.
[7] Wang G, Feng CC, Chu SJ, et al. Toosendanin inhibits growth and induces apoptosis in colorectal cancer cells through suppression of AKT/GSK-3β/β-catenin pathway[J]. Int J Oncol, 2015, 47(5):1767-1774.
[8] Sachdeva M, Mo YY. Micro RNA-145 suppresses cell invasion and metastasis by directly targeting mucin 1[J]. Cancer Res, 2010, 70(1):378-387.
[9] Yang E, Hu XF, Xing PX. Advances of MUC1 as a target for breast cancer immunotherapy[J]. Histol Histopathol, 2007, 22(8):905-922.
[10] Ohno T, Aihara R, Kamiyama Y, et al. Prognostic signi-ficance of combined expression of MUC1 and adhesion mo-lecules in advaneed gastric cancer[J]. Eur J Cancer, 2006, 42(2):256-263.
[11] 张灿灿, 尉 蔚, 林雪艳, 等. 上皮性卵巢癌中PARP-1的表达及其与EMT的关系[J]. 中国病理生理杂志, 2016, 32(3):425-431.
[12] Karicheva O, Rodriguez-Vargas JM, Wadier N, et al. PARP3 controls TGFβ and ROS driven epithelial-to-me-senchymal transition and stemness by stimulating a TG2-Snail-E-cadherin axis[J]. Oncotarget, 2016, 7(39):64109-64123.
[13] Cheng JC, Chang HM, Xiong S, et al. Sprouty2 inhibits amphiregulin-induced down-regulation of E-cadherin and cell invasion in human ovarian cancer cells[J]. Oncotarget, 2016, 7(49):81645-81660.
[14] Zhu YW, Yan JK, Li JJ, et al. Knockdown of radixin suppresses gastric cancer metastasisinvitroby up-regulation of E-cadherin via NF-κB/Snail pathway[J]. Cell Physiol Biochem, 2016, 39(6):2509-2521.
[15] Karyampudi L, Lamichhane P, Krempski J, et al. PD-1 blunts the function of ovarian tumor-infiltrating dendritic cells by inactivating NF-κB[J]. Cancer Res, 2016, 76(2):239-250.

