氢分子对高糖状态下肾小球系膜细胞凋亡相关蛋白及Nrf2信号通路的影响*
李银苹, 张学铭, 汪开诚, 应 磊, 汪 洋, 王万铁, 金可可
(温州医科大学病理生理学教研室, 浙江 温州 325035)
糖尿病肾病(diabetic nephropathy,DN)是糖尿病患者常见而严重的慢性并发症,研究表明,高血糖导致的肾脏细胞凋亡参与糖尿病肾病的发生和进展。糖尿病肾病的基本病理改变为细胞外基质增生,基膜增厚,晚期出现弥漫性肾小球硬化,最终导致肾衰竭。肾小球系膜细胞(glomerular mesangial cell)是重要的靶细胞及效应细胞,易发生高血糖诱导的细胞凋亡和损伤,在糖尿病肾病的发展中起重要作用[1-4]。近年的研究表明,氧化应激(oxidative stress)反应是糖尿病肾病的重要发病机制之一[5-6],可引发肾小球系膜细胞凋亡[7],使用抗氧化剂可有效改善糖尿病动物的肾脏损伤,防止肾脏纤维化[8-9]。
自2007年,Ohsawa等[10]在《Nature Medicine》报道氢在机体内具有选择性抗氧化治疗作用以来,国内外研究者已陆续发现氢在缺血-再灌注损伤、动脉粥样硬化和代谢综合征等多种疾病过程中发挥抗氧化作用[11-13],证实氢分子能特异性中和自由基中毒性最强的·OH和ONOO-而产生明显的抗氧化反应,同时氢分子亦可增加超氧化物歧化酶(superoxide dismutase,SOD)和过氧化氢酶(catalase,CAT)等抗氧化酶的活性[14],并抑制氧化应激引起的细胞凋亡[15]。但目前氢分子对糖尿病肾病的干预作用尚未见报道,本研究通过体外细胞培养实验,观察氢分子对高糖状态下肾小球系膜细胞凋亡相关蛋白表达以及核因子E2 相关因子2(nuclear factor E2-related factor 2, Nrf2)信号通路的影响,并探讨可能的机制,以期为糖尿病肾病的防治提供新的思路。
材 料 和 方 法
1 细胞培养
小鼠肾小球系膜细胞SV40-MES13购自中国科学院细胞库。细胞培养用含10% 胎牛血清(fetal bovine serum,FBS)低糖[5.5 mmol/L葡萄糖(glucose)]DMEM培养基,5% CO2条件下培养,实验分为4组:正常对照(normal control,C)组用低糖(5.5 mmol/L葡萄糖)DMEM培养基;甘露醇(mannitol,G)组用低糖加甘露醇(5.5 mmol/L葡萄糖+19.5 mmol/L甘露醇)DMEM培养基;高糖(high glucose,H)组用高糖(25 mmol/L葡萄糖)DMEM培养基;高糖+富氢水(high glucose+hydrogen-rich water,HH)组用富氢水配制高糖干粉DMEM(25 mmol/L葡萄糖干粉DMEM+富氢水)培养基培养,其中,高糖+富氢水组每6 h换液1次且培养基现配现用,其余3组每24 h换液 1 次,8~14代细胞用于本实验。
2 主要试剂
DMEM培养基、FBS和高糖干粉DMEM培养基均购自Gibco;富氢水购自北京活力氢源饮品有限公司(氢气浓度大于0.8 mmol/L,氢气与水稳定结合,开罐4 h氢气浓度仍大于0.4 mmol/L);二氢乙啶(dihydroethidium,DHE)、RIPA裂解液、SOD活性检测试剂盒和BCA蛋白测定试剂盒购自碧云天;兔抗鼠Nrf2、血红素加氧酶1(heme oxygenase 1,HO-1)和NAD(P)H:醌氧化还原酶1[NAD(P)H:quinone oxidoreductase 1,NQO-1]单克隆抗体均购自Abcam;兔抗鼠Bax、Bcl-2和caspase-3单克隆抗体均购自 Cell Signaling Technology;HRP标记山羊抗兔IgG购自杭州联科生物科技有限公司;逆转录试剂盒购自Thermo。所用引物均由上海捷瑞生物工程有限公司设计合成。
3 主要方法
3.1Western blot 法 造模48 h后,各组加入500 μL裂解液(含5 μL PMSF), 冰上裂解细胞20 min,取上清液,BCA法测定蛋白浓度。取蛋白样品,行SDS-PAGE,湿式电转移法转移至PVDF膜,用5%脱脂奶粉室温下封闭90 min,TBST漂洗3次后,分别加 I 抗[Nrf2(1∶1 000)、caspase-3(1∶1 000)、Bax(1∶1 000)、Bcl-2(1∶1 000)、β-actin(1∶1 000)、HO-1(1∶1 000)和NQO-1(1∶10 000)],4 ℃孵育过夜,TBST洗涤3次后加 II 抗室温孵育 1 h,再次 TBST 洗涤,滴加ECL发光液暗室曝光后,采用Quantity One图像分析系统对各条带灰度值进行分析,以目的蛋白条带吸光度与内参照β-actin条带吸光度的比值反映目的蛋白的表达水平。
3.2RT-PCR法测定mRNA的表达 采用RT-PCR法检测各组细胞HO-1和NQO-1 mRNA的表达,Trizol法提取总RNA并测定RNA浓度,采用逆转录试剂盒合成cDNA,引物序列如表1。PCR反应条件: 94 ℃ 3 min; 94 ℃ 30 s, 50 ℃(HO-1和β-actin)/ 52 ℃(NQO-1)30 s, 72 ℃ 1 min, 32个循环; 72 ℃ 5 min。采用Quantity One软件分析条带灰度值,以目的基因条带灰度值与内参照β-actin基因条带灰度值的比值反映目的基因的表达水平。

表1 RT-PCR引物序列
3.3SOD活性的检测 收集各组细胞,冰浴匀浆,4℃离心,取上清液,严格按照试剂盒说明书进行操作。
3.4超氧化物阴离子荧光探针检测活性氧簇(reactive oxygen species,ROS) 用含5 μmol/L DHE的低糖DMEM培养基,于37 ℃孵育细胞30 min, 进行荧光探针装载,PBS洗涤2次,荧光显微镜进行检测,采用ImageJ 软件进行半定量分析。
4 统计学处理
使用 SPSS 20.0 软件分析,计量资料行正态性检验,实验数据以均数±标准差(mean±SD)表示。组间比较采用单因素方差分析,多组样本的均数比较先行方差齐性检验,方差齐者两两比较行 SNK-q检验,方差不齐者行 Dunnett’s 检验,以P<0.05 为差异有统计学意义。
结 果
1 氢分子对高糖培养的肾小球系膜细胞凋亡相关蛋白表达的影响
与C组比较,H组中Bax和cleaved caspase-3的蛋白水平上调,Bcl-2蛋白表达下调(P<0.05),而HH组上述蛋白与C组比较差异均无统计学显著性;与H组比较,HH组的Bax和cleaved caspase-3蛋白水平明显下调,Bcl-2表达明显上调(P<0.05),见图1。这提示高糖状态下,氢分子可提高抗凋亡蛋白和降低促凋亡蛋白的水平。

Figure 1. The effects of hydrogen molecule on the protein levels of Bcl-2, Bax and cleaved caspase-3 in glomerular mesangial cells cultured with high glucose. Mean±SD.n=5.*P<0.05vsC group;#P<0.05vsG group;△P<0.05vsH group.
图1氢分子对高糖培养的肾小球系膜细胞凋亡相关蛋白表达的影响
2 氢分子对高糖培养的肾小球系膜细胞ROS及SOD活性的影响
与C组比较,H组的红色荧光明显增强,提示H组细胞内的ROS水平较C组增高;与H组比较,HH组的红色荧光明显减弱,提示HH组细胞内的ROS水平较H组明显降低,见图2。这表明氢分子可有效降低高糖诱导的ROS水平。
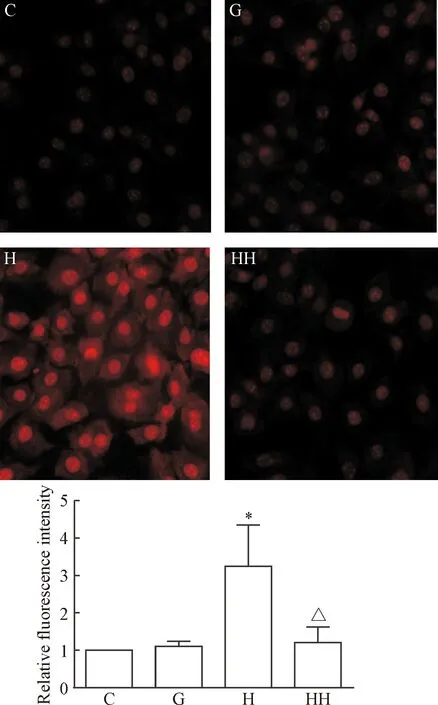
Figure 2. The effects of hydrogen molecule on ROS production in glomerular mesangial cells cultured with high glucose (DHE method, ×200). Mean±SD.n=4.*P<0.05vsC group;△P<0.05vsH group.
图2氢分子对高糖培养的肾小球系膜细胞活性氧表达的影响
H组的SOD活性较C组明显降低(P<0.05),而HH组的SOD活性与C组比较,差异无统计学显著性,且HH组的SOD活性明显高于H组(P<0.05),见图3,提示氢分子可有效提高高糖状态下抗氧化酶的活性。
3 氢分子对高糖培养的肾小球系膜细胞Nrf2信号通路的影响
与C组比较,H组Nrf2、HO-1和NQO-1蛋白表达降低,HO-1和NQO-1的mRNA表达也降低(P<
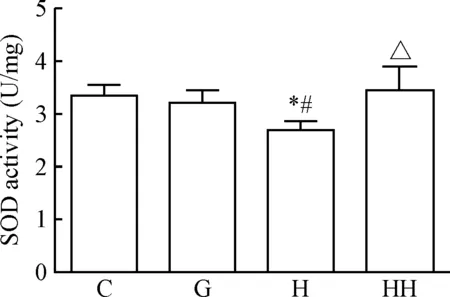
Figure 3. The effects of hydrogen molecule on the activity of SOD in glomerular mesangial cells cultured with high glucose. Mean±SD.n=6.*P<0.05vsC group;#P<0.05vsG group;△P<0.05vsH group.
图3氢分子对高糖培养的肾小球系膜细胞SOD活性的影响
0.05);HH组的Nrf2、HO-1和NQO-1蛋白表达及HO-1和NQO-1的mRNA表达均明显高于H组(P<0.05),见图4、5。
讨 论
DN是糖尿病常见而严重的慢性并发症,也是糖尿病患者死亡的主要原因之一。目前认为, 细胞凋亡在 DN 的发生与发展中起着重要作用[16]。 研究发现,肾小球系膜细胞凋亡参与DN的发病[17]。本实验表明,高糖可明显诱导肾小球系膜细胞促凋亡蛋白Bax和cleaved caspase-3的表达,抑制其抗凋亡蛋白Bcl-2的表达。
氧化应激是细胞凋亡的重要诱因,高血糖可诱导产生大量的活性氧,并超过机体的清除能力,使氧化/抗氧化系统失衡,引起脂质、蛋白质、DNA 过氧化及线粒体损伤,诱导细胞凋亡。Sugiyama等[7]在电子显微镜下也观察到ROS可明显诱导人肾小球系膜细胞凋亡,提示采取措施抑制高糖引发的氧化应激反应可能是改善DN的重要策略。我们发现,高糖状态下,肾小球系膜细胞产生大量的活性氧并伴有SOD活性的降低,且促凋亡相关蛋白表达相应增加,抗凋亡蛋白表达相应减少。采用富氢水干预后,可明显降低其活性氧水平,并显著提高抗氧化酶SOD活性,同时伴有抗凋亡蛋白表达增加和促凋亡蛋白表达减少,提示氢分子通过其选择性的抗氧化作用,对高糖状态下的肾小球系膜细胞发挥抗凋亡的保护作用。
Nrf2信号通路是目前发现的最重要的内源性抗氧化应激通路,在糖尿病氧化损伤中起关键的抑制作用[18]。Nrf2 广泛存在于心、肺、肝、肾和神经系统等组织器官内,是内源性抗氧化应激通路Nrf2-ARE通路中重要的转录因子,其通过与抗氧化反应元件ARE相互作用调节编码抗氧化蛋白。生理状态下,Nrf2在细胞浆中与它的抑制蛋白Keap1结合,保持低活性状态;当细胞暴露于氧化应激或亲电子混合物时,Nrf2从Keap1上游离出来,转位入细胞核中,与ARE结合,从而促使下游的HO-1和NQO1等的表达,发挥抗氧化的作用[2]。研究报道,Nrf2激活剂可减轻糖尿病所致肾脏的氧化损伤和炎症反应[18-19],而Nrf2-KO糖尿病小鼠较对照鼠表现为更大量的肾脏ROS产物和严重的DNA氧化损伤[20];Nrf2及其下游蛋白NQO1和γ-谷氨酰半胱氨酸合成酶(γ-glutamylcysteine synthetase,γ-GCS)的激活能够显著改善STZ诱导的野生型糖尿病小鼠肾脏的氧化损伤。本研究结果显示,高糖(25 mmol/L葡萄糖)组Nrf2蛋白以及HO-1和NQO-1 mRNA及蛋白表达降低,与Bai等[21]在糖尿病心肌病的研究结果一致,但Li等[22]在高糖组用30 mmol/L葡萄糖造模却得到了相反的实验结果,推测原因可能与糖浓度不同有关。高糖组ROS水平明显升高,提示高糖组处于高氧化应激状态,而高糖状态加富氢水干预后,可以显著提高Nrf2蛋白以及下游HO-1和NQO-1的mRNA及蛋白表达,且ROS水平相应降低,提示氢分子对高糖诱导的肾小球系膜细胞氧化应激反应具有抑制作用。因此,本研究初步认为,氢分子作为一种新型的 Nrf2 激活剂,可能通过上调Nrf2表达,激活下游抗氧化蛋白表达,增强细胞抗氧化能力,从而在高糖状态下对肾小球系膜细胞发挥抗凋亡作用。
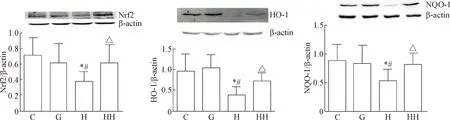
Figure 4. The effects of hydrogen molecule on the protein levels of Nrf2, HO-1 and NQO-1 in glomerular mesangial cells cultured with high glucose. Mean±SD.n=10.*P<0.05vsC group;#P<0.05vsG group;△P<0.05vsH group.
图4氢分子对高糖培养的肾小球系膜细胞Nrf2、HO-1和NQO-1蛋白表达的影响
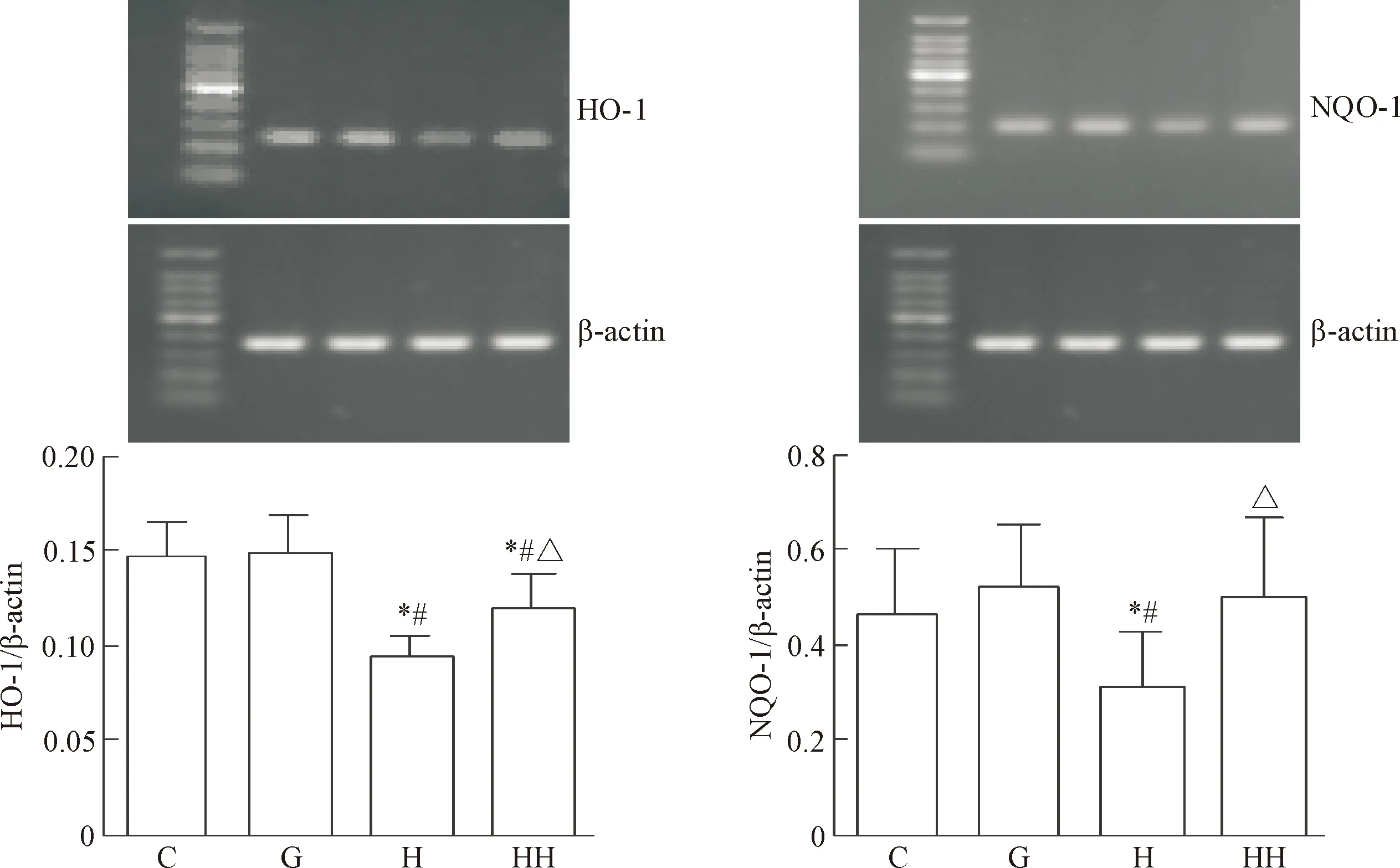
Figure 5. The effects of hydrogen molecule on the mRNA expression of HO-1 and NQO-1 in glomerular mesangial cells cultured with high glucose. Mean±SD.n=10.*P<0.05vsC group;#P<0.05vsG group;△P<0.05vsH group.
图5氢分子对高糖培养的肾小球系膜细胞HO-1和NQO-1mRNA表达的影响
[1] Lemley KV, Abdullah I, Myers BD, et al. Evolution of incipient nephropathy in type 2 diabetes mellitus[J]. Kidney Int, 2000, 58(3):1228-1237.
[2] Kang PS, Frencher S, Reddy V, et al. High glucose promotes mesangial cell apoptosis by oxidant-dependent mechanism[J]. Am J Physiol Renal Physiol, 2003, 284(3):F455-F466.
[3] Kikkawa R, Koya D, Haneda M. Progression of diabetic nephropathy[J]. Am J Kidney Dis, 2003, 41(3 Suppl 1):S19-S21.
[4] Harris RD, Steffes MW, Bilous RW, et al. Global glomerular sclerosis and glomerular arteriolar hyalinosis in insulin dependent diabetes[J]. Kidney Int, 1991, 40(1):107-114.
[5] 李晓博, 牟中卿, 陈 丽, 等. 糖尿病大鼠肾脏组织氧化应激及其在糖尿病肾病发病中的意义[J]. 中国病理生理杂志, 2006, 22(4):806-809.
[6] 李素娟, 李剑敏, 汪 洋, 等. 氧化应激和 P53 参与波动高糖诱导的肾小管上皮细胞凋亡[J]. 中国病理生理杂志, 2011, 27(12):2302-2306.
[7] Sugiyama H, Kashihara N, Makino H, et al. Reactive oxygen species induce apoptosis in cultured human mesangial cells[J]. J Am Soc Nephrol, 1996, 7(11):2357-2363.
[8] de Haan JB. Nrf2 activators as attractive therapeutics for diabetic nephropathy[J]. Diabetes, 2011, 60(11):2683-2684.
[9] Kitada M, Koya D. Renal protective effects of resveratrol[J]. Oxid Med Cell Longev, 2013, 2013:568093.
[10] Ohsawa I, Ishikawa M, Takahashi K, et al. Hydrogen acts as a therapeutic antioxidant byselectively reducing cytotoxic oxygen radicals[J]. Nat Med, 2007, 13(6):688-694.
[11] Huang Y, Xie K, Li J, et al. Beneficial effects of hydrogen gas against spinal cord ischemia-reperfusion injury in rabbits[J]. Brain Res, 2011, 1378:125-136.
[12] Ohsawa I, Nishimaki K, Yamagata K, et al. Consumption of hydrogen water prevents atherosclerosis in apolipoprotein E knockout mice[J]. Biochem Biophys Res Commun, 2008, 377(4):1195-1198.
[13] Kamimura N, Nishimaki K, Ohsawa I, et al. Molecular hydrogen improves obesity and diabetes by inducing hepa-tic FGF21 and stimulating energy metabolism indb/dbmice[J]. Obesity, 2011, 19(7):1396-1403.
[14] Zeng J, Zhang M, Sun X. Molecular hydrogen is involved in phytohormone signaling and stress responses in plants[J]. PLoS One, 2013, 8(8):e71038.
[15] Hong Y, Shao AW, Wang J, et al. Neuroprotective effect of hydrogen-rich saline against neurologic damage and apoptosis in early brain injury following subarachnoid hemorrhage: possible role of the Akt/GSK3β signaling pathway[J]. PLoS One, 2014, 9(4):e96212.
[16] Sano K, Fujigaki Y, Miyaji T, et al. Role of apoptosis in uranyl acetate induced acute renal failure and acquired resistance to uranyl acetate[J]. Kidney Int, 2000, 57(4):1560-1570.
[17] Mishra R, Emancipator SN, Kern T, et al. High glucose evokes an intrinsic proapoptotic signaling pathway in mesangial cells[J]. Kidney Int, 2005, 67(1):82-93.
[18] Jiang T, Huang Z, Lin Y, et al. The protective role of Nrf2 in streptozotocin-induced diabetic nephropathy[J]. Diabetes, 2010, 59(4):850-860.
[19] Palsamy P, Subramanian S. Resveratrol protects diabetic kidney by attenuating hyperglycemia-mediated oxidative stress and renal inflammatory cytokines via Nrf2-Keap1 signaling[J]. Biochim Biophys Acta, 2011, 1812(7):719-731.
[20] Yoh K, Hirayama A, Ishizaki K, et al. Hyperglycemia induces oxidative and nitrosative stress and increases renal functional impairment in Nrf2-deficient mice[J]. Genes Cells, 2008, 13(11):1159-1170.
[21] Bai Y, Cui WP, Xin Y, et al. Prevention by sulforaphane of diabetic cardiomyopathy is associated with up-regulation of Nrf2 expression and transcription activation[J]. J Mol Cell Cardiol, 2013, 57:82-95.
[22] Li H, Wang FX, Zhang L, et al. Modulation of Nrf2 expression alters high glucose-induced oxidative stress and antioxidant gene expression in mouse mesangial cells[J]. Cell Signal, 2011, 23(10):1625-1632.

