环介导等温扩增技术与横向流动试纸条法快速检测布鲁氏杆菌
李秀梅, 梁智选, 李 颖, 郭 恋, 王健春, 赵 静, 王红军
(1.天津市动物疫病预防控制中心,天津 300402;2.天津市畜牧业发展服务中心,天津300384)
布鲁氏菌病(简称布病,Brucellosis,俗称地中海弛张热、马耳他热、波浪热或波状热等)是由布鲁氏菌(Brucella)引起的一种变态反应性人畜共患传染病,严重地威胁着多种动物和人的健康,导致巨大的经济损失和严重的公共卫生危害。我国农业部将其列为二类动物疫病,卫生部将其列为乙类传染病,世界动物卫生组织(OIE)将其列为法定报告动物疫病[1]。其在自然环境中生活力较强,在病畜的分泌物、排泻物及死畜的脏器中能生存4个月左右,在食品中约生存2个月。羊、牛、猪是其主要宿主,羊、牛、猪和其畜产品与人类接触密切,从而增加了人类感染的机会,因此建立快速、准确的检测方法是保证人类和动物生命安全的重要手段。
传统的布鲁氏杆菌诊断主要通过病原分离与生化鉴定完成,但其存在细菌培养操作繁琐、耗时长等缺点。随着分子生物学检测技术的发展,以OMP25 基 因[2]、OMP31 基 因[3]、OMP22 基 因[4]、BSCP31基因[5]、BM28基因[6]等为靶标建立的PCR或实时定量荧光PCR技术已成功应用于布鲁氏杆菌的实验室诊断,具有特异性强、灵敏度高和速度快等优点,但该方法必须配备昂贵的仪器设备,需专门的操作人员,在适应性上有一定的缺陷。环介导等温扩增技术是Notomi等[7]于2000年建立的,该技术通过针对目的基因的6个区域设计4条特异性引物,利用一种链置换DNA聚合酶 (Bst DNA polymerase)在等温65℃左右,几十分钟即可实现核酸的高效扩增。该方法仅需要简单的水浴锅或加热器,操作简便、特异性强、灵敏度高、检测快速,适合于基层及现场使用。
2008年Kiatpathomchai[8]首次将横向流动试纸条技术与环介导等温扩增技术相结合 (LAMPLFD),用于LAMP扩增产物的检测。目前,该方法已被成功用于嗜盐弧菌、人的非洲锥虫病、副溶血霍乱弧菌、桃拉病毒、传染性肌肉坏死病毒、对虾白斑症病毒等病原的检测。在横向流动试纸条技术检测反应中,FITC标记的探针与生物素标记的LAMP扩增产物特异性杂交,并与胶体金标记的抗FITC的抗体结合形成三元复合物,并结合在横向流动试纸条具有生物素抗体的检测线上;未杂交的FITC标记探针与胶体金标记的抗FITC的抗体形成不含生物素的两元复合物,通过检测线,结合在控制线上。这样可以通过检测带是否显色判断扩增产物的有无。因此,LAMP-LFD方法安全、快速、高效且无设备及技术限制,具有其他技术无法替代的优势。
作者根据布鲁氏杆菌重要的毒力因子OMP25基因设计一套引物和探针,优化反应条件,建立布鲁氏杆菌LAMP-LFD检测方法,旨在将该方法应用于食品中布鲁氏杆菌的检测。
1 材料与方法
1.1 实验材料
Bst DNA 聚合酶、Taq 酶、dNTP、10×buffer(Mg2+Free)缓冲液:购自纽英伦生物技术(北京)有限公司;Betaine Solution(甜菜碱)、钙黄绿素:购自美国Sigma 公司;MgCl2、DNA marker:购自天根生化科技(北京)有限公司;细菌基因组DNA提取试剂盒、普通质粒小提试剂盒:购自杭州博日股份科技有限公司;横向流动试纸条检测所用通用检测试纸条:购自Milenia Biotec GmbH (Milenia Genline Hybri Detect by Milenia Biotec GmbH,Germany,http://www.mileniabiotec.de/);单增李斯特菌菌株 (菌株编号:ATCC13932):购自 CDC;金黄色葡萄球菌(菌株编号 :ATCC25923)、 沙 门 氏 菌 (菌 株 编 号 :ATCC10708)、 宋 氏 志 贺 氏 菌 (菌 株 编 号 :ATCC25931)、 空 肠 弯 曲 杆 菌 (菌 株 编 号 :ATCC29428)、大肠埃希氏菌O157(菌株编号:ATCC35150)等菌株:购自广州粤晨生物科技有限公司;布鲁氏杆菌DNA:中国农业科学院兰州兽医研究所惠赠。
1.2 引物设计与合成
根据GenBank中OMP25基因的已知序列 (序列号:AY89220)设计用于LAMP扩增的外引物BRU-F3、BRU-B3,内引物 BRU-FIP、BRU-BIP 等 4条特异性引物,同时合成BRU-HP探针1条,用于LFD的杂交试验,见表1。在内引物BRU-FIP的5’端标记生物素,在BRU-HP的5’端标记FITC。以上引物和探针由宝生物工程(大连)有限公司合成。其中,外引物BRU-F3、BRU-B3同时用作PCR扩增的特异性引物,扩增的预期片段大小约为228 bp。

表1 引物序列Table 1 Primer sequence
1.3 布鲁氏杆菌DNA基因组的提取
使用细菌基因组DNA提取试剂盒对布鲁氏杆菌细菌培养液提取基因组DNA,-20℃保存备用。
1.4 LAMP扩增条件的确立
以布鲁氏杆菌基因组DNA 2个浓度作为模板进行扩增条件的优化(经平板计数法测定,较高模板浓度相当于5.4×105CFU/mL,较低模板浓度相当于 5.4×102CFU/mL)。 LAMP 反应体系为 25 μL,包括 1×buffer(Tris-HCl 20 mmol/L(pH 8.8),MgS046.5 mmol/L,KCl 10 mmol/L, (NH4)2SO410 mmol/L,Triton X-100 0.1%,), 甜菜碱 1.6 mol/L,dNTPs 1.4 mmol/L,外引物 BRU-F3 和 BRU-B3 各 0.2 μmol/L,内引物 BRU-FIP和 BRU-BIP 各 1.6 μmol/L,Bst DNA聚合酶8U,布鲁氏杆菌基因组DNA模板2μL。阴性对照不加任何模板DNA。反应混合物在一定温度下温育后,经80℃热激5 min终止反应,利用1.5 g/dL的琼脂糖凝胶电泳检测产物。分别在 61、62、63、64、65 ℃下扩增 60 min, 根据扩增效果确定适宜的反应温度; 分别以 20、25、30、35、40、45 min为反应时间,在63℃进行扩增,根据扩增效果确定适宜的反应时间。
1.5 横向流动试纸条检测
利用优化后的LAMP反应体系,使用经生物素标记内引物(BRU-FIP)进行LAMP扩增反应,反应结束时不经过终止反应,而在反应体系中加入20 pmol的探针BRU-HP,63℃杂交 5 min。杂交结束后,从反应液中取 8 μL杂交液加入到 100 μL Buffer中混匀,将LFD试纸条浸入其中,反应约5 min,肉眼观察结果。
1.6 LAMP的灵敏度测定
将布鲁氏杆菌的原始菌液 (相当于5.4×106CFU/mL)进行连续10倍浓度梯度稀释,对稀释后不同浓度梯度的菌液进行离心,取其菌体沉淀提取基因组DNA,并以此为模板,利用优化的LAMP反应体系进行扩增。扩增产物分别经1.5 g/dL琼脂糖凝胶电泳和LFD检测扩增结果。同时,在相同模板浓度下,以外引物BRU-F3和BRU-B3为特异性引物,进行PCR扩增。PCR反应体系为25 μL,Taq DNA聚合酶(5 U/μL)0.15 μL,dNTPs(2.5 mmol/μL)2 μL,BRU-F3 (10 pmol/μL) 1 μL,BRU-B3(10 pmol/μL) 1 μL,模板 2 μL。 PCR 反应程序:94 ℃ 3 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s,30 个循环;72 ℃10 min。扩增产物利用2 g/dL琼脂糖凝胶电泳检测。
1.7 LAMP的特异性试验
将布鲁氏杆菌(羊种布鲁氏杆菌、牛种布鲁氏杆菌、猪种布鲁氏杆菌、犬种布鲁氏杆菌)与非布鲁氏菌菌株(单增李斯特菌菌株、金黄色葡萄球菌、沙门氏菌、宋氏志贺氏菌、空肠弯曲杆菌、大肠埃希氏菌O157)基因组核酸,按照建立的LAMP-LFD检测方法,进行特异性试验。
1.8 LAMP-LFD的重复性试验
将布鲁氏杆菌细菌培养液经平板菌落计数后,进行10倍浓度梯度稀释至LAMP-LFD检测的最低浓度,平行制备3个样品,使用细菌基因组DNA提取试剂盒提取基因组DNA,并以此为模板,利用优化的LAMP反应体系进行扩增,验证该方法的重复性。
2 结果与分析
2.1 LAMP扩增条件的建立
以较低浓度基因组DNA (5.4×102CFU/mL)为模板,选择 61、62、63、64、65 ℃ 5 个不同的反应温度进行LAMP扩增,结果见图1。在同样的反应体系下,63℃时条带最为清晰明亮,故确定LAMP反应的最适反应温度为63℃。以较高浓度基因组DNA(5.4×105CFU/mL)作为模板时,反应 20 min 即可检测到扩增产物,反应25 min扩增产物的浓度几乎达到最高值,延长扩增反应时间,扩增产物浓度不再出现明显提高(图2(a));以较低浓度基因组DNA(5.4×102CFU/mL)作为模板时,反应 20 min 未能检测到明显扩增;反应25 min可检测到明显扩增;反应30 min,扩增产物浓度不再出现明显提高 (图2(b))。为确保样品检测时,在较低模板浓度下仍尽可能地检出病原,选择LAMP扩增的最佳反应时间为40 min。
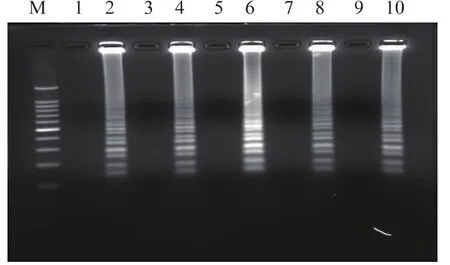
图1LAMP反应温度的确立Fig.1 Establishment of LAMP reaction temperature
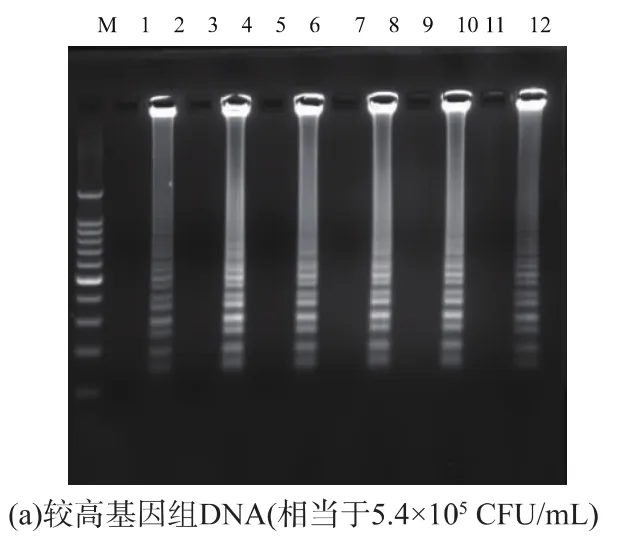
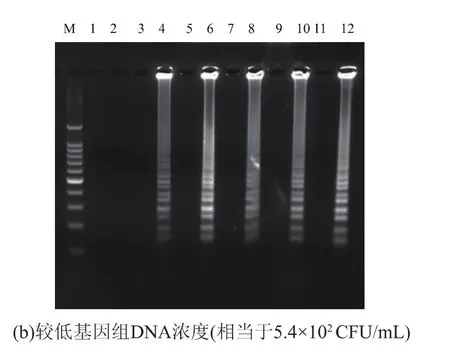
图2 LAMP反应时间的确立Fig.2 Establishment of LAMP reaction time
2.2 LAMP-LFD检测与特异性试验结果
按优化的LAMP反应体系,换用生物素标记的内引物BRU-FIP进行LAMP扩增反应。反应产物经1.5 g/dL的琼脂糖凝胶电泳检测发现,以羊种布鲁氏杆菌、牛种布鲁氏杆菌、猪种布鲁氏杆菌和犬种布鲁氏杆菌基因组DNA为模板的反应产物可出现特征性的梯状条带,以其他6株病原菌基因组DNA为模板的反应产物中未见明显扩增 (图3(a))。扩增产物经LFD检测发现,以羊种布鲁氏杆菌、牛种布鲁氏杆菌、猪种布鲁氏杆菌和犬种布鲁氏杆菌基因组DNA为模板的反应产物可使LFD试纸条的检测线位置出现明显的阳性条带,以其他6株病原菌基因组DNA为模板的反应产物在试纸条的检测线位置未出现条带(图3(b))。
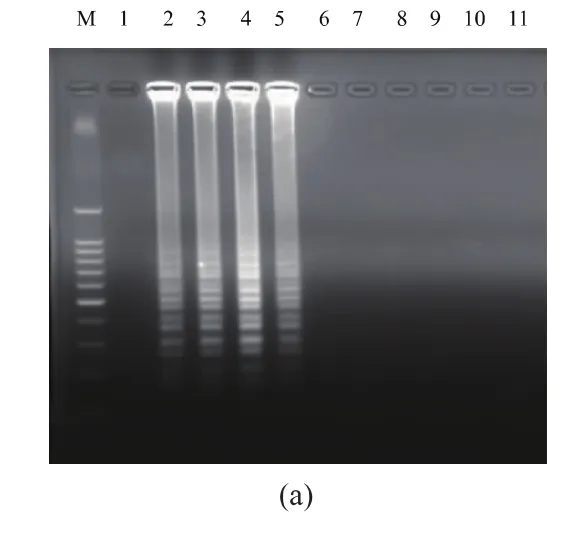

图3LAMP和LAMP-LFD特异性分析Fig.3 Specification analysis of LAMP and LAMP-LFD
2.3 LAMP-LFD的灵敏度测定
布鲁氏杆菌原始菌液 (相当于5.4×106CFU/mL)进行连续10倍浓度梯度稀释,对稀释后不同浓度梯度的菌液进行离心,取其菌体沉淀提取基因组DNA。以不同浓度的基因组DNA为模板进行的LAMP-LFD结果显示,反应产物经1.5 g/dL的琼脂糖凝胶电泳检测的最低模板浓度为原始浓度的10-6倍,即 5.4×100CFU/mL(图 4(a)和图 4(b))。 而以同样的模板进行PCR扩增,可检测的最低模板浓度为原始浓度的 10-4倍,即 5.4×102CFU/mL(图 4(c))。因此,LAMP-LFD方法的灵敏度是利用外引物BRU-F3、BRU-B3建立的PCR方法的100倍。


图4LAMP、LAMP-LFD和PCR检测的灵敏度比较Fig.4 Sensitivity comparision of LAMP assay of LAMP LAMP-LFD and PCR
2.4 LAMP-LFD的重复性分析
取3份布鲁氏杆菌原始菌液样品,经平板计数后,连续10倍浓度梯度稀释至最低检测浓度(约为5.4×100CFU/mL),使用细菌基因组DNA提取试剂盒提取基因组DNA,以此为模板进行LAMP-LFD扩增,反应产物经1.5 g/dL的琼脂糖凝胶电泳和LFD检测均可获得明显的阳性结果(见图5),说明该方法可重复、稳定性好。

图5LAMP和LAMP-LFD的重复性试验Fig.5 Repeated test of LAMP and LAMP-LFD
3 讨论
布鲁氏杆菌是一种能引起人畜共患病和食源性疾病的致病菌。该菌存在于食品中可引起人的食物中毒,对人和动物的生命安全构成了严重的威胁。众所周知,开展对该病原进行快速、灵敏、准确的检测是有效防治本病和保证食品卫生安全的重要手段。因此建立一种快速、灵敏、特异的检测布鲁氏杆菌的方法具有重要的公共卫生意义。
OMP25是布鲁氏杆菌重要的致病因子[9-11],它广泛存在于不同来源的布鲁氏杆菌;OMP25基因也是布鲁氏杆菌的特异基因,它与其他细菌毒力基因无同源性。因此,OMP25基因已成为布鲁氏杆菌分子检测方法(如PCR、荧光PCR等)的首选基因之一。作者以OMP25基因作为布鲁氏杆菌LAMP检测方法目的基因,设计了4条引物和1个DNA探针,用于LAMP-LFD检测,并优化了各反应条件。结果表明,生物素标记的LAMP扩增最佳反应温度为63℃、最佳反应时间为40 min,扩增后将扩增产物与异硫氰酸荧光素标记的DNA探针于63℃杂交5 min,再进行LFD反应,5 min后即可通过观察检测线位置出现红色条带与否来判定结果。该方法检测时间大大缩短,仅耗时50 min,与其他检测技术相比具有明显的优势。
检测技术的灵敏度和特异性对病原快速检测是非常重要的。LAMP反应仅在恒温条件下进行,扩增效率极高,通常1 h内可完成对靶基因约1010倍扩增[7],特别适用于食源性致病菌的快速检测。LAMP扩增结果可通过琼脂糖凝胶电泳[7]、目视检测浊度[12]、浊度仪检测浊度[13]、目视检测荧光[14-17]等方法来判定,由于LAMP反应引物多,产物复杂,上述几种判定方法不能够区分特异性和非特异性扩增,并且当模板含量较低时,上述检测方法在结果判断时主观性较大[7]。另外,目视检测荧光判定方法中使用的一些染料对LAMP扩增反应会有一些负面作用,比如SYBR greeΙ可与扩增产物核酸的小沟结合,影响扩增产物的量[18]。电泳检测法扩增产物的灵敏度虽比目视检测荧光和目视检测浊度约高10倍,但电泳检测法易增加产物污染的机率。而LFD对LAMP扩增结果的判定则是依赖于序列之间的特异性杂交,避免了琼脂糖凝胶电泳、目视检测浊度、浊度仪检测浊度、目视检测荧光等判定方法中由非特异性扩增造成的假阳性,在LAMP扩增的基础上进一步提高了反应的特异性和灵敏度。本研究中,LAMP-LFD布鲁氏杆菌的检测限为 5.4×100CFU/mL,与PCR方法相比灵敏度高100倍。优于许邹 亮[19]、Ohtsuki R[20]、Lin GZ[21]、Song L[22]等 建 立 的LAMP反应体系,与Soleimani M[23]等报道的检测限相当。因此,在食品中布鲁氏杆菌含量很低的情况下,就可采用LAMP-LFD进行检测。LAMP-LFD布鲁氏杆菌特异性检测结果表明,4株不同种的布鲁氏杆菌均呈阳性反应,其他6株非布鲁氏杆菌均为阴性,说明该检测方法特异性较高,并不与相关细菌发生交叉反应。这是应用LAMP-LFD技术检测布鲁氏杆菌的首次报道。
由研究结果可以看出,布鲁氏杆菌LAMP-LFD检测灵敏度比常规PCR方法高2个数量级,特异性和灵敏度较高,整个检测过程仅需80 min。且该技术不需要特殊的仪器设备,检测快速、操作简便,灵敏度高,为布鲁氏杆菌的诊断防控提供了新的发展方向,有望成为常规简易检测手段,尤其适用于基层和现场检测应用。
4 结 语
以布鲁氏杆菌OMP25基因为靶标建立的LAMP-LFD技术,能够快速、准确地检测布鲁氏杆菌,检测灵敏度达到 5.4×100CFU/mL,仪器需求简单,可满足基层检测机构和现场疫源地检测的需要。
[1]李长友,李明.动物布鲁菌病防治指导手册[M].北京:中国农业出版社,2012.
[2]DU Zhenkun,GUO Junqing,ZHANG Miaoxian,et al.Nested-PCR for detection of Brucella in milk[J].Journal of Zhejiang University,2008,34(2):169-174.(in Chinese)
[3]WAND Suhua,WAND Zhongcai,DU Aifang.Establishment of PCR for detecting bovine Brucella[J].China Animal Husbandry&Veterinary Medicine,2012,39(4):79-82.(in Chinese)
[4]XU Jun,WANG Yuanzhi,CHEN Chuangfu,et al.Nested-PCR for detection of Brucella in milk[J].Animal Husbandry&Veterinary Medicine,2008,4(140):64-66.(in Chinese)
[5]WANG Shenghang,SHAO Weijuan,XIE Jianyun,et al.Detection of Brucella(RS) using polymerase chain reaction[J].ShanghaiLaboratory Animal Science,2003,23(3):154-162.(in Chinese)
[6]ZHANG Taixiang,LING Zongshuai,ZHAO Lina,et al.Real-time quantitative RT-PCR assay for specific identification of brucella by real-time PCR[J].Chinese Journal of Animal Quarantine,2011,28(11):29-31.(in Chinese)
[7]NOTOMI T,OKAYAMA H,MASUBUCHI H,et al.Loop-mediated isothermal amplification of DNA[J].Nucleic Acids Res,2000,28(12):e63.
[8]KIATPATHOMCHAI W,JAROENRAM W,ARUNRUT N,et al.Shrimp Taura syndrome virus detection by reverse transcription loop-mediated isothermal amplification combined with a lateral flow dipstick[J].J Virol Methods, 2008,153(2):214-217.
[9]EDMONDS M P,CLOECKAERT A,BOOTH N J,et al.Attenuation of a Brucella abortus mutant lacking a major 25 KDa outer membrane protein in cattle[J].Am J Vet Res,2001,62:1461-1466.
[10]MATTHEW D,EDMONDS,CLOECKAERT A,et al.Brucella species lacking the major outer membrane protein Omp25 are attenuated in mice and protect against Brucella melitensis and Brucella ovis[J].Vet Microbiol,2002,88:205-221.
[11]BOIGEGRAIN R A,SALHI I,ALVAREZ M M T,et al.Release of periplasmic proteins of Brucella suis upon acidic shock involves the outer membrane protein Omp25[J].Infect Immun,2004,72:5693-5703.
[12]MORI Y,NAGAMINE K,TOMITA N,et al.Detection of loop-mediated isothermal amplification reaction by turbidity derived from magnesium pyrophosphate formation[J].Biochemical and Biophysical Research Communications,2001,289(1):150-154.
[13]MORI Y,KITAO M,TOMITA N,et al.Real-time turbidimetry of LAMP reaction for quantifying template DNA[J].Journal of Biochemical and Biophysical Methods,2004,59(2):145-157.
[14]NJIRU ZK,MIKOSZA A S,ARMSTRONG T,et al.Loop-mediated isothermal amplification(LAMP) method for rapid detection of Trypanosoma brucei rhodesiense[J].PLoS Neglected Tropical Diseases,2008,2(1):e 147.
[15]TOMITA N,MORI Y,KANDA H,et al.Loop-mediated isothermal amplification (LAMP)of gene sequences and simple visual detection of products[J].Nature Protocols,2008,3(5):877-882.
[16]GOTO M,HONDA E,OGURA A,et al.Colorimetric detection of loop-mediated isothermal amplification reaction by using hydroxy naphthol blue[J].Biotechniques,2009,46(3):167-172.
[17]LIANG C,CHENG S,CHU Y,et al.A closed-tube detection of loop-mediated isothermal amplification(LAMP) products using a wax-sealed fluorescent intercalator[J].Iournal of Nanoscience and Nanotechnology,2013,13(6):3999-4005.
[18]ESPY M J,UHL J R,SLOAN L M,et al.Real-time PCR in clinical microbiology:applications for routine laboratory testing[J].Clinical Microbiology Reviews,2006,19(1):165-256.
[19]XU Zouliang,NAN Wenlong,ZHOU Jie,et al.Visual detection of Brucella by loop-mediated isothermal amplification with hydroxynaphthol blue dye[J].Chinese Journal of Animal Quarantine,2011,28(8):37-40.(in Chinese)
[20]OHTSUKI R1,KAWAMOTO K,KATO Y,et al.Rapid detection of Brucella spp.by the loop-mediated isothermal amplification method[J].J Appl Microbiol,2008,104(6):1815-1823.
[21]LIN G Z 1,ZHENG F Y,ZHOU J Z,et al.Loop-mediated isothermal amplification assay targeting the OMP25 gene for rapid detection of Brucella spp[J].Mol Cell Probes,2011,25(2-3):126-129.
[22]SONG L1,LI J,HOU S,et al.Establishment of loop-mediated isothermal amplification (LAMP) for rapid detection of Brucella spp.and application to milk and blood samples[J].J Microbiol Methods,2012 ,90(3):292-297.
[23]SOLEIMANI M1,SHAMS S,MAJIDZADEH A K.Developing a real-time quantitative loop-mediated isothermal amplification assay as a rapid and accurate method for detection of Brucellosis[J].J Appl Microbiol,2013 ,115(3):828-834.

