水热法提取金银花中绿原酸的工艺研究
李杰,陈道鸽,王兵兵,王学廷
(河南科技大学医学院,河南洛阳471023)
绿原酸(Chlorogenic Acid,CA)是一种缩酚酸,在植物中经莽草酸途径形成的一类苯丙素类化合物[1],是国际公认的“植物黄金”[2]。现代药理学研究表明,绿原酸具有多种药理活性[3],如抗肿瘤、降血压、抗病毒等。同时,绿原酸还作为食品添加剂和植物生长激素,广泛应用于食品和化妆品行业[4-5]。鉴于绿原酸具有多种药理活性和广阔的应用领域,因此如何有效的从植物中进行提取越来越受到人们的关注。目前国外主要从咖啡豆中[6]提取绿原酸,而国内多以金银花为原料进行提取。金银花原产我国,具有清热解毒、疏散风热的功效,并且作为经济作物在各省都有大规模的人工种植区,资源丰富。
目前金银花中绿原酸的提取按照提取溶剂分类可大致分为水提法、有机溶剂提取法[7-8]和二氧化碳超临界萃取法[9]。从经济方面考虑水提法较为理想、实际,但是传统的水提法都是在开放的体系中进行提取,存在提取时间长、得率低等问题。近几年来发展起来的亚临界水提取[10]技术在一定程度上克服了传统水提法的不足,但设备比较昂贵,主要由高压注射泵、恒温炉、预加热器、萃取罐、冷却器及萃取接受等装置组成[11],提取成本较高。因此,有必要建立一种简便、经济、高效的水提法来提取金银花中的绿原酸。
水热法[12]是纳米材料合成[13-14]的一种常用方法,但在中药活性组分提取方面的应用研究还鲜见报道。其原理主要是以水为反应介质,通过对密闭的反应体系加热,在体系内部创造一个高温、高压的反应环境,使水处于亚临界(温度介于100℃~374℃之间)或超临界(温度高于374℃)[15]状态,从而表现出高活性、高传质速率的特点。该方法具有设备简单、操作简便、无污染等优点。因此,本研究通过单因素试验探讨了液料比、提取温度以及提取时间对金银花中绿原酸得率的影响,并在此基础上进行Box-Behnken中心组合设计,以绿原酸的得率为响应值,对该提取工艺进行了优化,以期为绿原酸的提取提供一种新途径、新方法,同时为金银花的开发利用提供参考。
1 材料与仪器
1.1 材料
金银花:洛阳中药材批发市场(粉碎过80目筛),经河南科技大学王学廷副教授鉴定,均为忍冬科植物忍冬的干燥花蕾;绿原酸标准品(质量分数为99.0%):上海金穗生物科技有限公司;甲醇、乙腈、磷酸(均为色谱纯):天津市巴斯夫化学试剂有限公司。
1.2 仪器
天美LC2000液相色谱仪:上海天美科学仪器有限公司;CT14RD高速离心机:上海天美生化仪器设备有限公司;BT125D双量程电子分析天平:德国多利斯公司;聚四氟乙烯内衬的不锈钢反应釜:福建物质结构研究所;PHG9246A烘箱:上海精宏实验设备有限公司。
2 方法
2.1 绿原酸的测定
2.1.1 色谱条件
色谱柱:Kromasil C18(250 mm×4.6 mm,5 μm);流动相:乙腈-0.4%磷酸(13∶87,体积比);检测波长:327 nm;进样量:20 μL;流速:1.0 mL/min;柱温:室温。
2.1.2 标准工作曲线的配制
精密称取绿原酸标准品10 mg,50%甲醇溶液溶解,并定容于50 mL棕色容量瓶中,逐级稀释为5、10、20、30、40、50 μg/mL 的绿原酸标准溶液。在“2.1.1”色谱条件下进行测定绿原酸的峰面积,以各浓度为纵坐标(Y),峰面积为横坐标(X)进行线性回归计算,得绿原酸标准品回归方程。
2.1.3 供试品溶液的制备及测定
按照料液比称取金银花粉末于18 mL水混合于水热釜中,密封反应釜并置于一定温度的烘箱内进行提取。提取结束后,自然冷却至室温,移取提取液2.00 mL以10 000 r/min离心分离5 min,取上清液0.20 mL于10 mL棕色容量瓶内,50%甲醇定容,0.45 μm滤膜过滤,取续滤液作为供试液,高效液相色谱法(High Performance Liquid Chromatography,HPLC) 法测定绿原酸的含量。
根据回归方程计算提取液中绿原酸的浓度,按公式计算绿原酸得率。改变提取条件,考察液料比、提取温度以及提取时间对绿原酸得率的影响。

式中:C为提取液中绿原酸的浓度,μg/mL;V为提取液的体积,mL;n为稀释倍数;M为金银花质量,g。
2.2 单因素试验设计
选取液料比 10 ∶1、20 ∶1、30 ∶1、40 ∶1、50 ∶1(mL/g)5 个水平;提取温度 80、90、100、110、120、130℃ 6个水平以及提取时间 10、20、30、40、50 min 5 个水平分别进行单因素试验。
2.3 Box-Behnken响应面法试验设计
综合单因素影响的试验结果,根据Box-Behnken试验设计原理,通过Design Expert 8.0.5统计分析软件的响应面分析法安排试验,优选水热法提取的最佳工艺参数。采用三因素三水平进行试验设计,水平编码见表1。

表1 Box-Behnken效应面法因素水平表Table 1 Factors and levels of Box-Behnken response surface method
2.4 数据分析
金银花中绿原酸提取试验平行进行3次,取平均值,然后利用Origin8.0和Design Expert 8.0.5软件进行作图和统计分析。
3 结果与讨论
3.1 标准品及供试品的色谱图
图1是绿原酸标准品、供试品以及空白溶剂的高效液相色谱图。
从图1中可以看出,在“2.1.1”的色谱条件下,供试液中的绿原酸和杂峰在12 min内实现了良好分离,且峰形对称不拖尾。绿原酸标准品的质量浓度Y与峰面积 X 的回归方程为:Y=2×10-5X+0.314 2,R2=0.999 9,线性关系良好。

图1 供试品溶液(A)绿原酸标准品溶液(B)空白溶剂(C)的高效液相色谱图Fig.1 HPLC of reference sample(A),reference substance(B)and 50%methanol(C)
3.2 方法学考察
3.2.1 精密度试验
取同一个绿原酸标准溶液,连续进样6次,以绿原酸的峰面计,绿原酸的RSD为1.42%,说明仪器的精密度良好。
3.2.2 重复性试验
取金银花粉末 0.8 g,液料比为 20 ∶1(mL/g),提取温度90℃,提取时间30 min,平行提取6份,在“2.1.1”色谱条件下进行检测,绿原酸峰面积的RSD值为1.39%,说明水热法提取绿原酸的重复性和稳定较好。
3.2.3 稳定性试验
取同一份供试液样品,在上述的色谱条件下,分别于配置后0、2、4、6、24 h进样,记录绿原酸的峰面积,RSD值为0.60%,表明供试液液在24 h内稳定。
3.2.4 回收率试验
精密量取0.5mL已知含量(绿原酸含量为0.545mg)供试液于50 mL容量瓶中,分别加入绿原酸对照品溶液(2.18 mg/mL)0.4、0.5、0.6 mL,按照低、中、高制备3组,平行测定3次,测得绿原酸平均加样回收率为96.58%,RSD=1.89%,说明该方法准确可靠。
3.3 单因素试验
3.3.1 液料比对绿原酸得率的影响
在提取温度为110℃,提取时间为20 min,液料比为 10 ∶1、20 ∶1、30 ∶1、40 ∶1、50 ∶1(mL/g)进行试验,探讨液料比绿原酸得率的影响,结果如图2所示。
由图2可知随着液料比增大,绿原酸得率呈现先升高后下降的趋势。这是因为随着提取溶剂体积的增大,金银花粉末与水的接触面积增大,使得绿原酸的得率逐渐升高,当液料比为30∶1(mL/g)时,绿原酸得率最大。超过30∶1(mL/g)后,绿原酸得率逐渐降低,这可能是由于当液料比为30∶1(mL/g)g时,在此提取条件下,金银花中的绿原酸已经完全提取出来,如果继续扩大液料比只会稀释提取液中绿原酸的浓度,从而表现为绿原酸的得率降低。因此,选择液料比为30∶1(mL/g)较为合适。
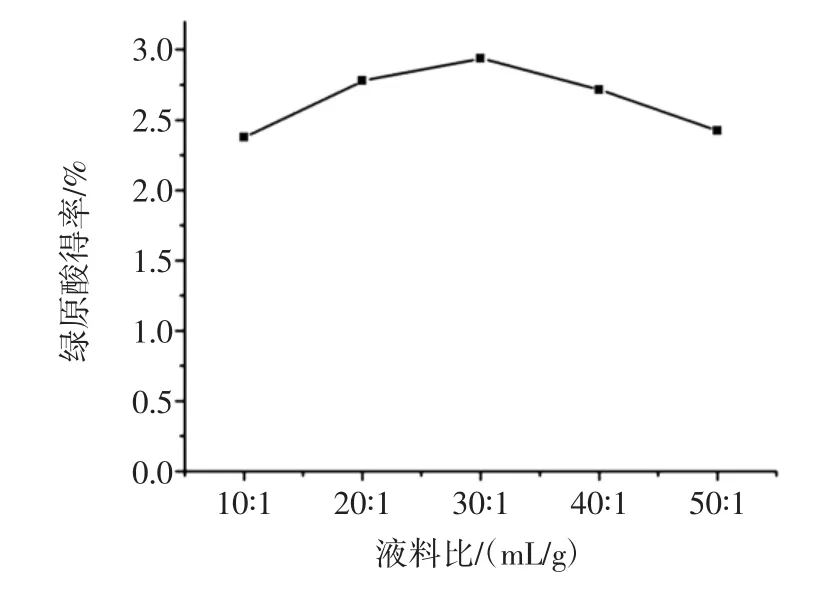
图2 液料比对绿原酸得率的影响Fig.2 Effect of liquid-solid ratio on CA extraction yield
3.3.2 提取温度对绿原酸得率的影响
选择试验条件为液料比30∶1(mL/g),提取时间20 min,提取温度控制为 80、90、100、110、120、130 ℃,讨论提取温度对绿原酸得率的影响。结果如图3所示。
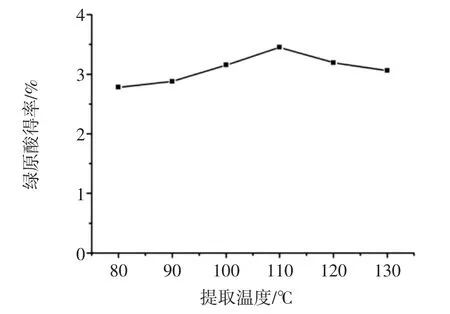
图3 提取温度对绿原酸得率的影响Fig.3 Effect of different temperature on CA extraction yield
从图3中可以看出在80℃~110℃范围内,随着提取温度的升高,绿原酸的得率也逐步提高。当提取温度为110℃时,绿原酸得率最高。一方面是由于温度的升高,加快了分子的扩散速度,使溶剂和固体组织充分接触,促进了整个提取过程的质量转移。此外提取温度超过100℃,水处于亚临近状态,与普通水相比,水的介电常数、表面张力和黏度都显著降低,水分子之间的氢键减弱,极性减小[16],提高了绿原酸在水中的溶解性和传质系数。同时,温度的升高也致使提取体系内的饱和蒸汽压升高,压力的升高有助于提高水对基质的穿透能力,缩短溶剂在基质的提取速度[17],从而提高绿原酸的溶出速度。当提取温度超过110℃时,绿原酸的得率开始降低,这可能是由于较高的温度和压力导致绿原酸分解所致。
3.3.3 提取时间对绿原酸得率得影响
固定液料比 30 ∶1(mL/g),提取温度为 110 ℃,选取 10、20、30、40、50 min 进行试验,考察提取时间对绿原酸得率得影响。结果见图4。

图4 提取时间对绿原酸得率的影响Fig.4 Effect of different extraction time on CA extraction yield
由图4可知,水热法提取10 min~30 min时,随着时间的延长,提取液中绿原酸的含量不断增加,超过30 min时,绿原酸的含量趋于平稳。这是由于在提取的初期,金银花中的绿原酸未被完全溶解出来,随着时间的延长,绿原酸逐渐被全部溶解出来并扩散到提取溶剂中,直至达到平衡。因此,提取时间宜控制在30 min左右。
3.4 Box-Behnken法试验结果与分析
采用Design Expert 8.0.5软件进行试验设计和结果分析,结果见表2。

表2 金银花中绿原酸得率得响应面试验设计及结果Table 2 Response surface design arrangement and experimental results
通过对试验结果进行响应面分析,经过二次回归拟合,得出拟合方程为:
Y=3.24-0.044A+0.13B-0.049C-0.11AB+0.13AC+0.045BC+0.038A2-0.060B2+0.053C2。
响应面分析法对绿原酸得率得ANOVA分析见表3。

表3 响应面分析法对绿原酸得率得ANOVA分析Table 3 ANOVA of the constructed regression model
表3对回归方程进行了方差分析,从中可以看出,各个因素对金银花中绿原酸得率影响的主次顺序为B>C>A,即提取温度>液料比>提取时间。3个因素对绿原酸得率影响显著程度排序为:AC>AB>BC。P值的大小表明模型及各考察因素的显著水平。P值小于0.05,表明模型或各因素有显著影响;P值小于0.01表明模型或各因素高度显著[18]。由表3可知,以绿原酸得率为响应值时,模型P=0.000 8<0.010 0,表明该二次方程模型高度显著。同时失拟项P=0.598 4>0.100 0,说明试验结果与数学模型拟合良好,可利用该数学模型预测试验结果,拟合方程的相关系数R2=0.981 4,与校正系数Adj.R2=0.947 9相近,表明绿原酸得率得预测值与实测值有较好的拟合度。变异系数(CV)为1.09%,也说明模型的置信度较高,模型方程能够很好的反映真实试验值,利用该回归方程可以确定水热法提取金银花中绿原酸的最佳工艺条件。
以拟合的目标函数为数学模型,绘制因变量的曲面和等高线图,见图5。
等高线图表示提取时间、提取温度、液料比这3个因素中任意一个变量取零水平时,其余两个变量对绿原酸提取率的影响。从图中可以看出提取温度对绿原酸提取率影响最显著,表现为曲线比较陡峭,提取时间和液料比次之,表现为曲线较平滑。应用Design Expert 8.0.5软件求导,可得水热法的最佳提取条件为:提取时间20 min,提取温度为120℃,液料比为20∶1(mL/g),在此条件条件下,绿原酸得率的预测值为3.69%。

图5 提取温度、提取时间和液料比交互作用对绿原酸得率的响应面及等高线Fig.5 Response surfaces plots and contour line of effects of interactions between extraction temperature,extraction time and liquid-solid ratio on yield of CA
3.5 验证试验
根据最佳提取条件,平行提取3份,将结果与二项式拟合方程的预测值进行比较。计算偏差:偏差=(预测值-实测值)/预测值×100%,结果如表4所示。

表4 验证试验结果Table 4 Results of verification test
从表中可以看出,优选的水热法提取工艺稳定,重现性好,预测值与真实值的偏差较小,说明利用响应面法优化得到的绿原酸水热法提取工艺条件可信。同时将水热法与《中国药典》中采用的超声波法进行了对比,超声法的得率分别为3.29%、3.21%和3.24%,平均得率为3.25%,水热法得率明显高于超声法,且所用的溶剂价廉、安全环保。
4 结论
本研究将水热法应用于绿原酸的提取,是一种新的探索。相对于有机溶剂提取,水是一种绿色环保而又价廉的提取溶剂,通过调控提取温度使水处于亚临界状态,有效的降低了水的极性和黏度,促进了目标物的溶出速度,提高了提取效率。同时,采用Box-Behnken试验设计对水热法提取工艺进行了优化,通过探讨液料比、提取温度以及提取时间对绿原酸得率的影响,发现提取温度对绿原酸得率的影响最大,其次是液料比,提取时间影响最小。水热法提取绿原酸的最佳工艺参数为:提取时间20 min,提取温度120℃,液料比20∶1(mL/g),在此条件下,绿原酸的得率为3.60%与预测值3.69%基本相符,表明利用响应面法优化得到的水热法提取工艺具有良好的可行性。与超声提取工艺相比,水热法具有省时、高效、环保等优点。该提取方法的建立为绿原酸的提取以及金银花的开发、利用提供了参考,同时为植物中活性物质的提取提出了一种新方法。
[1]高锦明,张鞍灵,张康健,等.绿原酸分布、提取与生物活性研究[J].西北林学院学报,1999,14(2):73-82
[2]周斌,高文远,张铁军,等.甲壳素及其衍生物在中药制药中的应用和前景[J].中国中药杂志,2005,30(17):1313-1314
[3]张鞍灵,马琼,高锦明,等.绿原酸及其类似物与生物活性[J].中草药,2001,32(2):173-176
[4]山永凯.枸杞中绿原酸的提取工艺研究[J].食品与机械,2012,28(5):127-130
[5]肖卓炳,郭瑞轲,郭满满,等.金银花中绿原酸超声微波双辅助提取工艺优化[J].食品科学,2012,33(22):111-114
[6]Rohit Upadhyay,K Ramalakshmi L,Jagan Mohan Rao.Microwaveassisted extraction of chologenic acid from green coffee beans[J].Food Chemistry,2012,130:184-188
[7]杨彬,罗磊,朱文学,等.金银花绿原酸和木犀草苷的提取[J].食品与发酵工业,2015,41(3):225-232
[8]Zhang Bin,Yang Rui-Yuan,Liu Chun-Zhao.Microwave-assisted extraction of chlorogenic acid from flower buds of Lonicrea japonica thunb[J].Separation and Purification Technology,2008,62:480-483
[9]李继睿,禹练英,杨孝辉,等.超临界流体萃取野菊花中绿原酸工艺研究[J].食品研究与开发,2012,33(9):30-32
[10]Pashp Pal Singh,Marleny D.A.Saldana.Subcritical water extraction of phenolic compounds from potato peel[J].Food Research Interna-tional,2011,44:2452-2458
[11]李新莹,刘兴利,冯豫川,等.亚临界水萃取在天然产物有效成分提取中的研究新进展[J].食品工业科技,2012(23):414-418
[12]施尔畏,夏长泰,王步国,等.水热法的应用与发展[J].无机材料学报,1996,11(2):193-206
[13]武萱蓉,杨巧珍,赵永祥,等.ZnS微球的水热/溶剂热法合成及其光催化性能研究[J].无机材料学报,2016(5):473-478
[14]徐丽红,阚彩侠,王长顺,等.聚乙烯吡咯烷酮辅助的水热法合成形貌可控的银纳米结构[J].物理化学学报,2014(3):569-575
[15]李振艳,张永忠,赵辛,等.亚临界水法提取萌发大豆中的异黄酮[J].中国油脂,2010,35(3):63-66
[16]周丽,张博雅,张永忠.亚临界水提取葛根中总异黄酮的研究[J].中草药,2012,43(3):492-495
[17]叶陈丽,贺帅,曹伟灵,等.中药提取分离新技术的研究进展[J].中草药,2015,46(3):457-464
[18]林建原,季丽红.响应面优化银杏叶中黄酮的提取工艺[J].中国食品学报,2013,13(2):83-90

