川西高寒土壤酶的动力学及热力学特征研究①
沈丹杰,陈玥希,孙 辉,姚 建
(四川大学建筑与环境学院,成都 610065)
土壤酶作为土壤物质的生物地化循环过程最为重要的参与者,不仅参与土壤物质转化与矿化等生态与生物化学过程,同时也对土壤中的外源物质转化及维持土壤正常生态功能具有重要作用。因此,土壤酶在土壤生物地化循环、土壤生态和土壤环境方面具有至关重要的地位[1]。酶按照功能可分为氧化还原酶类、转移酶类、水解酶类、裂合酶类、异构酶类和连接酶类等6类,主要作为胞外酶形式存在的土壤酶主要涉及前4类[2]。土壤酶中,磷酸酯酶参与土壤中磷酸酯类物质水解酶促反应,与有机磷酸酯类的矿化与转化密切相关,与土壤有效磷显著相关;纤维二糖水解酶和 β-葡萄糖苷酶属于纤维素酶系,纤维二糖水解酶作用于纤维素线状分子非还原末端的β-1,4糖苷键,形成纤维二糖,β-葡萄糖苷酶水解纤维二糖生成葡萄糖,这两种酶对土壤有机碳的转换过程至关重要,特别是土壤有机质中最重要的碳水化合物纤维素的水解过程;β-N-乙酰氨基葡萄糖酶参与几丁质转化氨基糖的过程,与土壤中有机氮相关组分转化与矿化密切相关[3-8]。
土壤酶传统的定量分析方法费时费力,重现性较差,以荧光物质标记底物的微孔板荧光法测定土壤酶活性的方法近年来逐渐发展起来[9-10],被越来越多的土壤酶相关研究工作所采用[11-12]。微孔板荧光法的优点在于可同时对多样本的酶活性进行快速分析,获得足够的重复测量数据,测定时间短而且实验条件相对稳定一致,可有效减小系统误差[13]。本文对微孔板荧光法测定酶活性的条件进行了一些改进,在此基础上测定了高山树线土壤几种酶的动力学与热力学特征。高山树线交错带被认为是对环境变化敏感的高寒生态系统之一,研究这些酶动力学与热力学特征,对揭示全球变暖背景下高寒土壤生化过程及变化具有重要意义。
1 材料与方法
试验采用微孔板荧光法测定土壤磷酸单酯酶(Phosphomonoesterase,EC3.1.3.2,PME)、β-葡萄糖苷酶(β-glucosidase,EC 3.2.1.21,BG)、β-N-乙酰氨基葡萄糖酶(β-N-Acetyl-glucosaminidase,EC 3.2.1.52,NAG)、纤维二糖水解酶(Cellobiohydrolase,EC 3.2.1.91,CBH)的活性,所用底物分别为4-甲基伞形酮-磷酸酯(MUF-P)、4-甲基伞形酮-β-D-葡萄糖苷(MUF-G)、4-甲基伞形酮-N-乙酰氨基-β-D-葡萄糖苷(MUF-NAG)和4-甲基伞形酮-纤维二糖苷 (MUF-C)。当土壤酶作用于相应底物时,荧光物质 4-甲基伞形酮(MUF)释放出来,通过多功能读数仪测定溶液荧光值,根据标准曲线计算得到相应酶的活性与反应速率。反应方程如下所示。
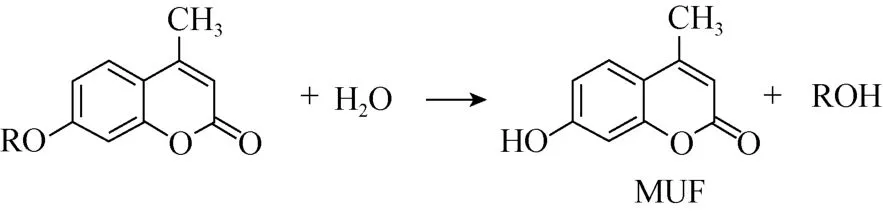
1.1 试验材料
1.1.1 土壤样品采集 土壤样品采集于四川阿坝藏族羌族自治州小金县梦笔山海拔4 018 m的树线交错带(31°42′15.7″N,102°19′18.7″E),采样时间为2016年6月中旬。每个样品取3个重复,采集深度为 0~10 cm。用采样铲采集5个点的土壤样品,混合均匀,各收集约 200g。土壤样品采回后自然风干,除去土壤里面的砂石、根系、植物残体等,研磨并过筛,密闭保存。
1.1.2 实验仪器 加液用八道移液器(Multichannel pipette,0~250 μl);微孔板采用通用的黑色固体聚苯乙烯微孔板(Black solid polystyrene microplate,96- well,360-μl well capacity);样品培养采用恒温培养箱;荧光值测定采用全波长扫描式多功能读数仪(仪器型号Varionskan Flash,美国Thermo)。
1.2 试验方法
1.2.1 土壤悬浊液的制备 将准确称量的 1 g土壤置入150 ml容积烧杯中,加入120 ml去离子水。并且使用搅拌子搅拌30 min使其混合均匀。每个样品均需制备出两份土壤悬浊液作为平行样,分别标记为土壤溶液1和土壤溶液2。
1.2.2 土壤溶液荧光值测定及荧光物质标准曲线 土壤酶活性的测定时,采用改性通用缓冲液(modified universal buffer,MUB)保证反应溶液pH的持续稳定。每个土壤样品做3个平行,每个平行测定4个重复值,测定的激发和发射波长分别为365 nm和450 nm。土壤酶活性用每小时每克土壤样品的底物MUF (μmol) 转化率表示。将土壤溶液置于不同浓度(0、0.04、0.08、0.12、0.16、0.20、0.24、0.28 mmol/L)的底物溶液中,于20 ℃ 恒温条件下准确培养10 min,而后加入NaOH终止反应并立即测定微孔板的荧光值,即可测得土壤酶的
动力学参数。向土壤溶液中加入相同浓度的底物溶液,分别置于0、5、10、15、20、25、30 ℃的恒温培养箱中培养 6 h,培养后向微孔板中加入NaOH终止反应并立即测定微孔板的荧光值,即可测得土壤酶的热力学数据。标准溶液采用 4-甲基伞形酮(4-methylumbelliferone)配置,溶液中标准物质的浓度梯度为 0、5、10、20、30和 50 μmo/L。每一种土壤均需单独测定其标准曲线,因为不同土壤颗粒对荧光物质的抑制作用是不同的。土壤干扰下的标准曲线以及空白样(底物的自动水解)均做2个平行,每个平行测定4个重复值。
1.3 数据处理
1.3.1 土壤酶动力学 在酶促反应中,当反应体系的温度、pH和酶浓度恒定时,反应初速度(v)随底物浓度([S])的增加而加速,最后达到最大反应速度(V)。根据Michaelis-Menten方程式,以1/v对1/[S]作图,即可得到不同酶促反应的各项动力学参数。

式中:Km为米氏常数。
1.3.2 土壤酶热力学 土壤呼吸的温度敏感性用Q10来表示,即理论上温度每增加 10 ℃ 土壤呼吸所增加倍数[14]。根据von't Hoff 规则,土壤酶温度效应以两个温度下酶促反应的速度常数之比表示,不过土壤敏感性指标在此基础上多有修改[15]。本文采用以下修正式计算Q10:

式中:Q10为土壤酶的温度敏感性指数;R1、R2分别为T1、T2温度下土壤酶的潜在活性值。
2 结果与分析
2.1 土壤酶的动力学特征
2.1.1 反应初速率v0微孔板中各种物质的加入量以及各种酶的反应初始速率见表1。由表中可以看出,在土壤酶浓度相同时,土壤酶促反应初速率v0随着MUF底物浓度的增加而增加。同时,初速率稳定性受到底物浓度影响,当底物浓度为0.04 mmol/L时,土壤磷酸单酯酶(PME)的波动量为54.33%,β-葡萄糖苷酶(BG)的波动量为 61.00%;当底物浓度为 0.16 mmol/L时,PME、BG波动量分别为11.39%、1.65%;而底物浓度达到0.28 mmol/L时,4种酶的波动量分别为 9.00%、1.37%、7.80%、21.57%。因此,底物浓度越小,反应初速度波动愈大;随着底物浓度增大,v0变化幅度呈降低趋势,即酶促反应初速率稳定性增加。
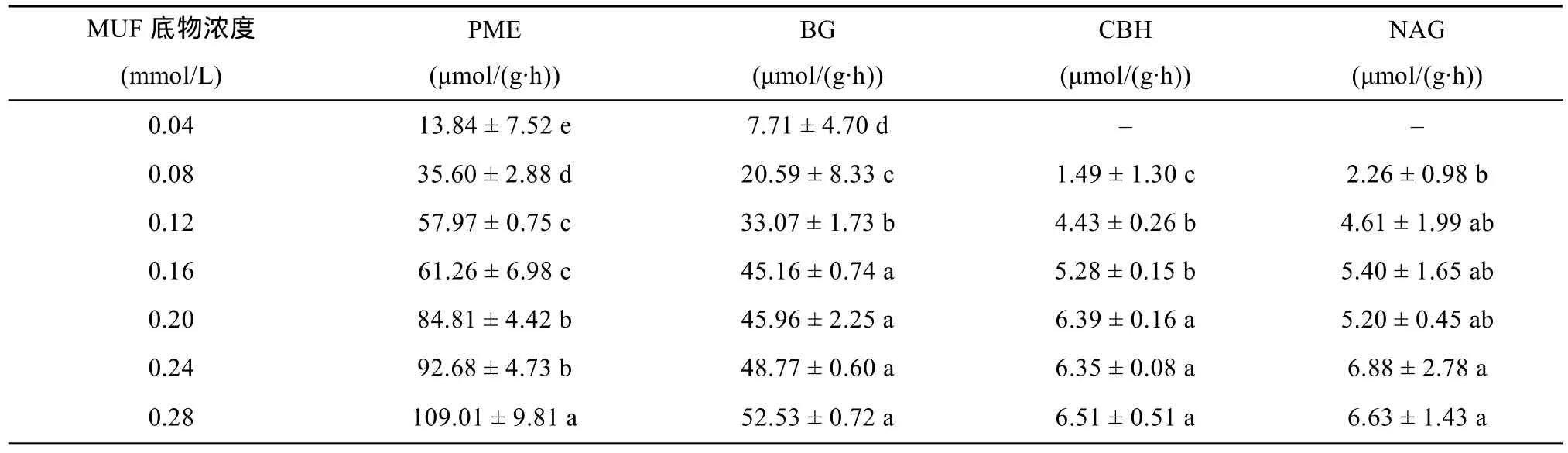
表1 川西高寒表层土壤(0~10 cm)4种酶促反应的初速度(v0)Table 1 Initial velocities (v0) of four enzymatic reaction of alpine topsoil (0-10 cm) in western Sichuan
2.1.2 酶促反应动力学参数 土壤酶动力学参数不但表明土壤酶含量的高低,且反映酶与底物结合的紧密程度及其作用过程,对探索土壤酶存在状态以及各种因素对酶催化反应不同阶段的影响有重要意义。应用Michaelies方程对PME、BG、CBH、NAG这4种酶动力学参数进行拟合,所得米氏常数Km、最大反应速率V参数见表2。
最大反应速率V可以反映出土壤中该酶的酶-基质复合体分解形成产物的速度,由表2可以看出,高寒土壤中4种酶最大反应速率为PME>BG>NAG>CBH。米氏常数Km表示酶对底物的亲和力大小,Km值越大亲和力越小,即酶与底物结合形成酶-基质复合体越困难,结果显示这4种酶与底物结合的亲和力大小为 CBH>BG>NAG>PME。V/Km反映了酶促反应初始速率,该值越大酶与底物结合形成酶-基质复合体和酶-基质复合体分解形成产物的总反应速率越快,酶的催化效率越高,本研究中这4种酶的催化效率为PME>BG>CBH>NAG。

表2 川西高寒表层土壤(0~10 cm)4种酶的动力学参数Table 2 Kinetic parameters of PME, BG, CBH and NAG of alpine topsoil (0-10 cm) in western Sichuan
在土壤溶液酶促反应体系中,土壤胶体对底物有一定的吸附能力,从而使酶促反应更容易进行。但米氏方程计算土壤酶的动力学参数时,没有考虑到土壤颗粒的吸附性,因此得到的Km值可能略大于真实值。
2.2 土壤酶热力学特征
2.2.1 土壤酶活性的温度效应 不同土壤酶的温度效应趋势见图1。数据表明,在0~25 ℃的温度范围内,PME、BG、CBH的活性随温度的升高而增加;在25~35 ℃的温度范围内,这3种酶的活性均保持在较稳定的范围内。NAG在0~35 ℃区间内,活性随温度升高而持续上升。
2.2.2 土壤酶活性的温度敏感性 不同温度下土壤酶活性敏感性指标Q10见表3。在0~35 ℃ 范围内,4种酶对温度的敏感性为:CBH>NAG>BG>PME。从表中看出,在10~20 ℃ 范围内PME、BG、CBH、NAG的Q10均达到最大值,分别为3.25、3.80、10.22和6.31。结果表明,随着土壤温度的上升,土壤酶的温度敏感性是先升高后降低,在 10 ~20 ℃达到最大值。在高温区间(20~35 ℃),4种酶的温度敏感性较低温区间(0~20 ℃)有显著降低。

图1 不同温度下川西高寒表层土壤(0~10 cm)的酶活性变化趋势Fig. 1 Changes in enzyme activities of alpine topsoil (0-10 cm) with temperature in western Sichuan

表3 川西高寒表层土壤(0~10 cm)中4种酶在不同温度段的Q10值Table 3 Q10 values of four enzymes of alpine soil (0-10 cm) in different temperature intervals in western Sichuan
3 讨论
3.1 酶的动力学特征
本文以 4-甲基伞形酮衍生物为底物测量了磷酸单酯酶(PME)、β-葡萄糖苷酶(BG)、纤维二糖水解酶(CBH)和 β-N-乙酰氨基葡萄糖酶(NAG)的动力学参数,结果与Stemmer[16]以及Parham和Deng[17]的结果范围一致。与已报道文献的平均值相比,本文 PME和BG的Km偏小,而NAG的Km偏大。这可能是由于在以土壤为代表的非均相系中,Km值受到酶构象的改变、酶活性位点对底物或抑制物的可接近性、产物与底物的扩散效应和微环境效应等多项因素的影响。
在酶活性测量的过程中,底物的选择会对结果的准确性造成影响。国际上没有规定土壤酶测定的标准化底物,目前较为常用的示踪底物主要为对硝基酚(p-Nitrophenyl, pNP)类衍生物和甲基伞形酮(MUF)类衍生物两大类。对硝基酚测量方法的研究起源较早,早在 1969年就有文献报道利用对硝基苯磷酸盐(p-nitrophenyl phosphate)测量土壤磷酸酶的活性[18]。由于对硝基酚类衍生物的种类丰富,目前已广泛用于水解酶和酯酶的研究[17,19-22],不过对硝基酚易被土壤胶体吸附,土壤颗粒本身带有的颜色也会影响测定结果,并且该方法灵敏度较低,不能用于低活性土壤酶的测定[23]。同时,对硝基酚衍生物在土壤溶液中的扩散性不如4-甲基伞形酮衍生物[10],故以4-甲基伞形酮衍生物为底物的测定会导致Km值偏小。以 4-甲基伞形酮为底物的荧光法,凭借其高灵敏性、高准确度和受土壤颗粒颜色影响小的特点,在测量酶活性的研究中发展迅速。但无论是哪种方法,都不能忽略土壤对底物的吸附作用,而土壤对底物的吸附作用往往很难测定与计算。因此,研究中往往选择稀释倍数高的土壤溶液测量酶活性,以忽略土壤对底物的吸附作用。Marx等[10]和 Stemmer[16]也选择 MUF作为底物测量多种酶的活性,但本文PME和BG的Km值均比相关文献低。原因可能在于本研究是将1 g土壤稀释成120 ml的土壤溶液作为酶测定的背景溶液,Marx等是将1 g土壤稀释成100 ml的土壤溶液,而Stemmer则仅将0.5 g的土壤稀释成2 ml的土壤溶液,本研究中的土壤溶液稀释度较大导致土壤对底物的吸附作用减弱,短时间内MUF底物扩散不良,从而引起相应酶的Km值降低。
3.2 土壤酶的温度敏感性
土壤溶液的培养时间和培养温度均会对酶的温度敏感性的测定结果产生影响。培养温度对酶活性的影响最为直接,就PME而言,Q10在10~20 ℃ 时大约为3.25,即培养过程1 ℃ 的温差将导致结果出现 22.5% 的变异。因此,要获得准确结果就需要精确地控制培养温度。
由图2可以看出,研究区域春夏日均温为0~13 ℃,其中昼间的土壤温度大多在10~20℃,少数时间段会升至20 ℃以上,但持续时间都较短,春夏夜间仅0 ~9 ℃;秋季均温在 0~5 ℃;而冬季均温大多在 0 ℃ 以下。因为这4种土壤酶在10~20 ℃的温度敏感性最高,故该温度区间的酶活性变化能最大程度反映全球变暖对该区域酶活性的影响。有研究表明,青藏高原地区未来的升温幅度约0.6℃/10a,这一结果与ICPP在2013年发布的第五次报告中的 PCR8.5情景大体一致。高山地区的温度变化往往伴随着光照、水分等多种环境因子的变化,其实质是通过改变山地区域小气候、土壤理化特征等环境系统,对土壤微生物生物量、群落结构以及土壤酶活性造成影响[24-25]。研究区域土壤0~10 cm深度的日均温在10 ℃以下,未来可预见升温情形下,高寒土壤表层均温也在20 ℃以内,因此本文对未来50 a升温条件下表层土壤酶活性及增幅进行了预测,结果如图3所示。
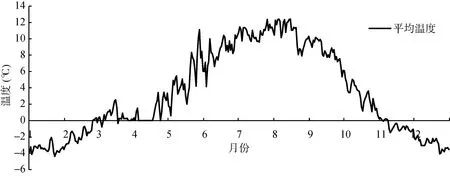
图2 研究区域土壤表层(0~10 cm)年均温度(2011—2015)Fig. 2 Changes of daily average temperature of topsoil(0-10 cm) in study area from 2011 to 2015
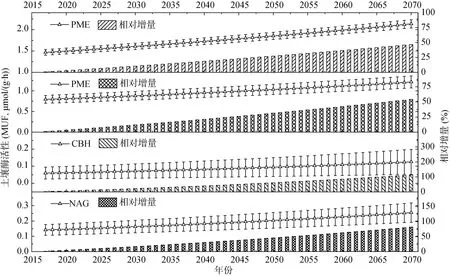
图3 预期升温情形下(2017—2070)川西高寒土壤表层的酶活性及增加幅度Fig. 3 Estimated activities of four enzymes of alpine topsoil(0-10 cm) from 2017 to 2070 under soil warming scenariosin western Sichuan
按照 0.6℃/10a的增温幅度计算,到 2070年PME、BG、CBH和NAG的春夏昼间酶活性将增加约 0.678、0.427、0.066 和 0.114 μmol/(g·h),增幅达到46.50%,54.12%,112.35% 和81.64%,这期间春夏夜间以及秋季昼夜 4种酶的活性增加约 0.177、0.102、0.018 和 0.064 μmol/(g·h)。因此,持续升温可能会对高寒土壤相关生化过程产生明显影响,特别是在春夏季节影响更为显著。
4 结论
1) 在动力学方面,磷酸单酯酶(PME)和 β-葡萄糖苷酶(BG)的活性及催化效率均显著大于纤维二糖水解酶(CBH)和β-N-乙酰氨基葡萄糖酶(NAG),有机磷循环比有机碳、氮循环活跃。在底物浓度为0~0.28 mmol/L时,高寒土壤PME,BG,CBH,NAG 4种酶的活性随着底物浓度的增加而上升。酶对底物的亲和力(Km)和初始反应速度(Km/Vm)共同决定着酶促的反应速率和酶对底物的催化效率。
2) 在热力学方面,亚高山森林土壤酶的温度敏感性在高温区间反而较低。高寒土壤 PME,BG,CBH,NAG 4种酶的活性随着温度升高呈现出两种变化趋势,即持续增长型(NAG)和先升高后稳定型(PME、BG、CBH)。温度变化时,土壤酶的温度敏感性先升高后降低,在10~20 ℃ 时达到最高。川西高寒土壤4种酶在低温区间(0~20 ℃)具有较高的温度敏感性。
因此,川西高寒土壤酶在低温阶段对气温变暖响应敏感,高寒土壤升温会引起相关酶参与的土壤生态与生化过程的急剧变化,这对揭示增温背景下高寒土壤生态系统生物地化循环的效应特征具有重要理论意义。
[1] 孙波, 赵其国. 土壤质量与持续环境:Ⅲ.土壤质量评价的生物学指标[J]. 土壤, 1997, 29(5): 225-234
[2] 曹慧, 孙辉, 杨浩, 等. 土壤酶活性及其对土壤质量的指示研究进展[J]. 应用与环境生物学报, 2003, 9(1):105-109
[3] Taylor J P, Wilson B, Mills M S, et al. Comparison of microbial numbers and enzymatic activities in surface soils and subsoils using various techniques[J]. Soil Biology &Biochemistry, 2002, 34(3): 387-401
[4] 鱼海霞, 何忠俊, 洪常青. 玉龙雪山土壤酶活性特征及其与土壤养分的关系[J]. 云南农业大学学报:自然科学,2013, 28(5): 668-675
[5] 尤彩霞, 陈清, 任华中,等. 不同有机肥及有机无机配施对日光温室黄瓜土壤酶活性的影响[J]. 土壤学报, 2006,43(3): 521-523
[6] 边雪廉, 岳中辉, 焦浩,等. 土壤酶对土壤环境质量指示作用的研究进展[J]. 土壤, 2015, 47(4): 634-640
[7] Ilyina A V, Tatarinova N Y, Varlamov V P. The preparation of low-molecular-weight chitosan using chitinolyticcomplex from Streptomyces kurssanovii[J]. Process Biochemistry, 1999, 34(9): 875-878
[8] 耿玉清, 王冬梅. 土壤水解酶活性测定方法的研究进展[J]. 中国生态农业学报, 2012, 20(4): 387-394
[9] Sinsabaugh R L, Reynolds H, Long T M. Rapid assay for amidohydrolase (urease) activity in environmental samples[J]. Soil Biology & Biochemistry, 2001, 32(14):2095-2097
[10] Marx M C, Wood M, Jarvis S C. A microplate fluorimetric assay for the study of enzyme diversity in soils[J]. Soil Biology & Biochemistry, 2001, 33(12/13): 1633-1640
[11] 马延霞, 吴清平, 张菊梅, 等. 大肠菌群特异性检测荧光底物 MUGal的合成及应用[J]. 现代食品科技, 2014,30(8): 251-257
[12] Giacometti C, Cavani L, Baldoni G, et al. Microplate-scale fluorometric soil enzyme assays as tools to assess soil quality in a long-term agricultural field experiment[J].Applied Soil Ecology, 2014, 75(2): 80-85
[13] Dick R P. Methods of soil enzymology[M]. Msdison,Wisconsin: Soil Science Society of America, 2011
[14] 杨庆朋, 徐明, 刘洪升, 等. 土壤呼吸温度敏感性的影响因素和不确定性[J]. 生态学报, 2011, 31(8): 2301-2311
[15] 秦纪洪, 张文宣, 王琴, 等. 亚高山森林土壤酶活性的温度敏感性特征[J]. 土壤学报, 2013, 50(6): 1241-1245
[16] Stemmer M. Multiple-substrate enzyme assays: A useful approach for profiling enzyme activity in soils?[J]. Soil Biology & Biochemistry, 2004, 36(3): 519-527
[17] Parham J A, Deng S P. Detection, quantification and characterization of β-glucosaminidase activity in soil[J].Soil Biology & Biochemistry, 2000, 32(8/9): 1183-1190
[18] Tabatabai M A, BremnerJ M. Use of p-nitrophenyl phosphate for assay of soil phosphatase activity[J]. Soil Biology & Biochemistry, 1969, 1(4): 301-307
[19] Verchot LV, Borelli T. Application of para-nitrophenol(pNP) enzyme assays indegraded tropical soils[J]. Soil Biology & Biochemistry, 2005, 37(4): 625-633
[20] Rui X, Liang D. Responses of soil β-glucosidaseactivities to simulated increased precipitation in a semi-arid temperate grasslands[J].Polish Journal of Ecology, 2013,61(2): 401-404
[21] Stege P W, Messina G A, Bianchi G, et al. Determination of the β-glucosidase activity in different soils by pre capillary enzyme assay using capillary electrophoresis with laser-induced fluorescence detection[J]. Journal of Fluorescence, 2010, 20(2): 517-523
[22] Elsgaard L, Andersen G H, Eriksen J. Measurement of arylsulphatase activity in agricultural soils using a simplified assay[J]. Soil Biology & Biochemistry, 2002,34(1): 79-82
[23] Nannipieri P, Smalla K. Nucleic acids and proteins in soil[M]. Berlin Heidelberg: Springer Berlin Heidelberg,2006
[24] Fierer N, Mccain C M, Meir P, et al. Microbes do not follow the elevational diversity patterns of plants and animals[J]. Ecology, 2011, 92(4): 797-804
[25] 曹瑞, 吴福忠, 杨万勤, 等. 海拔对高山峡谷区土壤微生物生物量和酶活性的影响[J]. 应用生态学报, 2016,27(4): 1257-1264

