两种根际促生菌在不同氮磷条件下对油菜生长和养分吸收的影响①
王 丹,赵学强,郑春丽*,沈仁芳
(1 内蒙古科技大学生命科学与技术学院,内蒙古包头 014010;
2土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所),南京 210008)
我国是世界油菜主产国,油菜种植面积和总产量均居世界首位[1]。油菜是产油效率最高的油料作物之一,菜籽油占国产油料作物产油量的 57.2%,在食用油供给的地位举足轻重[2]。然而,目前我国食用油消费的 60% 以上依赖于进口[3],进一步推动油菜产业的发展对于提高我国食用油自给率和保障食用油供给安全具有重要战略意义。
油菜产业的发展离不开化肥,氮磷钾肥对提高油菜产量尤其重要。据分析,中国油菜施用氮肥增产量和增产率均值分别为1 044 kg/hm2和87.4%,磷肥增产量和增产率均值分别为634 kg/hm2和39.9%,钾肥增产量和增产率均值分别为420 kg/hm2和22.9%,总体表现为氮肥>磷肥>钾肥[4]。然而,油菜对化肥的利用率却很低。对长江流域油菜氮磷钾肥料利用率现状研究表明,氮肥、磷肥、钾肥的表观利用率分别为34.0%、17.4% 和 36.9%[5],所以施入土壤中的化肥仅有1/3左右被油菜当季吸收,而剩下的约2/3留在环境中。过量施用化肥会导致土壤酸化、土壤板结、水体富营养化、温室气体排放增加、农产品品质降低等一系列问题,这对于环境质量和农业可持续发展都构成了巨大威胁[6]。因此,提高油菜产量和化肥利用率是油菜产业可持续发展中面临的双重挑战。在这种状况下,我们需要寻求新的科学途径,以维持油菜产业的可持续发展。
微生物直接参与了植物获得养分和土壤养分循环两个过程,大量试验已证明土壤微生物在植物获得土壤养分方面发挥着重要作用[7]。根际是根系周围数毫米的微区域,是植物吸收养分的“门户”。根际促生菌(plant growth-promoting rhizobacteria,PGPR)是指一群定植于植物根际,能够促进植物生长的一类细菌代表。这类细菌包括的种类主要有芽孢杆菌属、假单胞菌属、固氮螺菌属、固氮菌、克雷白氏杆菌、农杆菌属、黄杆菌属、伯克氏菌属以及沙雷氏菌属等20 多个种属[7-9]。添加根际促生菌能够通过刺激根系生长、溶解土壤难溶性磷、固氮等一系列生理生化机制,来增强植物获得养分的能力。此外,PGPR也可通过分泌铁载体和产生抗生素等间接作用提高植物抗逆性[10],预防和控制作物病害,降低农药和化肥的施用量,被普遍认为是一种环境友好、经济有效的提高作物产量的方法[11-14]。
目前已从油菜根际土壤分离到一些根际促生菌,它们能够改善油菜生长并提高养分吸收[15-17]。许多研究也表明,通过接种外源根际促生菌,能够改善油菜生长,提高油菜养分吸收能力,降低化肥施用量[18-27]。上述这些研究大都将根际促生菌的促生机制归结为油菜吸收大量元素N、P、K能力的改善,而很少关注中微量元素。油菜是一种对微量元素十分敏感的作物类型,如缺硼会导致油菜“花而不实”,以及花青素含量的积累,显著影响油菜产量。除此之外,缺铁会阻碍油菜新叶叶绿素的形成,缺锌则对叶绿素a、类胡萝卜素产生一定影响[28]。另外,根际促生菌的效果取决于油菜体内养分状况,在不同的氮磷钾供应状况下,根际促生菌对油菜表现出不同的效果[29]。综合这些因素,本文研究了两种不同芽孢杆菌在不同氮磷供应条件下对油菜吸收大量元素和中微量元素的影响,以期阐明根际促生菌对油菜生长的影响及其机制,为提高油菜产量和肥料利用率提供理论依据。
1 材料与方法
1.1 试验材料
试验所用土壤为南京市横溪基地水稻土,农民种植方式为水稻-油菜轮作,土壤基本理化性质:pH 6.20,有机质9.94 g/kg,全氮1.50 g/kg,有效磷16.18 mg/kg,速效钾89.13 mg/kg。供试油菜品种为宁油16号,属半冬性甘蓝型油菜(Brassica napus)品种。氮肥为尿素,N 200 mg/kg干土;磷肥为过磷酸钙,P 100 mg/kg干土;钾肥为氯化钾,K 200 mg/kg干土。试验使用菌种为巨大芽孢杆菌(Bacillusmegaterium)和短小芽孢杆菌(Bacillus pumilus)。
1.2 试验方法
1.2.1 盆栽试验 试验在中国科学院南京土壤研究所温室进行,试验周期为2015年12月10日至2016年4月14日。试验用盆钵为直径12 cm、高度8 cm的聚乙烯塑料盆,每盆装土1.5 kg,定植5棵幼苗。土样在装盆前经风干磨细过筛,并经高温高压蒸汽灭菌,以消除土壤里面土著微生物的影响。设置氮磷均施、不施磷施氮、不施氮施磷3组施肥处理,每组施肥处理再分为不接种、接种巨大芽孢杆菌、接种短小芽孢杆菌3组菌剂处理。播种前肥料与土壤混合后装盆,所有试验处理均施用钾肥。将保存的菌种进行活化,然后接入液体LB培养基,在30 ℃ 和200 r/min进行摇床培养,测定菌液OD值大约为1时,将菌液在3 500 r/min下进行离心10 min,离心后的沉淀用双蒸水重悬。用移液枪吸取1 ml菌液打到土壤中每株幼苗的根部。每组试验重复3次。油菜生长期间,根据土壤湿度情况,适当浇水。
1.2.2 样品采集与测定方法 油菜植株收获后,经105 ℃杀青,70 ℃ 烘干称重,样品经磨样机粉碎后供分析养分含量。地上部样品经HNO3-HClO4消煮,用ICP-OES (Inductively Coupled Plasma-Optical Emission Spectrometer) (Thermo Scientific iCAP 7000)测定P、K、Ca、Mg、S、Cu、Zn、Fe、B等元素含量;植株全氮含量用凯氏定氮仪测定。按常规法测定土壤基本理化性状:土壤 pH 按水土比 2.5∶1.0,pH 计测定;采用重铬酸钾容量法测有机质;凯氏定氮法测土壤全氮;0.5 mol/L NaHCO3浸提-钼锑抗比色法测有效磷;1 mol/L NH4OAc 浸提-火焰光度法测速效钾。
1.3 数据处理
采用Excel和SPSS 20对数据进行处理和统计分析。
2 结果与分析
2.1 芽孢杆菌对油菜生长的影响
图1表明,不管是未接种处理还是两种菌剂处理,缺氮和缺磷两个处理地上部干重仅为氮磷均施的 1/5左右,表明油菜生长对氮磷缺乏非常敏感,但是缺氮和缺磷两个处理之间地上部干重差异不显著。在氮磷均施处理下,与未接种处理相比,接种巨大芽孢杆菌显著增加了油菜地上部干重,但是接种短小芽孢杆菌没有表现出效果,甚至有降低油菜地上部干重的趋势。在缺氮和缺磷两个处理下,两种菌剂处理和对照之间没有显著差异。这些结果表明,油菜对缺氮和缺磷非常敏感,巨大芽孢杆菌在氮磷供应的条件下具有促生效果,而短小芽孢杆菌在目前试验条件下没有效果。

图1 根际促生菌对油菜干重的影响Fig. 1 Effects of PGPRs on dry weights of rape
2.2 芽孢杆菌对油菜地上部大量元素含量的影响
表 1比较了在同一施肥处理下接种巨大芽孢杆菌和短小芽孢杆菌对油菜地上部N、P、K含量的影响。结果表明:①同一施肥处理下3种菌剂处理之间油菜地上部 N含量没有显著差异;②巨大芽孢杆菌处理油菜地上部 P含量显著高于未接种处理和短小芽孢杆菌处理,而未接种处理和短小芽孢杆菌处理之间没有显著差异;③与未接种处理相比,巨大芽孢杆菌仅在氮磷均施处理下增加了油茶地上部 K含量,而在缺氮和缺磷条件下对 K含量没有影响;相反,短小芽孢杆菌在缺氮和缺磷条件下降低了 K含量,而在氮磷均施处理下对K含量没有影响。
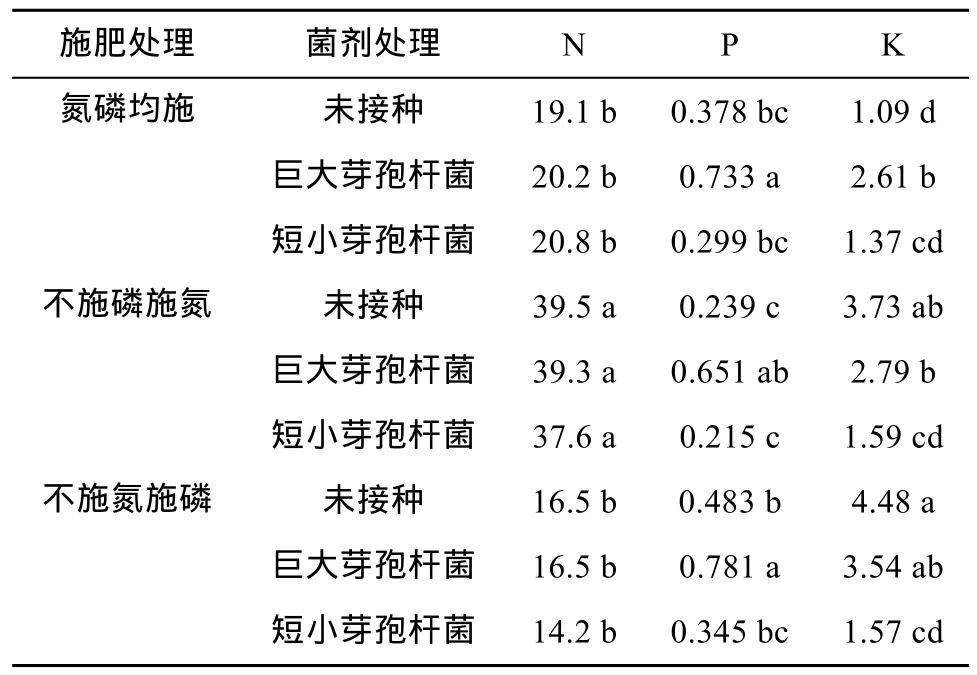
表1 根际促生菌对油菜地上部大量元素含量的影响(mg/g)Table 1 Effects of PGPRs on the contents of macroelements of rape shoots
2.3 芽孢杆菌对油菜地上部中量元素含量的影响
表 2比较了在同一施肥处理下接种巨大芽孢杆菌和短小芽孢杆菌对油菜地上部Ca、Mg、S含量的影响。结果表明:①在氮磷均施处理下,3种菌剂处理之间油菜地上部所有中量元素含量没有显著差异;②在缺磷处理下,与未接种处理相比,巨大芽孢杆菌增加了油菜地上部Ca和S含量,没有影响Mg含量;而短小芽孢杆菌对Ca、Mg、S含量均没有影响;③在缺氮处理下,与未接种处理相比,巨大芽孢杆菌和短小芽孢杆菌对油菜地上部Ca、Mg、S含量均没有影响。
2.4 芽孢杆菌对油菜地上部微量元素含量的影响
表 3比较了在同一施肥处理下接种巨大芽孢杆菌和短小芽孢杆菌对油菜地上部Cu、Zn、Fe、B含量的影响。结果表明:①在氮磷均施处理下,与未接种处理相比,巨大芽孢杆菌增加了油菜地上部Zn和B含量,没有影响Cu和Fe含量;而短小芽孢杆菌降低了Cu含量,对Zn、Fe、B含量没有影响;②在缺磷处理下,与未接种处理相比,巨大芽孢杆菌增加了油菜地上部Cu、Zn、Fe、B含量,而短小芽孢杆菌对这4种元素含量均没有影响;③在缺氮处理下,与未接种处理相比,仅巨大芽孢杆菌增加了油菜地上部B含量,对Cu、Zn、Fe含量没有影响,而短小芽孢杆菌对这4种元素含量均没有影响。
3 讨论
本文试验结果表明,不管是缺氮还是缺磷,油菜生物量仅为氮磷均施条件下的20%,表明油菜对缺氮和缺磷非常敏感。保证充足的氮磷供应是油菜高产稳产的必需条件,这与李慧等[4]根据我国油菜氮磷增产率调研结果得出的结论相一致。在研究中也注意到,相对于一些大田粮食作物水稻、小麦和玉米,油菜根系较小,而且不容易深扎,导致油菜根系从土壤中摄取养分的区域范围较小,所以必须增加土壤养分供应量,即增加根际区域养分浓度,才能保证油菜获得足够的养分,以维持其正常生长。油菜氮效率与根系形态、生理特性有着密切关系[30]。因此,改良油菜根系是提高油菜获得养分能力的一条有效途径。
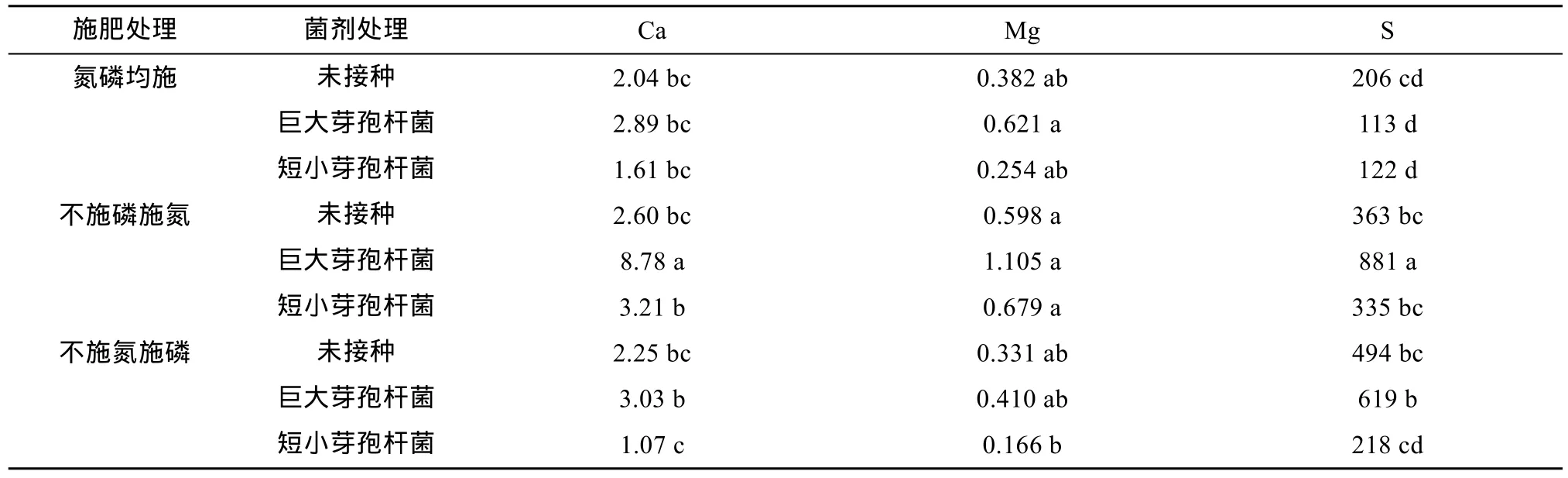
表2 根际促生菌对油菜地上部中量元素含量的影响(mg/g)Table 2 Effects of PGPRs on contents of secondary elements of rape shoots

表3 氮磷肥和根际促生菌对油菜微量元素含量的影响(μg/g)Table 3 Effects of PGPRs on contents of microelements of rape shoots
根际促生菌的作用机制大致可以概括为直接促进作用和间接促进作用。直接促进作用是微生物能够为植物提供一些合成复合物,或者促进根系从环境吸收养分。根际促生菌可以通过固氮为植物提供氮源;合成铁载体从土壤中溶解铁提供给植物细胞;合成一些激素刺激植物的生长发育;溶解土壤难溶态磷,提高磷的生物有效性;合成一些低分子化合物或酶,调节植物发育[31-33]。不同根际促生菌可能会利用以上机制的一种或几种来影响植物生长发育。间接促进作用是根际促生菌能减少或阻止病源性微生物,提高植物抗病性的主要原因,即生防作用。根际促生菌还可以调节改善根际土壤的微生物群落结构、生理代谢与功能,影响土壤养分的转化,间接影响植物生长[34]。可见,根际促生菌的作用机制多种多样,本文从养分吸收角度来解释根际促生菌的作用机制。植物公认的必需元素有 17种,除C、H、O可以通过光合作用来源于大气外,N、P、K、Ca、Mg、S、Fe、Mn、Cu、Zn、Mo、B、Cl、Ni等14种元素主要来源于土壤,被称为矿质营养元素。任何一种必需元素的缺乏都会限制植物的生长。
本文中,在氮磷适量供应条件下,巨大芽孢杆菌表现出了促生效果,而短小芽孢杆菌没有促生效果,甚至有轻微抑制效果。为了探究巨大芽孢杆菌和短小芽孢杆菌促生效果差异的可能机制,我们分析了油菜地上部 N、P、K、Ca、Mg、S、Fe、Cu、Zn、B 10种必需元素的含量。结果表明,在氮磷供应条件下,接种巨大芽孢杆菌增加了油菜地上部P、K、Zn和B含量,对其他元素含量没有影响,相反,接种短小芽孢杆菌对所有分析的元素含量都没有影响。根据这些结果,我们推测巨大芽孢杆菌的促生机制可能是巨大芽孢杆菌增加了油菜对P、K、Zn和B 4种营养元素的吸收。仅仅根据这些数据,还不能完全回答巨大芽孢杆菌促进油菜吸收P、K、Zn和B的确切机制,其机制可能是上述根际促生菌的直接促进和间接促进机制中的一种或几种,如增大根系、提高土壤养分有效性、改变土壤微生物群落结构等。虽然巨大芽孢杆菌和短小芽孢杆菌都属于芽孢杆菌属,但是每一种根际促生菌株都有其特定的生物学特性,对于植物的促生效果也不尽相同。例如,简单芽孢杆菌 JM170能提高苜蓿固氮酶活性、根系的溶磷量与 IAA 分泌的能力[35],而JX59只能增加燕麦根系的溶磷量,不具备提高固氮酶活性的能力[36]。土壤类型、环境条件、菌种类型和植物种类等因素都可能影响到根际促生菌作用的发挥[34]。
一些报道也表明根际促生菌能够促进油菜对N、P、K养分的吸收,而对于中微量营养元素的关注较少。例如,多黏芽孢杆菌(Paenibacillus polymyxa)提高了油菜的生物固氮能力[26];Bacillus edaphicus提高了油菜对 K的吸收[25];Pseudomonas fluorescens和Enterobacter radicincitans促进了油菜对P的吸收;Achromobacter增加了油菜对NO-3-N和K的运输[17];巨大芽孢杆菌增加了油菜N、P、K含量[18-20]。也有报道表明,虽然解磷菌促进了油菜生长,但是机制不是因为增加了 P吸收[23]。本文的研究结果表明,巨大芽孢杆菌主要促进了P、K、Zn和B 4种营养元素的吸收,而对于 N、Ca、Mg、S、Fe、Cu等元素的吸收促进效果较小。因此,不同根际促生菌在不同土壤上对油菜的促生机制不一样。
虽然在氮磷正常供应条件下,接种巨大芽孢杆菌增加了油菜地上部生物量,但是在缺氮或缺磷试验条件下,接种巨大芽孢杆菌没有表现出改善油菜生长的效果。元素分析结果表明,在缺氮或缺磷条件下,巨大芽孢杆菌也促进了一些元素的吸收,但是短小芽孢杆菌对所有测定元素没有表现出促进作用。我们推测,在缺氮或缺磷条件下,巨大芽孢杆菌没有促生效果的原因是土壤有效氮和有效磷含量远低于油菜生长的临界值,即使巨大芽孢杆菌在缺氮或缺磷条件下提高了一些元素的吸收,但是由于缺氮和缺磷是油菜生长的最主要限制因子,根际促生菌的作用也难以发挥。只有在缺氮和缺磷这两个限制因子消除后,即在正常氮磷供应条件下,巨大芽孢杆菌的促生效果才得以表现。
本文试验结果是在灭菌土培条件下获得的,这与实际条件相差较大,巨大芽孢杆菌在田间条件能否表现出促生效果仍不清楚。因此,将来需要进一步在田间条件下研究巨大芽孢杆菌对油菜生长和养分吸收的影响,以推动该菌种在农业上的应用。
4 结论
1) 油菜对缺氮和缺磷十分敏感,缺氮或缺磷下油菜地上部生物重仅为正常氮磷供应条件下的20%,氮磷肥对油菜生长至关重要;
2) 巨大芽孢杆菌仅在氮磷均施的条件下促进了油菜生长,而在缺氮或缺磷条件下没有表现出促生效果,其机制可能是巨大芽孢杆菌在氮磷均施条件下促进了油菜对P、K、Zn和B 4种营养元素的吸收;
3) 短小芽孢杆菌在缺氮、缺磷或正常氮磷条件下都没有表现出促生作用,对养分吸收也没有促进作用。
[1] 殷艳, 王汉中. 我国油菜生产现状及发展趋势[J]. 农业展望, 2011, 7(1): 43-45
[2] 刘秀秀, 鲁剑巍, 王寅, 等. 缺钾对油菜主序产量性状的影响及施钾效果[J]. 土壤, 2014, 46(5): 875-880
[3] 殷艳, 王汉中. 我国油菜产业发展成就、问题与科技对策[J]. 中国农业科技导报, 2012, 14(4): 1-7
[4] 李慧, 马常宝, 鲁剑巍, 等. 中国不同区域油菜氮磷钾肥增产效果[J]. 中国农业科学, 2013, 46(9): 1837-1847
[5] 邹娟, 鲁剑巍, 陈防, 等. 长江流域油菜氮磷钾肥料利用率现状研究[J]. 作物学报, 2011, 37(4): 729-734
[6] 黄国勤, 王兴祥, 钱海燕, 等. 施用化肥对农业生态环境的负面影响及对策[J]. 生态环境, 2004, 13(4):656-660
[7] 沈仁芳, 赵学强. 土壤微生物在植物获得养分中的作用[J]. 生态学报, 2015, 35(20): 6584-6591
[8] Gray E J, Smith D L. Intracellular and extracellular PGPR:Commonalities and distinctions in the plant-bacterium signaling processes[J]. Soil Biology and Biochemistry,2005, 37: 395-412
[9] Lee K J, Kamala-Kannan S, Sub H S, et al. Biological control of Phytophthora blight in red pepper (Capsicum annuumL.) using Bacillus subtilis[J]. World Journal of Microbiology and Biotechnology, 2008, 24: 1139-1145
[10] 丁琳琳, 刘五星, 孙剑英, 等. 产 ACC脱氨酶植物根际促生菌的筛选及其对修复植物高羊茅生长的影响[J]. 土壤, 2013, 45(2): 271-276
[11] 吴建峰, 林先贵. 土壤微生物在促进植物生长方面的作用[J]. 土壤, 2003, 35(1): 18-21
[12] Richardson A E, Barea J M, Mcneill A M, et al. Acquisition of phosphorus and nitrogen in the rhizosphere and plant growth promotion by microorganisms[J]. Plant and Soil, 2009, 321(1/2): 305-339
[13] 康贻军, 程洁, 梅丽娟, 等. 植物根际促生菌作用机制研究进展[J]. 应用生态学报, 2010, 21(1): 232-238
[14] 刘淑琮, 冯炘, 于洁. 植物根际促生菌的研究进展及其环境作用[J]. 湖北农业科学, 2009, 48(11): 2882-2887
[15] 崔松松, 白莉敏, 周可金, 等. 油菜亲和性根际菌株的筛选及其促生效果[J]. 西北农林科技大学学报(自然科学版), 2016, 44(1): 91-96
[16] 吴忠贤, 安莉, 傅培兴. 油菜促生菌的研究和应用——Ⅰ.菌种的分离和筛选[J]. 江西科学, 1991, 9(4): 219-224
[17] Bertrand H, Plassard C, Pinochet X, et al. Stimulation of the ionic transport system inBrassica napusby a plant growth-promoting rhizobacterium (Achromobactersp.)[J].Canadian Journal of Microbiology, 2000, 46(3): 229-236
[18] 胡小加, 余常兵, 李银水, 等. 生物肥料对油菜的促生及菌核病防治的研究[J]. 中国油料作物学报, 2009, 31(4):540-543
[19] 胡小加, 江木兰. 巨大芽胞杆菌( A6)在红黄壤中对油菜的促生作用[J]. 中国油料作物学报, 2003, 25(4): 105-106[20] 胡小加, 江木兰, 张银波. 巨大芽孢杆菌在油菜根部定殖和促生作用的研究[J]. 土壤学报, 2004, 41(6): 945-948
[21] Noel T C, Sheng C, Yost C K, et al. Rhizobium leguminosarum, as a plant growth-promoting rhizobacterium:Direct growth promotion of canola and lettuce[J]. Canadian Journal of Microbiology, 1996, 42(3): 279-283
[22] El-Howeity M A, Asfour M M. Response of some varieties of canola plant (Brassica napusL.) cultivated in a newly reclaimed desert to plant growth promoting rhizobacteria and mineral nitrogen fertilizer[J]. Annals of Agricultural Science, 2012, 57(2): 129-136
[23] Freitas J R D, Banerjee M R, Germida J J. Phosphatesolubilizing rhizobacteria enhance the growth and yield but not phosphorus uptake of canola (Brassica napusL.)[J].Biology and Fertility of Soils, 1997, 24(24): 358-364
[24] Krey T, Caus M, Baum C, et al. Interactive effects of plant growth-promoting rhizobacteria and organic fertilization on P nutrition ofZea maysL. andBrassica napusL.[J].Journal of Plant Nutrition and Soil Science, 2011, 174(4):602-613
[25] Sheng X F. Growth promotion and increased potassium uptake of cotton and rape by a potassium releasing strain ofBacillus edaphicus[J]. Soil Biology and Biochemistry,2005, 37(10): 1918-1922
[26] Puri A, Padda K P, Chanway C P. Evidence of nitrogen fixation and growth promotion in canola (Brassica napusL.) by an endophyticdiazotrophPaenibacillus polymyxa,P2b-2R[J]. Biology and Fertility of Soils, 2015, 52(1): 1-7
[27] Naseri R, Maleki A, Naserirad H, et al. Effect of plant growth promoting rhizobacteria (PGPR) on reduction nitrogen fertilizer application in rapeseed (Brassica napusL.)[J]. Middle East Journal of Scientific Research, 2013,14(2): 213-220
[28] 韩配配, 秦璐, 李银水, 等. 不同营养元素缺乏对甘蓝型油菜苗期生长和根系形态的影响[J]. 中国油料作物学报, 2016, 38(1): 88-97
[29] Belimov A A, Safronova V I, Mimura T. Response of spring rape (Brassica napusvar.oleiferaL.) to inoculation with plant growth promoting rhizobacteria containing 1-aminocyclopropane-1-carboxylate deaminase depends on nutrient status of the plant[J]. Canadian Journal of Microbiology, 2002, 48(3): 189-199
[30] 刘代平, 宋海星, 刘强, 等. 油菜根系形态和生理特性与其氮效率的关系[J]. 土壤, 2008, 40(5): 765-769
[31] Brown M E. Seed and root bacterization[J]. Annual Review of Phytopathology, 2003, 12(1): 181-197
[32] Kloepper J W, Lifshitz R, Schroth M N. Pseudomonas inoculants to benefit plant production[J]. ISI Atlas Science.Animal&Plant Science, 1988, 1: 60-64
[33] Kloepper J W, Ran L, Zablotowicz R M. Free-living bacterial inocula for enhancing crop productivity[J]. Trends in Biotechnology, 1989, 7(2): 39-43
[34] 刘丹丹, 李敏, 刘润进. 我国植物根围促生细菌研究进展[J]. 生态学杂志, 2016(3): 815-824
[35] 韩华雯, 孙丽娜, 姚拓, 等. 苜蓿根围有益菌接种剂对苜蓿生长特性影响的研究[J]. 草地学报, 2013, 21(2):354-359
[36] 冯瑞章, 姚拓, 周万海, 等. 溶磷菌对燕麦生物量及植株氮、磷含量的影响[J]. 水土保持学报, 2009, 23(2): 188-192

