稻田土壤真菌群落多样性和组成对麦秸还田的响应①
王 宁,于建光*,常志州,黄红英,顾克军,张振华
(1 江苏省农业科学院农业资源与环境研究所,南京 210014;2 江苏省农业科学院循环农业研究中心,南京 210014)
在长江中下游地区,长期形成的稻麦轮作种植模式在保障主要粮食供应上功不可没,可以预见该种植方式仍将长期存在;同时由于小麦收获后秸秆产生量大以及茬口时间短、季节紧,秸秆还田作为有效的秸秆处置措施仍被广泛采用。长期秸秆还田不仅能改善土壤结构,增加土壤养分和作物产量[1-5],而且对土壤微生物也有重要的影响[6]。然而由于传统的土壤微生物研究方法,如微生物平板培养法、变性梯度凝胶电泳(DGGE)等往往无法详细描述出土壤微生物的群落多样性和组成方面的信息[7-8],使得对于土壤微生物多样性的研究仍然匮乏,有关其演替规律及与环境因子的关系仍不明了[9]。
真菌是土壤微生物的重要组成部分,是土壤肥力和健康的重要指标之一,直接影响土壤物质循环、养分转化和作物病害发生等[10-14]。研究表明,真菌不仅能分解土壤中有机质为植物提供养分,而且还可以改善土壤结构并提高作物产量[11-13]。目前基于传统微生物学研究方法的研究显示,秸秆还田能够提高土壤真菌的Shannon-Weiner 多样性指数,促进微生物量的生长和土壤呼吸,并且改变微生物群落结构[15-18],然而由于土壤中大部分真菌很难分离培养,采用传统的土壤微生物研究方法难以有效揭示其功能与作用,近年来兴起的现代分子生物学技术如高通量测序技术等,为深入探究土壤真菌群落组成、功能及其适应机制提供了良好的契机[19-21],有助于阐述秸秆还田后真菌群落的响应规律。
本文拟利用Illumina测序技术,研究不同量小麦秸秆施用于两种类型稻田土壤后真菌群落的组成和多样性,旨在揭示稻田土壤真菌群落对秸秆还田的响应规律,并结合土壤性质进一步揭示土壤真菌群落迁移的驱动因子。
1 材料与方法
1.1 试验材料
通过文献检索和实地调研,选择了两种长期稻麦轮作田块作为典型土壤采样点,分别来自江苏省泰州市的高砂土(GS)和无锡市的黄泥土(HN)。采集土壤风干过2 mm筛,混合均匀后室温贮存备用。
供试秸秆是成熟收割后的小麦秸秆,来自于江苏省农业科学院小麦试验基地。小麦秸秆晒干后磨碎,过10目筛,贮存于4 ℃ 备用。
1.2 试验设计
试验设置4种处理,分别为不添加小麦秸秆即对照(CK)、施用10 g/kg小麦秸秆(WS10)、施用20 g/kg小麦秸秆(WS20)、施用50 g/kg小麦秸秆(WS50)。
称取400 g 土壤(干重)于广口瓶中(直径 10 cm ×高 15 cm),分别设置以上4种处理,其中小麦秸秆与土壤混合均匀,添加去离子水使其处于淹水状态,每个处理3次重复。将培养瓶置于25 ℃ 恒温培养箱,避光培养;在整个淹水培养期间,上覆水深度始终保持一致。培养30 d后,收集土壤孔隙水,用于溶解性有机碳(DOC)的测定;破坏性采样收集土壤样品,将土壤混合均匀,部分土壤风干后用于土壤pH、电导率、有机质、总碳和总氮的测定,部分鲜样保存于-20 ℃ 冰箱用于真菌群落结构分析。
1.3 分析方法
1.3.1 化学性质的测定 pH采用酸度计(pHs-3C型精密pH计,上海雷磁仪器厂)测定(土∶水 = 1∶5);电导率(EC)采用电导仪(DDSJ-318型电导率仪,上海雷磁仪器厂)测定;有机质(SOM)含量采用灼烧矢量法((550±5)℃, 6 h)测定;总碳(TC)与总氮(TN)含量采用元素分析仪(Vario MAX CNS, Elementar,Germany)测定,并计算碳氮比值(C/N);溶解性有机碳(DOC)含量采用有机碳分析仪(Shimadzu TOC-Vcph, Japan)测定。
1.3.2 土壤 DNA 提取及其真菌群落分析 根据FastDNA® Spin Kit for Soil试剂盒说明书提取土壤中DNA,储存于 -20 ℃ 备用。真菌PCR扩增采用具有 barcode的 18S rRNA 通用引物,ITS1F:5′-CTTGGTCATTTAGAGGAAGTAA-3′;ITS2R:5′-GCTGCGTTCTTCATCGATGC-3′。20 μl的扩增反应体系包括:10 ng模板 DNA、4 μl FastPfu Buffer(5×)、2 μl BSA(2.5 mmol/L)、0.8 μl ITS1F(5 μmol/L)、0.8 μl ITS2R(5 μmol/L)、18 μl灭菌水。每个样品包括 3 个重复体系。扩增条件如下:94 ℃预变性3 min;30个扩增循环,每个循环包括94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s;最后在72 ℃ 再延伸5 min。混合同一样品的4个PCR 产物重复样,切胶回收并纯化。将PCR产物用蓝色荧光定量系统进行检测定量,之后按照每个样本的测序量要求,进行相应比例的混合。所获得的DNA送到上海凌恩生物有限公司,用于Illumina Miseq测序。
1.4 数据分析
利用SPSS 23.0对不同处理下土壤性质进行方差分析;利用QIIME(1.7.0)软件计算真菌群落alpha多样性和beta多样性,其中真菌群落OTU种类用于表征 alpha多样性,在QIIME平台,根据样品两两间unweight UniFrac distance进行主成分分析(PCA)用于表征样品间真菌群落的相似性,即 beta多样性;利用R(vegan数据包)分析不同群落之间差异的显著性;利用R平台 vegan数据包作典范相关对应分析(canonical correlation analysis, CCA),鉴定影响真菌群落结构的主要影响因素。数据分析采用Excel进行,图形绘制采用SigmaPlot 10.0。
2 结果与分析
2.1 土壤理化性质
两种类型稻田土壤理化性质见表1。由表1可以看出,不同类型土壤理化性质存在较大差异。高砂土属砂质土,其土壤酸碱度(pH)、电导率(EC)、总碳(TC)和碳氮比(C/N)显著高于属于壤土的黄泥土,而黄泥土总氮(TN)和有机质(SOM)含量则显著高于高砂土。

表1 供试土壤基本理化性质Table 1 Basic properties of two tested paddy soils
不同量小麦秸秆(0、10、20 和50 g/kg)施用下,两种类型土壤理化性质的变化见表2。由表2可以看出,与未施用秸秆的土壤相比,随着秸秆还田量的增大,土壤pH逐渐降低,其中高砂土和黄泥土pH降低量分别由 4.37% 和 0.89% 逐渐增大到 6.14% 和5.47%。以上结果表明,秸秆还田显著降低了土壤酸碱度,并随着秸秆还田量的增加,土壤pH降低效应愈加显著。
与pH不同,秸秆还田后高砂土EC、SOM、TC、TN、C/N和DOC含量分别增加了77.3%~227%、94.1%~525%、28.2%~143.7%、9.09%~63.6%、10.8%~50.3% 和 235%~1357%(P<0.05);而秸秆还田后黄泥土EC、SOM、TC、TN、C/N和DOC含量分别增加了 219%~1780%、11.7%~89%、57.1% ~197%、6.74%~34.8%、48.0%~125% 和 42.4% ~930%(P<0.05),并且当秸秆还田量为50 g/kg时,上述土壤指标增加量最大。以上结果表明,秸秆还田显著提高了土壤电导率、有机质、总碳、总氮、碳氮比以及溶解性有机碳含量,并且随着秸秆还田量的增加其含量也逐渐增大。
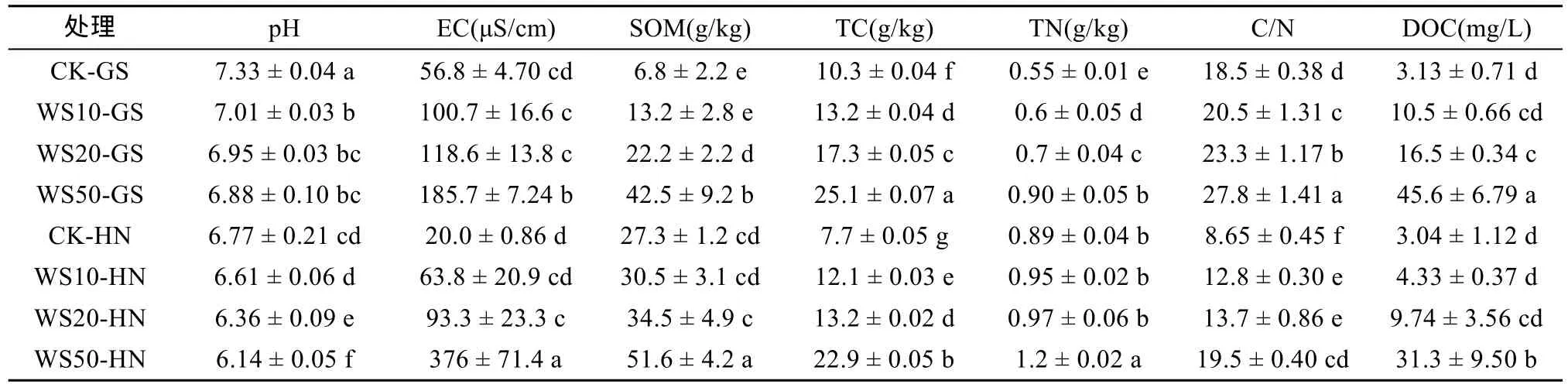
表2 淹水培养30 d后,不同量秸秆施用下土壤基本理化性质Table 2 Basic properties of soils under different straw return treatments after 30 days of flooding incubation
2.2 土壤真菌群落多样性
利用Illumina高通量测序技术,24个不同量秸秆施用的土壤样品按照 97% 相似性对非重复序列(不含单序列)进行 OTU聚类。图 1为当测序深度30 000时稻田土壤真菌群落OTUs数,即稀疏曲线。由图1可以看出,随着秸秆还田量的增加,高砂土真菌群落多样性逐渐降低,而黄泥土真菌群落多样性虽然有所降低但并无显著性变化。研究结果表明秸秆还田显著降低了高砂土真菌群落多样性(P< 0.05);但对黄泥土真菌群落多样性并无显著性影响(P>0.05)。
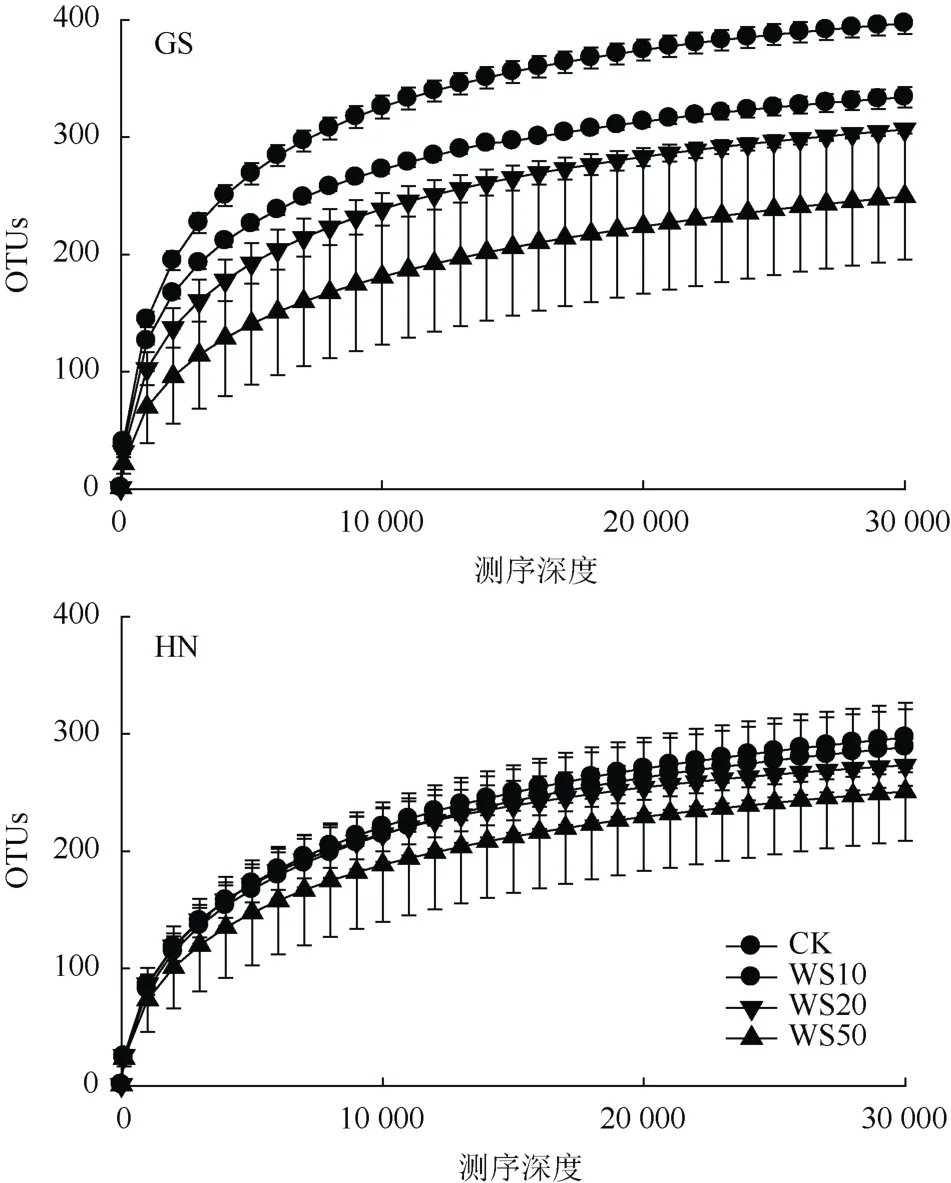
图1 不同量秸秆施用下两种类型稻田土壤真菌群落多样性(平均值±标准差,n = 3)Fig. 1 Fungal community diversities in soils under different straw return treatments
2.3 土壤真菌群落组成
利用 Illumina高通量测序技术,24个不同量秸秆施用的土壤样品的真菌群落组成分布见图2。由图2可以看出,未施用秸秆的高砂土在纲水平上的优势菌是散囊菌纲(Eurotiomycetes)和粪壳菌纲(Sordariomycetes),其相对丰度分别为34.3% 和33.3%;而未施用秸秆的黄泥土中粪壳菌纲为优势菌,相对丰度达80.4%。秸秆施用后高砂土中散囊菌纲的相对丰度显著降低,而粪壳菌纲的相对丰度显著提高(P< 0.05);对于黄泥土,秸秆施用对土壤优势菌散囊菌纲的相对丰度并无显著性影响,但当秸秆施用量为50 g/kg时,与未施用秸秆的黄泥土相比,黄泥土中粪壳菌纲的相对丰度显著降低(P< 0.05)。以上结果表明,不同类型稻田土壤中真菌群落的优势菌组成存在差异,而土壤真菌群落的优势菌对秸秆还田的响应也与土壤类型密切相关。
为了进一步探究秸秆还田对土壤中真菌群落组成的影响,对不同量秸秆还田下土壤中真菌群落组成进行了主成分分析(PCA)(图3)。由图3可以看出,不同量秸秆还田下,高砂土真菌群落组成明显不同,进一步的显著性差异分析发现,与未施用秸秆相比,秸秆施用显著改变了高砂土真菌群落结构,但不同量(10、20和50 g/kg)秸秆还田下,高砂土真菌群落组成并无显著性差异。与未施用秸秆相比,秸秆施用量为10和20 g/kg时并未改变黄泥土真菌群落结构,而当秸秆施用量为50 g/kg时黄泥土中真菌群落结构有着显著性迁移。以上研究结果表明,两种类型土壤真菌群落结构对不同量秸秆还田的响应显著不同。
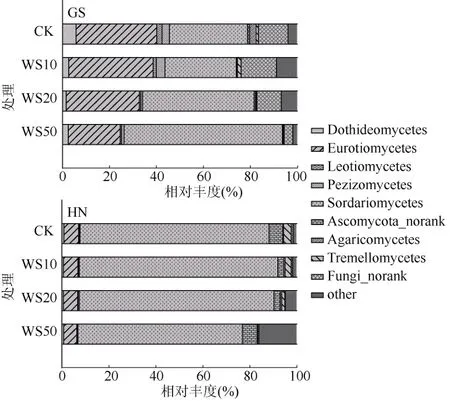
图2 不同量小麦秸秆施用下两种类型稻田土壤真菌群落组成Fig. 2 Compositions of fungal communities in soils under different straw return treatments
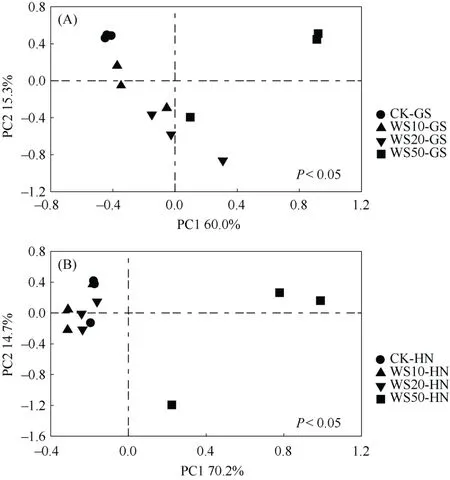
图 3 不同量秸秆施用下两种类型稻田土壤(A. 高砂土;B. 黄泥土)真菌群落组成的主成分分析Fig. 3 Principal component analysis (PCA) of compositions of fungal communities in soils under different straw return treatments
2.4 土壤性质对真菌群落结构的影响
为了进一步探究土壤中真菌群落迁移的主要驱动因子,本论文基于典范相关分析(CCA)对环境因子和土壤真菌群落结构的关系进行探讨,其中真菌属和环境因子之间夹角的余弦值代表了二者之间的相关性。由图4可以看出,在所用的环境因子(pH、EC、SOM、TC、TN、C/N、DOC)中,土壤 pH、EC 和SOM是影响秸秆还田后高砂土真菌群落迁移的重要因子,而pH、EC、SOM和C/N是影响秸秆还田后黄泥土真菌群落迁移的重要调控因子。其中,秸秆还田后土壤真菌群落的迁移与土壤pH呈明显的负相关性,而与SOM、EC和C/N呈现明显的正相关性。以上研究结果表明,秸秆还田主要是通过改变土壤性质来调控真菌群落组成。
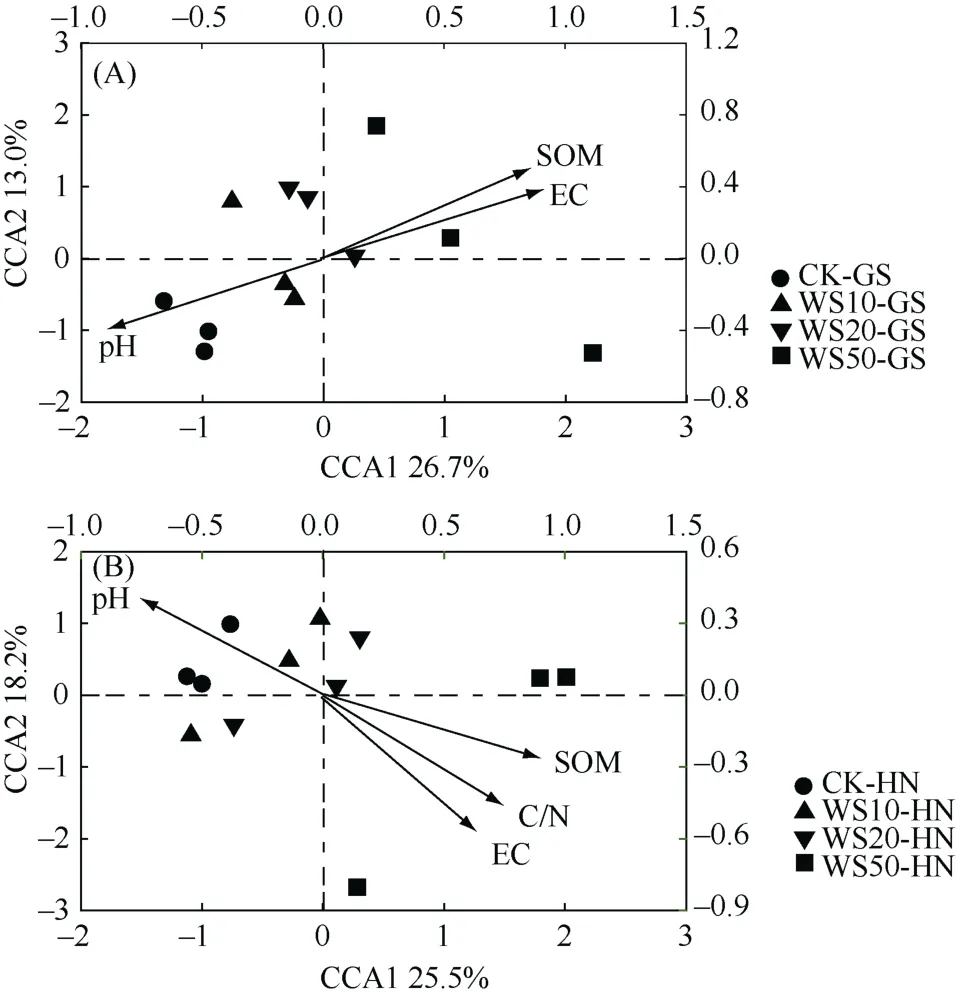
图4 不同量秸秆施用下两种类型稻田土壤(A. 高砂土;B. 黄泥土)真菌群落组成的典范相关分析Fig. 4 Canonical correlation analysis (CCA) of compositions of fungal communities in soils under different straw return treatments
3 讨论
真菌作为微生物的重要组成,推动着土壤有机质循环、养分转化、毒物降解和作物病害发生等,而真菌群落多样性是维持土壤生态系统正常功能的前提条件[10-14]。本研究发现,秸秆施用后两种类型土壤真菌群落多样性都一定程度地降低,这很可能主要是由于秸秆还田过程中能够促进有机质的矿化,从而消耗土壤中大量氧气,使土壤中微生物由好氧微生物逐渐以兼性厌氧微生物或厌氧微生物为主,而黄泥土属壤土,由于其通气性较差,淹水培养30 d后土壤中真菌很可能已经以兼性厌氧微生物或厌氧微生物为主,因此秸秆施用后黄泥土真菌群落多样性并未显著降低,而很可能只是改变了土壤中兼性厌氧微生物或厌氧微生物的丰度。总之,为了维持土壤真菌群落多样性,秸秆还田过程中可以采取一定措施(如干湿交替等)来适当增加土壤含氧量,尽可能避免土壤微生物多样性的降低。
大量研究显示土壤真菌群落结构受到许多环境因素的影响,其中土壤性质是调控土壤微生物群落结构的重要因子[22]。已有研究表明pH是引起微生物群落迁移的重要调控因子[23],我们研究发现秸秆施用显著降低了土壤酸碱度,这很可能是由于秸秆还田过程中会腐烂分解产生一些有机酸[24],进一步的 CCA分析发现pH显著改变了高砂土和黄泥土真菌群落组成。同时,由于秸秆中含有丰富的碳、氮、磷、钾等营养元素,秸秆还田可以将作物中的营养元素归还土壤,在一定程度上增加了土壤中碳氮等养分含量以及土壤电导率[25-27]。本研究中秸秆还田显著提高了土壤EC约0.78~17.8倍,从而有利于土壤微生物间电子传递,进而改变真菌群落结构。另外,碳素供应是决定土壤微生物生长的关键性因素,其中有机质(SOM)作为微生物的重要碳源,已经被发现是土壤真菌群落改变的重要因子[28]。
本研究中两种类型土壤真菌群落组成对不同量秸秆还田响应的差异很可能是由于不同类型土壤中微生物可利用的基质含量和种类各不相同所导致的。其中土壤 C/N已经被报道是影响微生物群落的重要因子[29],本研究中 C/N显著改变了黄泥土真菌群落组成而对高砂土群落组成的迁移并无显著性影响。这很可能是由于黄泥土自身 C/N较低不足以支持淹水期间土壤微生物的生长,而秸秆还田显著提高了土壤C/N,从而为微生物生长提供了基质,并且随着秸秆施用量的增大,土壤 C/N亦逐渐增大,因此与低秸秆施用量10 g/kg和20 g/kg相比,秸秆施用量为50 g/kg时显著改变了黄泥土微生物群落组成;然而对于高砂土,自身 C/N较高足以支持微生物的生长,因此不同量秸秆施用下高砂土真菌群落组成并无显著性差异。
4 结论
1)秸秆还田显著降低了高砂土真菌群落多样性,而对黄泥土真菌群落多样性并无显著影响。
2)秸秆还田显著改变了高砂土真菌群落组成,但不同秸秆还田量下,土壤真菌群落组成并无显著性差异;对于黄泥土,与未施用秸秆的土壤相比,秸秆施用量为10和20 g/kg时,黄泥土真菌群落组成并无显著改变,而当秸秆施用量为50 g/kg时黄泥土真菌群落组成有着明显迁移。
3)pH、SOM、EC是影响秸秆还田后高砂土真菌群落迁移的重要因子;与高砂土不同,pH、SOM、EC和C/N是影响秸秆还田后黄泥土真菌群落迁移的重要调控因子。
[1] Becker M, Asch F, Maskey S L, et al. Effects of transition season management on soil N dynamics and system N balances in rice-wheat rotations of Nepal. Field Crops Research, 2007, 103(2): 98-108
[2] 于建光, 李辉信, 陈小云, 等. 秸秆施用及蚯蚓活动对土壤活性有机碳的影响. 应用生态学报, 2007, 18(4):818-824
[3] 卢萍, 单玉华, 杨林章, 等. 秸秆还田对稻田土壤溶液中溶解性有机质的影响. 土壤学报, 2006, 43(5):736-741
[4] 劳秀荣, 孙伟红, 王真, 等. 秸秆还田与化肥配合施用对土壤肥力的影响. 土壤学报, 2003, 40(4): 618-623
[5] 王倩倩, 尧水红, 张斌, 等. 秸秆配施氮肥还田对水稻土酶活性的影响. 土壤, 2017, 49(1): 19-26
[6] 郭梨锦, 曹凑贵, 张枝盛, 等. 耕作方式和秸秆还田对稻田表层土壤微生物群落的短期影响. 农业环境科学学报, 2013, 32(8): 1577-1584
[7] Chen L, Zhang J, Zhao B, et al. Effects of straw amendment and moisture on microbial communities in Chinese fluvo-aquic soil. Journal of Soils & Sediments,2014, 14(11): 1829-1840
[8] Henriksen T M, Breland T A. Carbon mineralization,fungal and bacterial growth, and enzyme activities as affected by contact between crop residues and soil.Biology & Fertility of Soils, 2002, 35(1): 41-48
[9] Zhao F, Xu K. Efficiency of DNA extraction methods on the evaluation of soil microeukaryotic diversity. Acta Ecologica Sinica, 2012, 32(4): 209-214
[10] 王轶, 李季, 曹志平, 等. 长期施肥对农田土壤真菌的影响. 中国生态农业学报, 2014, 22(11): 1267-1273
[11] 陈丹梅, 袁玲, 黄建国, 等. 长期施肥对南方典型水稻土养分含量及真菌群落的影响. 作物学报, 2017, 43(2):286-295
[12] 张伟, 许俊杰, 张天宇. 土壤真菌研究进展. 菌物研究, 2005(3): 52-58
[13] 康振生. 我国植物真菌病害的研究现状及发展策略.植物保护, 2010, 36(3): 9-12
[14] Kennedy A C, Smith K L. Soil microbial diversity and the sustainability of agricultural soils. Plant and Soil, 1995,170: 75-86
[15] Chen L, Zhang J, Zhao B, et al. Effects of straw amendment and moisture on microbial communities in Chinese fluvo-aquic soil. Journal of Soils & Sediments,2014, 14(11): 1829-1840
[16] Henriksen T M, Breland T A. Carbon mineralization,fungal and bacterial growth, and enzyme activities as affected by contact between crop residues and soil.Biology & Fertility of Soils, 2002, 35(1): 41-48
[17] Tanaka H, Kyaw K M, Toyota K, et al. Influence of application of rice straw, farmyard manure, and municipal biowastes on nitrogen fixation, soil microbial biomass N,and mineral N in a model paddy microcosm[J]. Biology &Fertility of Soils, 2006, 42(6): 501-505
[18] 郭梨锦, 曹凑贵, 张枝盛, 等. 耕作方式和秸秆还田对稻田表层土壤微生物群落的短期影响. 农业环境科学学报, 2013, 32(8): 1577-1584
[19] Nie S A, Li H, Yang X R, et al. Nitrogen loss by anaerobic oxidation of ammonium in rice rhizosphere. The Isme Journal, 2015, 9(9): 2059-2067
[20] Song M, Luo C, Jiang L, et al. Identification of benzo[a]pyrene-metabolizing bacteria in forest soils by using DNA-based stable-isotope probing. Applied &Environmental Microbiology, 2015, 81(21): 7368-7376
[21] Lv B Y, Xing M Y, Yang J Y, et al. Pyrosequencing reveals bacterial community differences in composting and vermicomposting on the stabilization of mixed sewage sludge and cattle dung. Applied Microbiology &Biotechnology, 2015, 99(24): 10703-10712
[22] Wang N, Ding L J, Xu H J, et al. Variability in responses of bacterial communities and nitrogen oxide emission to urea fertilization among various flooded paddy soils[J]. FEMS Microbiology Ecology, 2015, 91: 1-9
[23] Shen C, Xiong J, Zhang H, et al. Soil pH drives the spatial distribution of bacterial communities along elevation on Changbai Mountain[J]. Soil Biology and Biochemistry,2013, 57: 204-211
[24] 闫洪亮, 王胜楠, 邹洪涛, 等. 秸秆深还田两年对东北半干旱区土壤有机质、pH值及微团聚体的影响[J]. 水土保持研究, 2013, 20(4): 44-48
[25] Wang W, Lai D Y F, Wang C, et al. Effects of rice straw incorporation on active soil organic carbon pools in a subtropical paddy field. Soil & Tillage Research, 2015,152: 8-16
[26] Li F, Wang Z, Dai J, et al. Fate of nitrogen from green manure, straw, and fertilizer applied to wheat under different summer fallow management strategies in dryland. Biology & Fertility of Soils, 2015, 51(7): 1-12
[27] 张丽, 张磊, 鲁剑巍, 等. 添加尿素和秸秆对三熟制水旱轮作土壤各形态氮素的影响. 土壤, 2017, 49(1): 13-18
[28] Weber K A, Achenbach L A, Coates J D. Microorganisms pumping iron: Anaerobic microbial iron oxidation and reduction. Nature Reviews Microbiology, 2006, 4:752-764
[29] Wan X, Huang Z, He Z, et al. Soil C:N ratio is the major determinant of soil microbial community structure in subtropical coniferous and broadleaf forest plantations.Plant and Soil, 2015, 387: 103-116

